清华大学施一公教授新年第一篇《PNAS》文章
2017-02-09 万纹 生物通
三年前,清华大学生科院施一公教授研究组在PNAS杂志上发表论文,揭示出了Apaf-1凋亡体(apoptosome)激活caspase-9的分子机制,但关于Apaf-1的作用机制依然知之甚少。今年1月,这一研究组再次于PNAS发文,通过分析与caspase-9结合的Apaf-1凋亡体结构,以及在Apaf-1凋亡体存在情况下的caspase-9生化活性,进一步解析了Apaf-1的作用机制。
细胞凋亡是由引发剂和效应物caspase的连续激活进行的,在哺乳动物细胞中,引发剂caspase-9负责效应物caspase-3的激活,这个过程主要依赖于一个特定的多蛋白复合物。对于caspase-9来说,这个多蛋白复合物被称为凋亡体,包括凋亡蛋白酶激活因子1(Apaf-1)和细胞色素c(CytC)之间的一个异二聚体的七个拷贝。
一直以来,科学家们都希望能弄清楚Apaf-1凋亡体激活caspase-9的分子机制。此前施一公教授研究组发现以往报道的Apaf-1 CARD(caspase recruitment domain)结构域与caspase-9 CARD之间1:1相互作用不足以激活caspase-9。Apaf-1 CARD和caspase-9之间形成多聚复合体是caspase-9激活的基础,而三种类型的独特界面是多聚复合体形成的必要条件。而且,研究人员证实了多聚复合体上的另一个表面区域在caspase-9激活发挥必不可少的作用。
在此基础上,这一组研究人员进一步报道了一个凋亡全酶的冷冻电子显微镜(cryo-EM)结构,并以此为指导进行了相应的生物化学分析,这些结构与生化分析结果表明,凋亡体至少能部分通过抑制性CARD结构域的螯合作用来激活caspase-9。
研究人员表示此前的机械研究大量依赖于在没有Apaf-1凋亡体存在的情况下改造的caspase-9,而这项研究中,他们分析了在Apaf-1凋亡体存在情况下的caspase-9活性的生物化学,结果表明Apaf-1凋亡体能通过两种方式来激活caspase-9:一种是由Caspase募集结构域(Caspase recruitment domain,CARD)介导的抑制作用,另外一种是刺激蛋白酶结构域的催化活性。
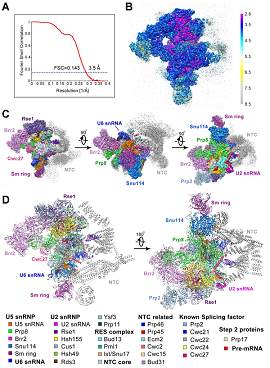
此外,此前施一公教授研究组还在Genes & Development上发文,通过单粒子冷冻电镜分析,在3.8 Å的原子级分辨率上,确定了一个完整的哺乳动物凋亡体Apaf-1的三维结构。
研究人员确定了一个完整的哺乳动物凋亡体的原子结构(3.8 Å分辨率)。结构分析连同结构引导的生化表征,揭示了细胞色素c如何通过与WD40重复的特异性相互作用,而解除Apaf-1的自动抑制。与自动抑制的Apaf-1的结构对比,揭示了dATP结合如何触发一系列的构象变化,从而导致凋亡体的形成。总而言之,这些研究结果,阐释了细胞色素c和dATP介导的Apaf-1激活的分子机制。
原始出处:
Yigong Shi,Yini Lia, Mengying Zhoua, Qi Hua,et al.Mechanistic insights into caspase-9 activation by the structure of the apoptosome holoenzyme. PNAS.December 17, 2016.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#PNAS#
0
#清华#
0
很好的学习资料,感谢了。
76
点赞党来了
79