维生素片又致癌啦?!Nature子刊:这种常见的维生素,恐促进肿瘤的生长和增殖!饮食限制即可阻碍
2023-11-17 Swagpp MedSci原创 发表于上海
Nature Metabolism:高表达的癌症驱动基因MYC的乳腺肿瘤细胞严重依赖维生素B5,进行细胞的生长和存活;相反,饮食限制维生素B5则会逆转MYC介导的代谢变化,阻碍肿瘤生长。
口腔溃疡?吃点维生素B!消化不良?吃点维生素B!神经炎症?吃点维生素B!
B族维生素的重要性越来越为人们熟知,是维持人体正常机能与代谢活动不可或缺的物质。由于人体无法自行合成维生素B,需要通过膳食进行补充,因此很多人担心平时生活中吃不够而选择了维生素补充剂。
膳食补充维生素B固然重要,但维生素B是个大家族,包括了硫胺素(维生素B1)、核黄素(维生素B2)、烟酸(维生素B3)、泛酸(维生素B5)等等,它们各司其职,发挥着不同的作用。
然而,真的有必要“一网打尽”每一种都去补吗?会不会得不偿失,反而对健康造成损害呢?
举例来说,维生素B5,又称泛酸,该单词来源于希腊语“无处不在的酸类物质”,在自然界的分布极其广泛。泛酸参与体内多种代谢,促进糖、脂肪、氨基酸中的乙酸分解,同时也是多酶复合物脂肪酸合酶的组成成分。
泛酸的重要性不言而喻,但过多的补充反而可能出现“物极必反”的情况。近日,Nature Metabolism上最新刊登的研究显示:高表达的癌症驱动基因MYC的乳腺肿瘤细胞严重依赖维生素B5,进行细胞的生长和存活;相反,饮食限制维生素B5则会逆转MYC介导的代谢变化,阻碍肿瘤生长。
因此,这维生素B5,还真不必随意补充。

https://doi.org/10.1038/s42255-023-00915-7
在人类癌症中,有一种名为MYC的原癌基因——MYC也是一种多效应转录因子,正常情况下,MYC能影响多个基因的表达,调节细胞分化增殖;但在多种肿瘤恶化的过程中,MYC发生突变或多度表达,较高MYC表达水平的克隆往往以亚克隆的形式出现,与癌症分级程度高和生存率低相关。
为了找出MYC介导代谢重构的核心代谢物,研究者模拟人类癌症的分析特征构建了一批肿瘤小鼠,从中提取了大量的代谢通路,并分析所有统计学上出现明显变化的代谢物。
关联性分析显示,维生素B5与乳腺肿瘤中的MYC水平存在最强的相关性,其化学结构是通过化学标准和肿瘤组织进行串联质谱系统确认得到。
同时,这一发现的临床相关性也得到了证实——研究者使用人类患者来源的异种移植物(PDXs),将其皮下移植到免疫功能低下的小鼠体内。
结果显示,具有最高MYC水平或强MYC转录特征的PDXs,显示出泛酸水平的显著增加。此外,肿瘤微卫星不稳定性(MSI)检测也明确,肿瘤间和肿瘤内的MYC高表达区域中,泛酸水平明显升高。
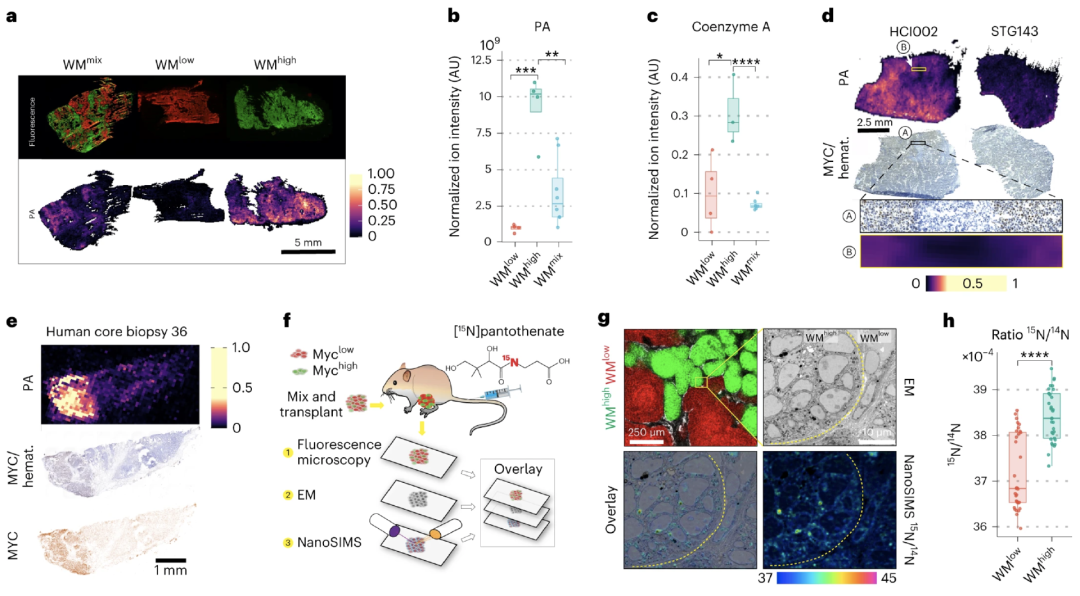
泛酸与乳腺肿瘤中的MYC表达相关
事实上,泛酸(即维生素B5,又称PA)的重要意义在于:PA是辅酶A(CoA)的前体。
CoA是一种硫醇,能通过形成硫酯而作为羧基的活化剂。作为PA的活性形式,CoA参与到多种关键代谢途径中,比如:三羧酸循环和脂肪酸的生物合成以及氧化等等。
基于上述研究中的发现,即MYC与PA代谢之间的联系存在临床意义和普遍效度,研究者进一步聚焦于“PA-CoA轴参与MYC介导的新陈代谢”的全过程。
解吸电流聚焦电离(DEFFI)质谱成像(MSI)和荧光显微镜观察结果显示,具有MYC-ER结构的肿瘤内三羧酸循环活性明显增加。这意味着,MYC活性的增加能够提升PA的吸收和代谢,从而促进三羧酸循环的活跃性,以及代谢产物的摄取,进一步刺激了肿瘤细胞的高速生长。
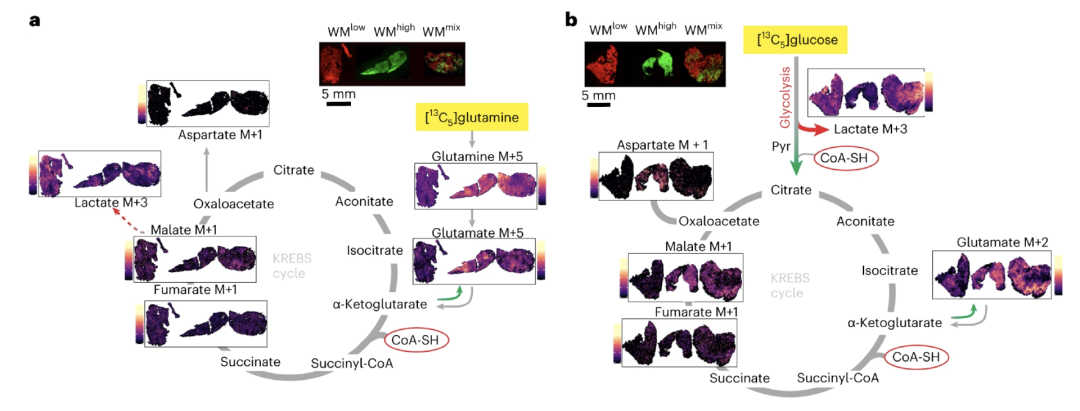
泛酸与高MYC区域有关
既然肿瘤生长对维生素B5有着高度依赖性,那么降低体内泛酸的含量是否能有效抑制肿瘤的生长呢?
为了证实这一观点,研究者通过饮食控制了乳腺癌小鼠体内的全身PA水平,将小鼠分为无PA饮食或正常对照组饮食。
结果不出所料,在正常对照组中,具有MYC-ER结构的乳腺癌小鼠体内的肿瘤细胞保持强烈的增殖趋势;但相反在缺乏PA的情况下,便会丧失这种生长优势,甚至能增加肿瘤细胞的死亡。
研究者进一步采用液相色谱与串联质谱联用(LC-MS)分析了两组小鼠的肿瘤组织情况,发现随着PA的减少,CoA的含量也显著下降。不仅如此,大多数糖酵解中间产物、三羧酸循环中间产物、必需氨基酸和非必需氨基酸以及核苷酸均大大减少。
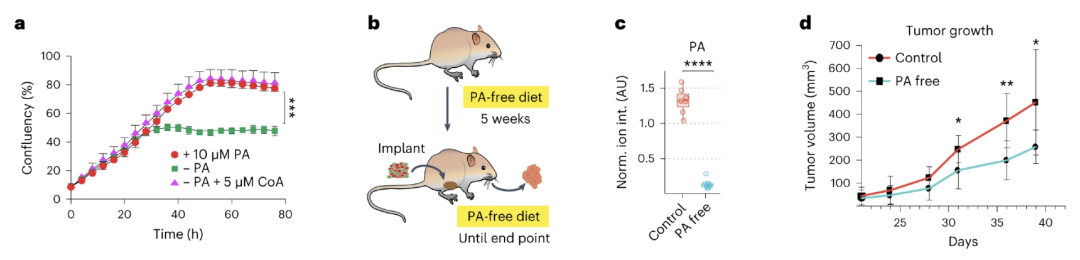
不同喂食方式下的肿瘤生长差异
机制层面显示,MYC能以细胞自主方式增强PA吸收的能力,而这个过程与多维生素转运载体SLC5A6的存在息息相关。
简单来说,MYC可以直接与Slc5a6启动子区域的E-box结合,激活SLC5A6的转录调节。而SLC5A6能控制细胞内的PA水平,即当过表达SLC5A6时,PA的水平急剧增加,进而增强肿瘤细胞的代谢和生长潜力。
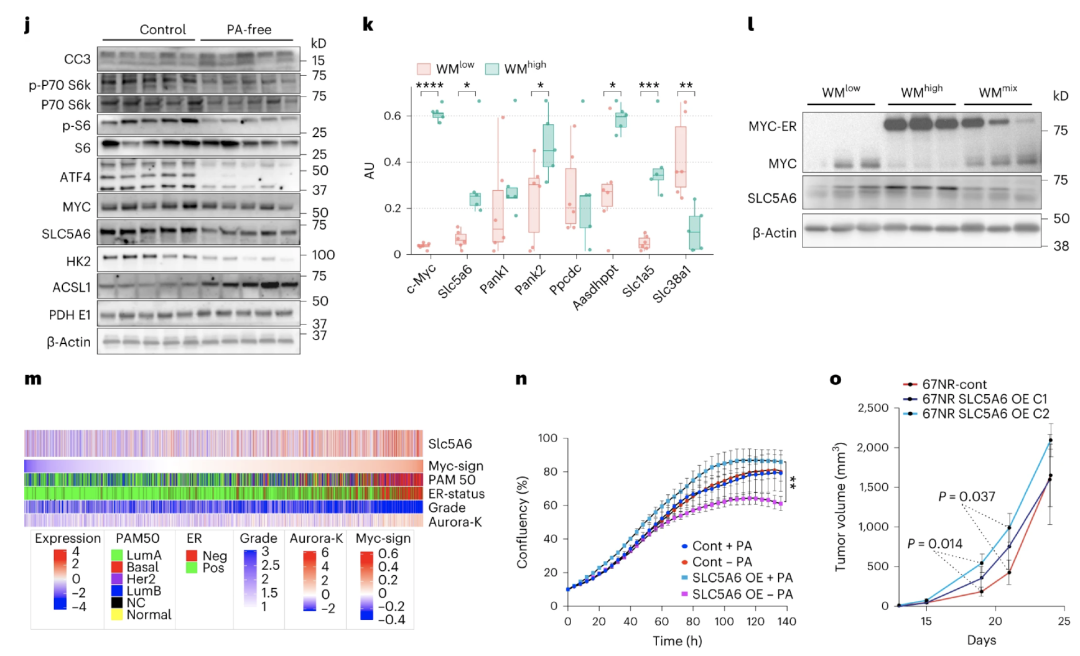
MYC通过调节SLC5A6表达来控制PA
到这里整个影响链路就很清晰了:MYC通过直接上调转运体SLC5A6,提高了肿瘤内的PA水平;而作为CoA的前体,PA的增加又会导致更多的CoA合成,加剧了三羧酸循环活动,诱导癌症细胞的生长和增殖。
但相反,如果限制饮食中维生素B5的摄入,则能有效逆转MYC介导的细胞代谢变化,使肿瘤生长受阻。
这项研究的重要意义在于,由于化疗会引起一定的胃肠道副作用,从而引发维生素的缺乏,所以临床上往往会给肿瘤患者提供一定的维生素补充剂。但本项研究则给出一记警示,并非所有维生素都需要补充,甚至限制维生素B5的水平将有助于阻碍癌细胞的增殖。
因此,补充维生素不一定能与“健康”划上等号,均衡膳食才是王道,切莫“聪明反被聪明误”啦!
参考资料:
Kreuzaler P, Inglese P, Ghanate A, Gjelaj E, Wu V, Panina Y, Mendez-Lucas A, MacLachlan C, Patani N, Hubert CB, Huang H, Greenidge G, Rueda OM, Taylor AJ, Karali E, Kazanc E, Spicer A, Dexter A, Lin W, Thompson D, Silva Dos Santos M, Calvani E, Legrave N, Ellis JK, Greenwood W, Green M, Nye E, Still E; CRUK Rosetta Grand Challenge Consortium; Barry S, Goodwin RJA, Bruna A, Caldas C, MacRae J, de Carvalho LPS, Poulogiannis G, McMahon G, Takats Z, Bunch J, Yuneva M. Vitamin B5 supports MYC oncogenic metabolism and tumor progression in breast cancer. Nat Metab. 2023 Nov 9. doi: 10.1038/s42255-023-00915-7. Epub ahead of print. PMID: 37946084.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











维生素b致癌??
65
维生素过量也不好
44
#COA# #MYC# #维生素B5# #泛酸#
67