Nat Commun:激动性CD40疗法会损害胶质瘤对检查点阻断的反应性
2021-07-06 haibei MedSci原创
在临床前胶质瘤模型中,αCD40的全身递送会诱导功能低下的T细胞并损害对免疫检查点抑制剂的反应。
胶质母细胞瘤(GBM),或四级胶质瘤,是成人中最常见的恶性原发性脑肿瘤。尽管目前有手术、放疗、化疗以及最近在肿瘤治疗领域开发的多模式治疗策略,但是GBM患者的预后仍然不佳,中位生存期不到24个月。
虽然针对PD-1和CTLA-4的检查点抑制剂(CPI)在一些人类实体瘤和实验性小鼠胶质瘤模型中取得了临床成功,但它们对GBM患者的疗效被证明是有限的。这并不奇怪,因为大脑的免疫反应是适应敏感和免疫特化的微环境的。因此,需要专门针对脑瘤微环境设计的治疗方法,以便对GBM进行有效的免疫反应。
胶质瘤被骨髓中的巨噬细胞和脑内的小胶质细胞高度浸润,这些巨噬细胞促进肿瘤生长并抑制免疫反应。CD40在几种抗原呈递细胞(APCs)上表达,激动性CD40抗体(αCD40)具有广泛的免疫刺激作用。事实上,已有的研究显示,αCD40可以使巨噬细胞偏向于肿瘤抑制,并增强树突状细胞(DCs)的抗原表达。此外,CD40对B细胞的激活可以调节活化、抗体产生、生殖中心的形成和抗原表达。

目前,αCD40抗体正在针对众多实体瘤进行临床开发。然而,关于它们在胶质瘤中的疗效,目前有相互矛盾的证据,因为其结果因实验模型和组合治疗方案而异。彻底了解αCD40疗法如何影响大脑免疫反应的不同部分,对于评估其治疗胶质瘤的潜力是必要的。
最近,研究人员在Nature Communications杂志发文,证明了在临床前胶质瘤模型中,αCD40的系统性递送会诱导脑膜组织附近的三级淋巴结构(TLS)的形成。在未接受治疗的胶质瘤患者中,TLS的存在与T细胞浸润的增加有关。
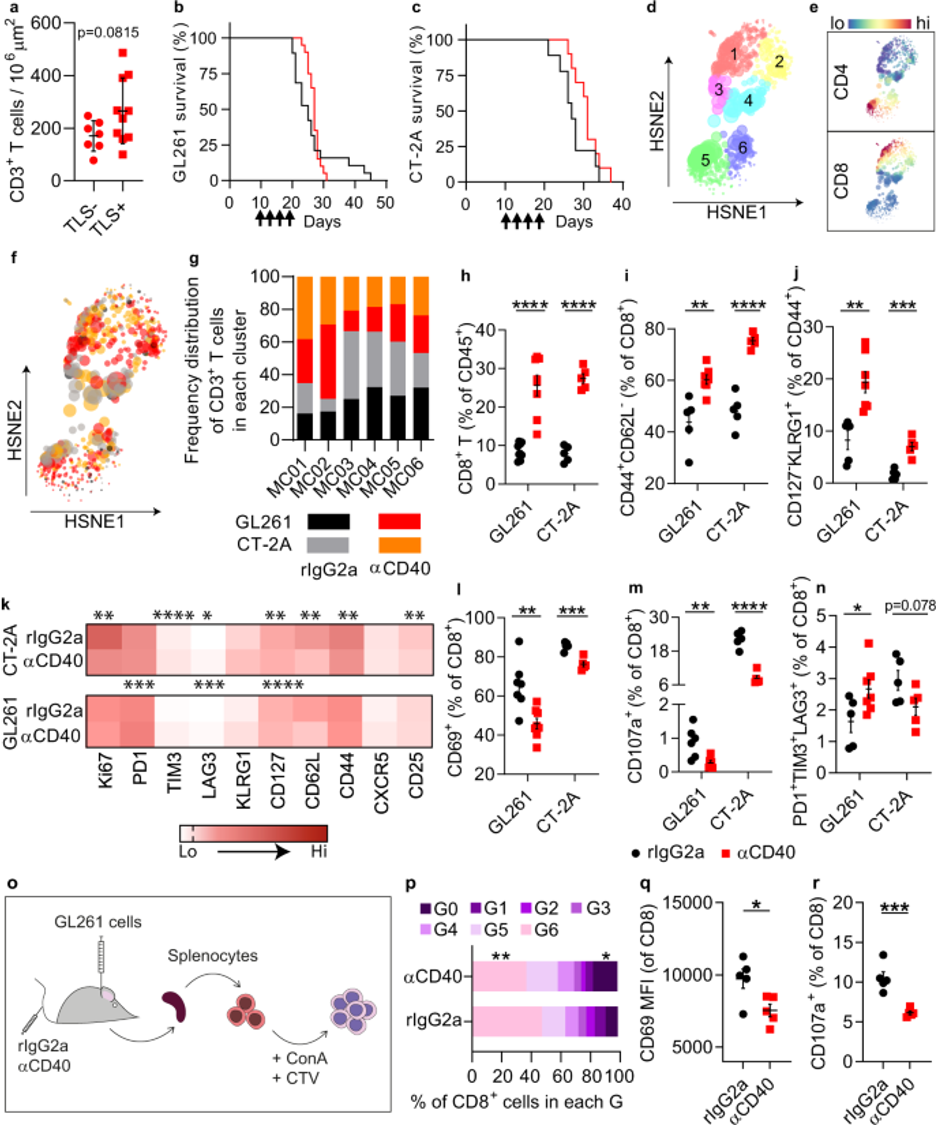
αCD40治疗导致临床前胶质瘤模型中的细胞毒性T细胞反应受到抑制
然而,在临床前胶质瘤模型中,αCD40的全身递送会诱导功能低下的T细胞并损害对免疫检查点抑制剂的反应。这与αCD40治疗后全身诱导抑制性CD11b+B细胞有关,这些细胞在肿瘤微环境中积累。
因此,该研究结果揭示了αCD40治疗对胶质瘤的多种影响,并揭示了免疫疗法可以调节大脑中TLS的形成,为未来调节免疫反应提供了机会。
原始出处:
Luuk van Hooren et al. Agonistic CD40 therapy induces tertiary lymphoid structures but impairs responses to checkpoint blockade in glioma. Nature Communications (2021).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#COMMUN#
137
#Nat#
67
#CD4#
92
#阻断#
81
#反应性#
105
1
141
厉害厉害
88