NATURE:什么导致癌细胞铁死亡?
2019-07-27 海北 MedSci原创
铁死亡是由细胞代谢和铁依赖性脂质过氧化作用驱动的细胞死亡过程,其在缺血性器官损伤和癌症等疾病中发挥作用。
铁死亡是由细胞代谢和铁依赖性脂质过氧化作用驱动的细胞死亡过程,其在缺血性器官损伤和癌症等疾病中发挥作用。
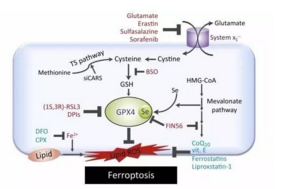
谷胱甘肽过氧化物酶4(GPX4)是一种中枢调节剂,通过中和脂质过氧化物来保护细胞,脂质过氧化物是细胞代谢的副产物。
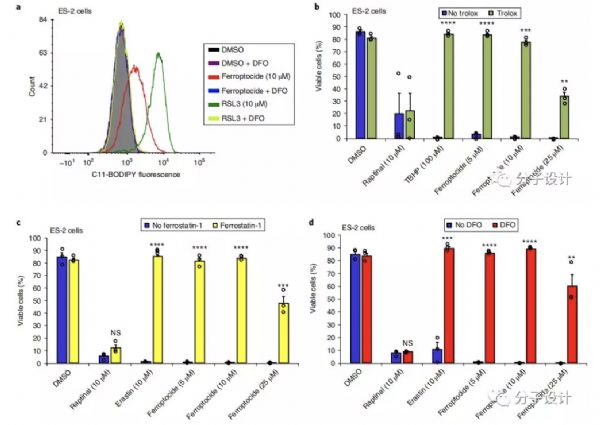
直接抑制GPX4,或通过耗尽其底物谷胱甘肽或谷胱甘肽(如半胱氨酸)的构建块而间接抑制GPX4可引发铁死亡。
铁死亡有助于几种肿瘤抑制因子,如p53,BAP1和富马酸酶,的抗肿瘤功能。与直觉相反,易于转移,并且通常对各种治疗具有抗性的间充质癌细胞对于铁死亡非常敏感。
最近,研究人员发现,铁蛋白沉积可以通过钙粘蛋白介导的细胞间相互作用非细胞自主调节。
在上皮细胞中,由E-钙粘蛋白介导的这种相互作用通过激活细胞内NF2(也称为merlin)和Hippo信号传导途径来抑制铁死亡。拮抗该信号轴允许原癌基因转录共激活因子YAP通过上调几种铁死亡调节剂(包括ACSL4和TFRC)来促进细胞凋亡。
这一发现提供了对具有间充质或转移性质的癌细胞对铁死亡高度敏感的观察结果的机制见解。值得注意的是,类似的机制也调节一些非上皮细胞中的铁死亡。
最后,肿瘤抑制因子NF2的遗传失活是间皮瘤中常见的致瘤事件,使得癌细胞在恶性间皮瘤的原位小鼠模型中对铁死亡更敏感。
因此,该研究结果证明了细胞间相互作用和细胞内NF2-YAP信号在决定铁蛋白死亡中的作用,并且还表明NF2-YAP信号传导中的恶性突变可以预测癌细胞对未来诱导铁死亡的治疗的反应性。
原始出处:
Wu J et al. Intercellular interaction dictates cancer cell ferroptosis via NF2-YAP signalling. NATURE, 2019; DOI: 10.1038/s41586-019-1426-6.
本文系梅斯医学(MedSci)原创编译整理,转载需授权!
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Nat#
48
#癌细胞#
70
#致癌#
60