Cell Host Microbe:科学家在H5N6禽流感病毒起源和进化机制研究中取得突破
2016-12-08 微生物研究所 微生物研究所
H5N6流感病毒的进化路径自2014年首次报道人感染H5N6流感病毒以来,H5N6不断在我国及东南亚国家家禽中暴发流行,并持续出现人感染病例。H5N6作为一种新型流感病毒,其基因起源、进化机制和流行趋势尚缺乏系统和深入的研究。中国科学院流感研究与预警中心在中国科学院院士高福的带领下,通过中科院微生物研究所病原微生物与免疫性重点实验室与中科院武汉病毒研究所、深圳市第三人民医院、泰山医学院、吉林大学、
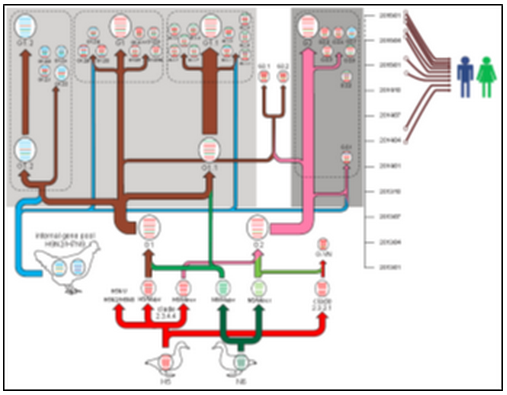
H5N6流感病毒的进化路径
自2014年首次报道人感染H5N6流感病毒以来,H5N6不断在我国及东南亚国家家禽中暴发流行,并持续出现人感染病例。H5N6作为一种新型流感病毒,其基因起源、进化机制和流行趋势尚缺乏系统和深入的研究。中国科学院流感研究与预警中心在中国科学院院士高福的带领下,通过中科院微生物研究所病原微生物与免疫性重点实验室与中科院武汉病毒研究所、深圳市第三人民医院、泰山医学院、吉林大学、福建农林科学院等成员单位的密切合作,自2014年起对我国16个省份和地区39个市县的禽流感病毒流行状况进行持续监测。监测数据显示,我国北方地区主要以H9N2为主,长三角、华中、华南地区有一定比例H7N9存在,而在长三角地区以南H5N6比重增大,逐渐取代H5N1成为优势流行毒株。病毒与宿主相关性分析表明,H5N6和H6N6是鸭群中主要流行的病毒亚型;而鸡群中则以H9N2流行为主。鸭群在H5N6的产生和传播过程中发挥了重要作用。
进一步的基因起源与遗传进化分析显示:H5N6源于H5Ny与H6N6的重配;H5和N6基因的组合模式表现出进化谱系特异性;内部基因在病毒的流行和传播中,不断与低致病力禽流感病毒重配,形成至少34种基因型,并且自然筛选出4种优势基因型(G1、G2、G1.1、G1.2)。G1和G2是最早形成的基因型,G1.1在G1基础上重配了H6病毒的PB2基因,G1.2内部基因来源于H9N2/H7N9。目前感染人的病毒分别属于此4种基因型。值得注意的是,G1.2与H7N9和H10N8病毒基因组成形式类似,且至少造成5例人感染。人主要通过直接接触带毒禽类或污染物而感染,尚未实现人→人传播;同时H5N6病毒已经在猪、猫、野鸟中被分离发现。H5N6对家禽、野鸟、哺乳动物及人的感染,给我们敲响了警钟,必须开展积极有效的防控措施,阻止病毒在家禽中的传播范围继续扩大,从而降低对人的感染几率。
该研究揭示了H5N6病毒的进化规律和流行趋势,对我国和世界禽流感的防控具有指导意义。该项成果作为封面文章于12月1日在线发表于国际学术刊物Cell Host & Microbe上。中科院流感研究与预警中心、微生物所流感技术平台负责人毕玉海为第一作者,武汉病毒所陈全姣、微生物所汪千力、武汉病毒所陈建军为并列第一作者。高福为核心通讯作者,中科院微生物所研究员刘翟、泰山医学院教授史卫峰、深圳市第三人民医院教授刘映霞为并列通讯作者。
原始出处:
Fu Gao,et al. Genesis, Evolution and Prevalence of H5N6 Avian Influenza Viruses in China. Cell Host&Microbe.2016
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Micro#
47
#CRO#
54
#机制研究#
58
#禽流感病#
53
#Cell#
53
#H5N6#
60
#进化机制#
51
#CEL#
0
继续关注!!!!
57
#禽流感病毒#
122