读书报告 | 吉西他滨联合顺铂治疗后鼻咽癌免疫微环境的变化
2023-11-08 iCombo iCombo 发表于上海
本研究提供了GP化疗后肿瘤的高分辨率地图,全面揭示了以B细胞为中心的抗肿瘤免疫作用,也确定并验证了ILB可能是接受GP方案治疗的鼻咽癌患者的潜在生物标志物。
导读
吉西他滨联合顺铂(GP)的化疗方案是鼻咽癌(NPC)的标准治疗,其临床活性的基础机制尚不清楚。对此,中山大学肿瘤防治中心马俊教授课题组使用未经治疗的和GP化疗后的配对鼻咽癌样本(n=15对),开展了单细胞RNA测序(scRNA-seq)并结合T细胞和B细胞受体测序(scTCR-seq和scBCR-seq),揭示了GP化疗激活了先天样B细胞(ILB)主导的抗肿瘤免疫应答。
吉西他滨联合顺铂化疗诱导的DNA片段激活了STING -I型干扰素通路,增加了癌细胞中MHC I类分子的表达,同时通过Toll样受体9信号通路诱导innate-like B cell(ILB)为主的免疫应答。在缺乏生发中心的肿瘤组织中ILB通过ICOSL-ICOS轴扩增TH1和TFH,最终强化三级淋巴器官样结构中的细胞毒性T细胞。此外,本研究还使用了该团队已经发表的多中心III期临床试验(NCT01872962, n = 139)中收集到的患者样本,结果显示:在接受GP化疗的鼻咽癌患者亚组中,肿瘤浸润ILBs频率增加与良好的DFS和OS显著相关。在接受GP方案和免疫联合治疗的鼻咽癌患者(n=380)中,ILB也是提示良好预后的因素。总之,本研究提供了GP化疗后肿瘤的高分辨率地图,全面揭示了以B细胞为中心的抗肿瘤免疫作用,也确定并验证了ILB可能是接受GP方案治疗的鼻咽癌患者的潜在生物标志物,这些发现将一定程度上影响鼻咽癌患者未来的临床管理(Nat Med.2023 Jun;29(6):1424-1436. doi: 10.1038/s41591-023-02369-6)。
研究背景
化疗的疗效不仅涉及直接的细胞毒作用,同时也依赖于激活的抗肿瘤免疫应答,但是有效化疗如何驱动微环境成分,从而引发最佳抗肿瘤免疫应答尚不清楚。
最近发现B细胞除了分泌抗体之外,还能作为APCs启动滤泡辅助性T细胞应答(肺癌)。目前,B细胞能否触发抗肿瘤T细胞应答,以及化疗如何改变B细胞的环境信号和功能表型的研究还很匮乏。
GP方案广泛应用于肺癌、胰腺癌、乳腺癌和头颈肿瘤,虽然它对多数癌症的疗效相当有限,但该课题组最近发现,局晚鼻咽癌(NPC)患者对GP反应良好,总响应率94.5%,5年OS率为89.7%。
本文全面表征了NPC患者经GP化疗后TME的演变模式,并鉴定出了以前未被识别的Biomarker--先天样B细胞(ILBs),后者主导GP化疗后的抗肿瘤免疫应答。
GP化疗重塑了鼻咽癌的肿瘤免疫环境

本文分析了来自15例鼻咽癌患者GP化疗前后的30个配对肿瘤样本中TIME的演变,使用scRNA-seq protocol获得了216893个单细胞转录组,同时在30个匹配样本中的6个构建了单细胞T和B细胞受体测序(scTCR-seq和scBCR-seq)文库
b:化疗前后,T细胞和B细胞构成了鼻咽癌样本中80%以上的免疫成分;与匹配的未治疗样本相比,化疗后的样本中,非浆细胞显著增加
d:新鲜样本中的(HLA)-A、HLA- b和HLA- c增加,特别是在有应答的肿瘤中
GP化疗增强鼻咽癌的抗原递呈能力
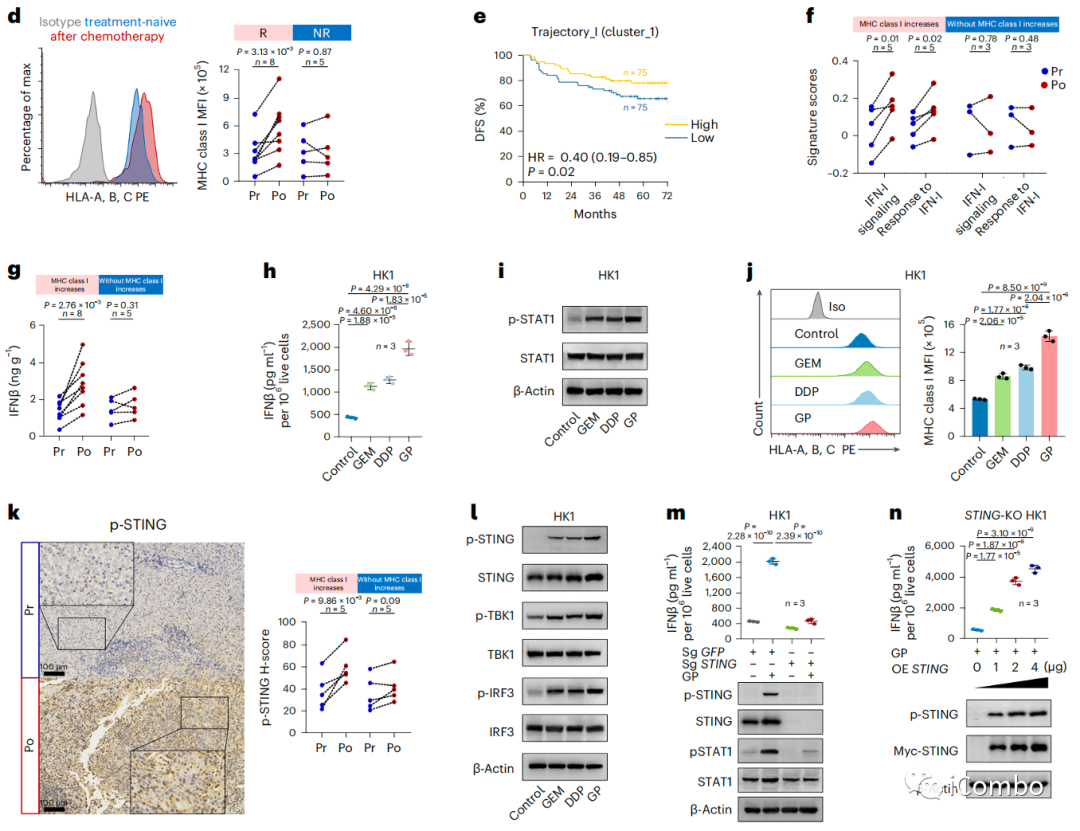
f:单细胞数据提示,在化疗后的鼻咽癌样本中,伴随MHC I类分子增加者,表现出IFN-I信号通路富集和对IFN-I通路应答
h/i:人鼻咽癌细胞株HK1和hon1分别用GEM、DDP或GP联合处理。暴露于GEM或DDP导致IFNβ产生增加,并显著激活STAT1,GEM和DDP联合产生协同作用
k:在化疗后MHC I增加的鼻咽癌样本中,观察到DNA sensor STING的表达显著增加并且STING的激活增强
l:GP化疗协同触发了鼻咽癌细胞中STING-TBK1-IRF3通路的激活
回补实验共同证明化疗可以通过STING依赖的IFN-I途径增强鼻咽癌细胞中MHC-I类相关抗原的递呈机制
GP化疗触发TH1和TFH细胞诱导的细胞毒性T淋巴细胞反应
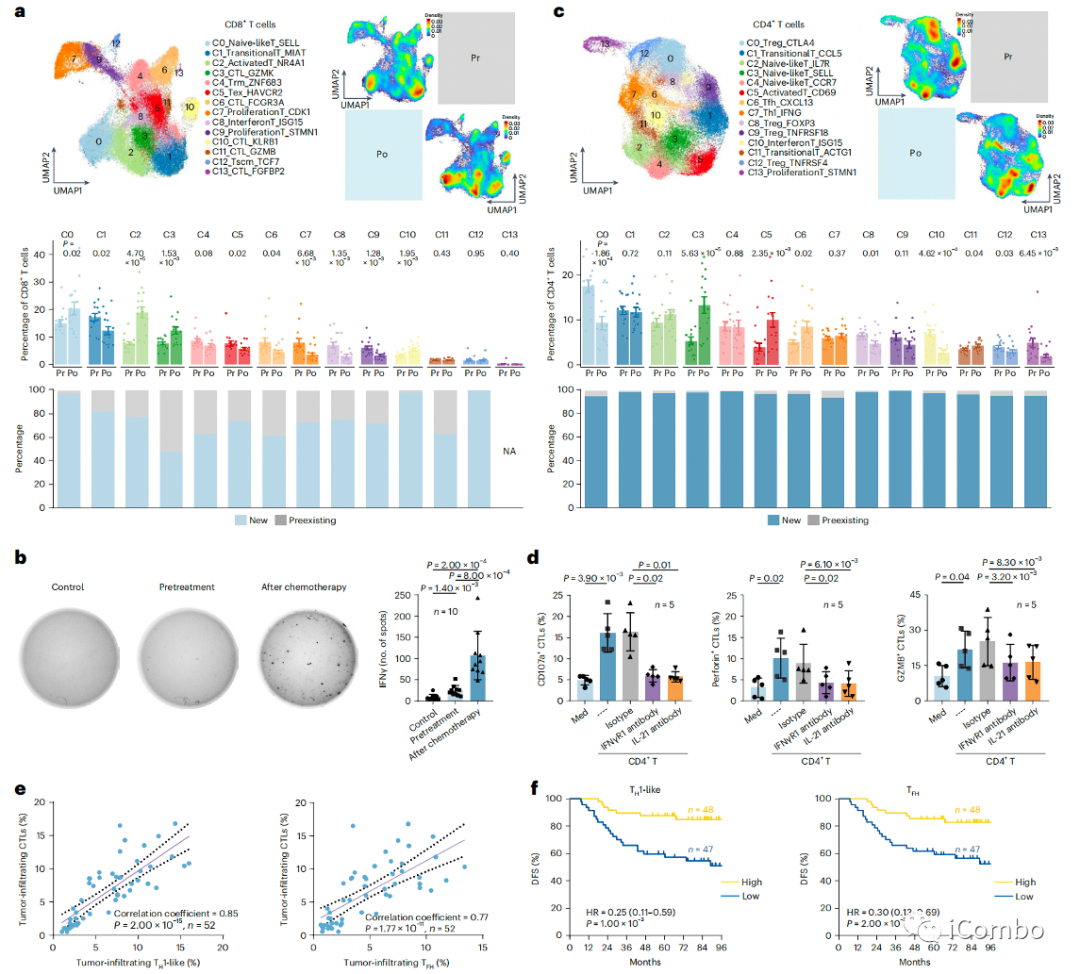
a:CD8+T细胞中鉴定出14个簇,化疗后naive-like CD8+T(Cluster_0)、activated CD8+T(Cluster_2)和两个CTL簇(Cluster_3和10)显著增加,而exhausted T cells(Cluster_5)百分比降低;在化疗后的鼻咽癌样本中,新克隆构成了70%以上的exhausted CD8+T细胞(Cluster_5),这表明新克隆可以在化疗后的鼻咽癌环境中经历早期激活和随后的耗竭
b:化疗后的肿瘤溶解物可比治疗前的肿瘤溶解物(Pr)更有效地触发自体CD8+T细胞产生IFN-γ
c:化疗后TFH(Cluster_6)和TH1(Cluster_7)的百分比增加,据报道这两种细胞均可维持CTL应答
e:在鼻咽癌样本中,TH1样细胞和TFH细胞与GZMB+CD8+T细胞呈正相关
鉴定ILB-dominant的抗肿瘤T细胞免疫
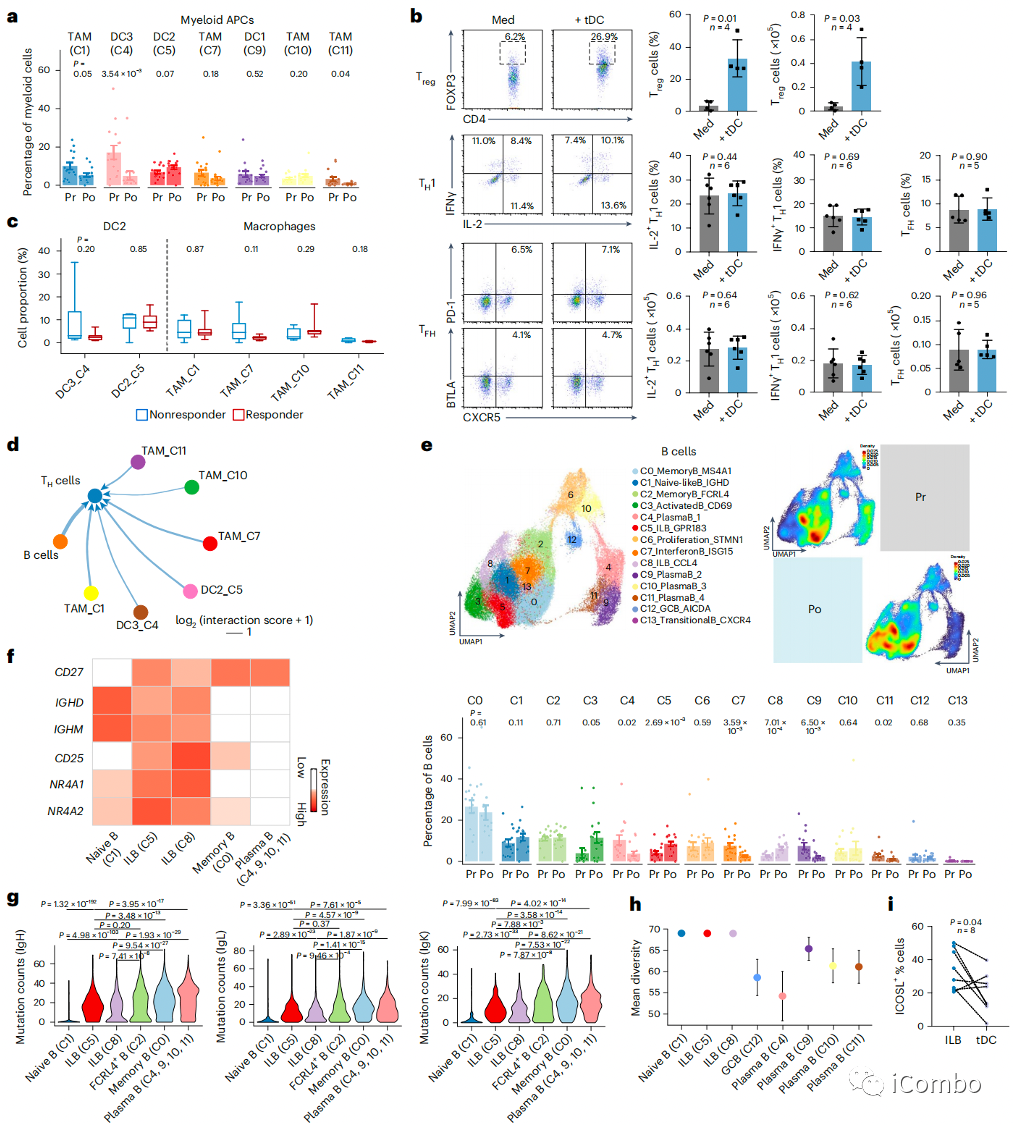
a:髓系APCs,包括经典DCs(Cluster_4, 5和9)和肿瘤相关巨噬细胞(TAMs)(Cluster_1, 7, 10和11)的频率在化疗后没有变化,甚至下降
b:从化疗后的肿瘤样本中分选出的DCs(肿瘤来源的DCs(tDCs))具有诱导Treg细胞的功能,而不是触发TH1和TFH细胞
c:化疗后肿瘤中髓系APC的丰度不能区分应答者和无应答者
f:以单细胞分辨率对不同B细胞簇进行分析发现了两个显著增加的B细胞簇(Cluster_5和8),两个簇均表现为高表达CD25、NR4A1和NR4A2的活化状态
f/g/h:与记忆B细胞和浆细胞相比,这些簇表现出显著较低的VH区转录本体细胞超突变和较高的BCR多样性, IGHD和IGHM的表达增加,表明这些细胞处于初始阶段
化疗后ILB聚集在三级淋巴器官样结构中
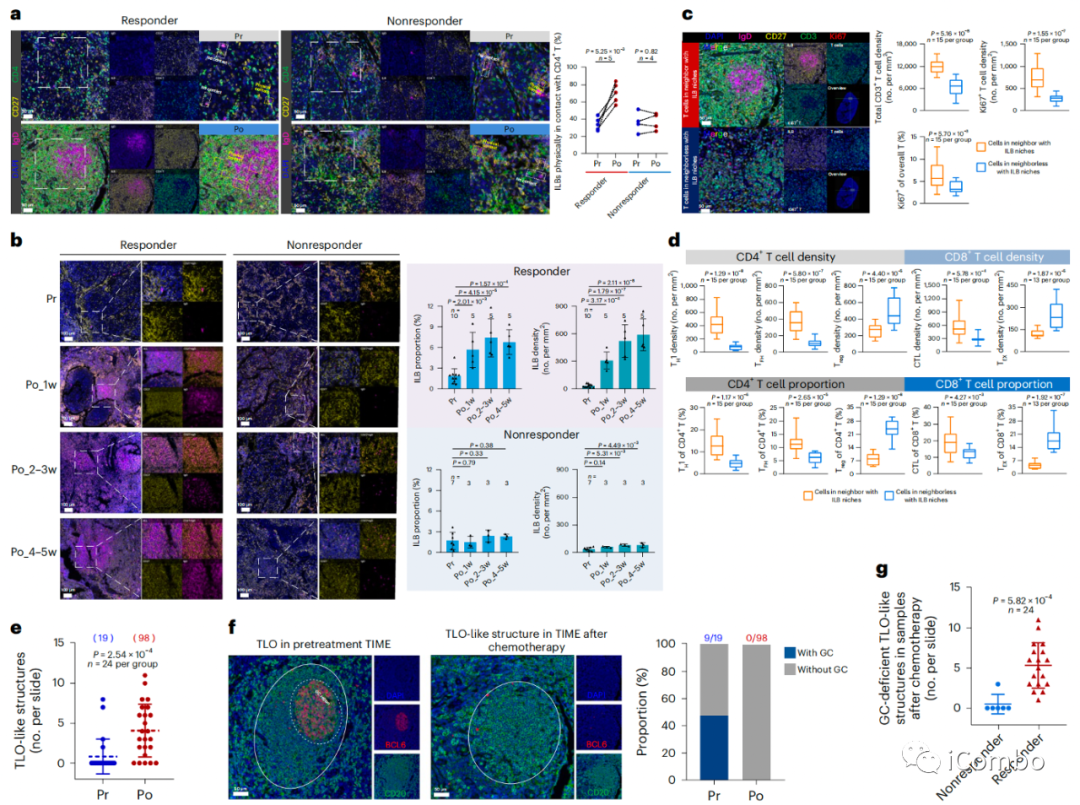
a:应答者的三级淋巴器官(TLO)样结构中出现了明显的ILB聚集,CD4+T细胞也密集浸润
b:开始化疗1w后,TLO样结构中ILB的频率显著增加,并且随着时间的推移,ILB仅在NPC无应答者中稍微增加
c:增殖T细胞的水平显著增加
d:在这些区域中检测到较多的TH1、TFH和GZMB+CD8+T细胞,但较少的Treg和HAVCR2+CD8+T细胞
e:化疗后样本中TLO样结构的数量显著增加
f/g:未经治疗的样本中,近50%的TLOs含有GC,而化疗后的肿瘤缺乏GC区(0/98)。重要的是,在应答者中,这些GC缺陷的TLOs样结构的数量显著较高
ILBs通过ICOSL-ICOS轴扩增TFH和TH1细胞
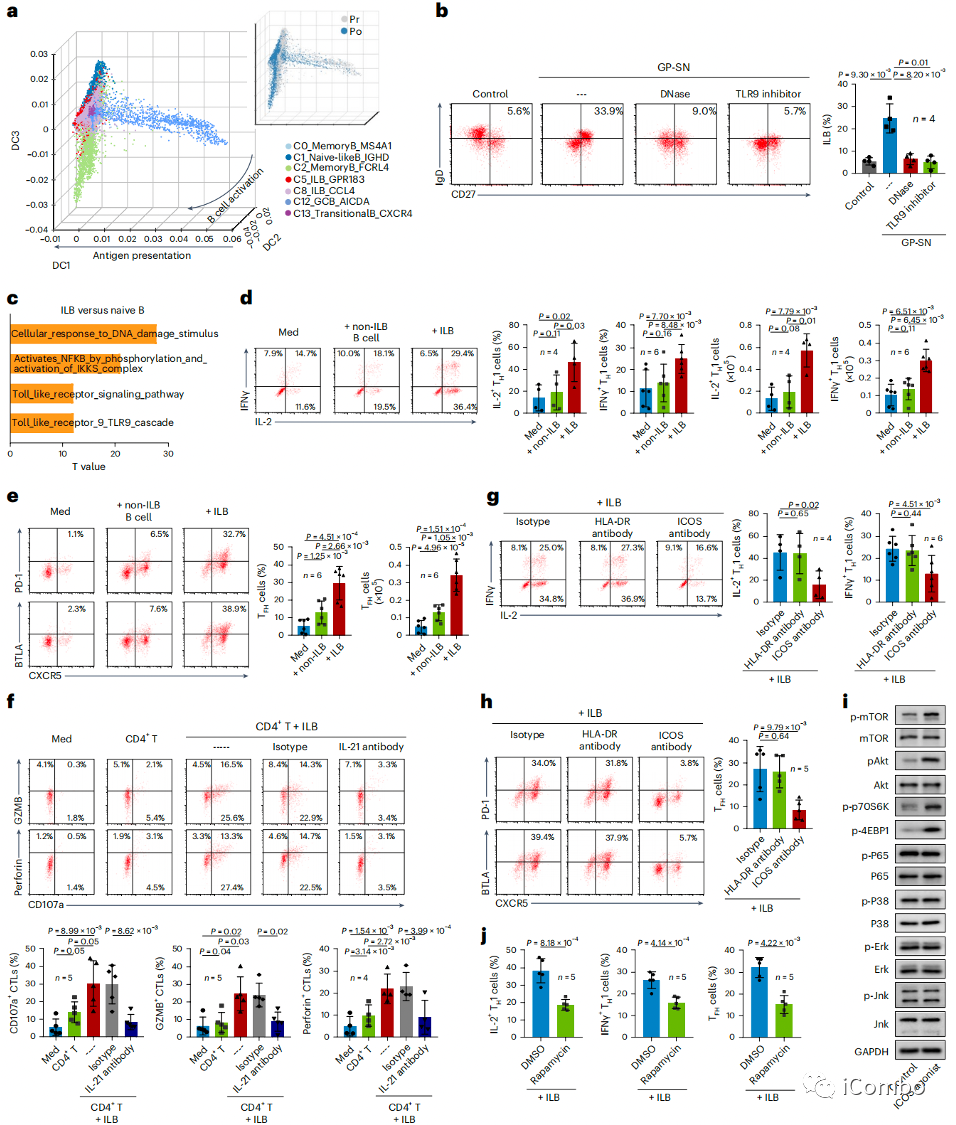
a:ILB呈现出从naive B细胞到化疗后逐步激活的稳定轨迹
d/e:在共培养体系中,与非ILB B细胞相比,ILB显示出更强的扩增IFNγ+IL-2+TH1和CXCR5+TFH细胞的潜力
g/h:为阐明ILB介导的TH1和TFH扩增机制,首先使用特异性抗体来屏蔽ILB中的HLA-DR信号,并发现这一治疗几乎没有改变ILB诱导的TH1和TFH扩增,这表明ILB以不依赖MHC II类分子的方式调节TH1和TFH
i/j:在肿瘤来源的CD4+T细胞的培养体系中添加ICOS激动剂可以稳定激活PI3K-Akt-mTOR通路,但对其他信号没有作用;与此同时,在CD4+T细胞中使用雷帕霉素抑制mTOR活化可显著减弱ILB介导的TH1和TFH扩增
ILBs可预测鼻咽癌患者接受含GP方案的疗效
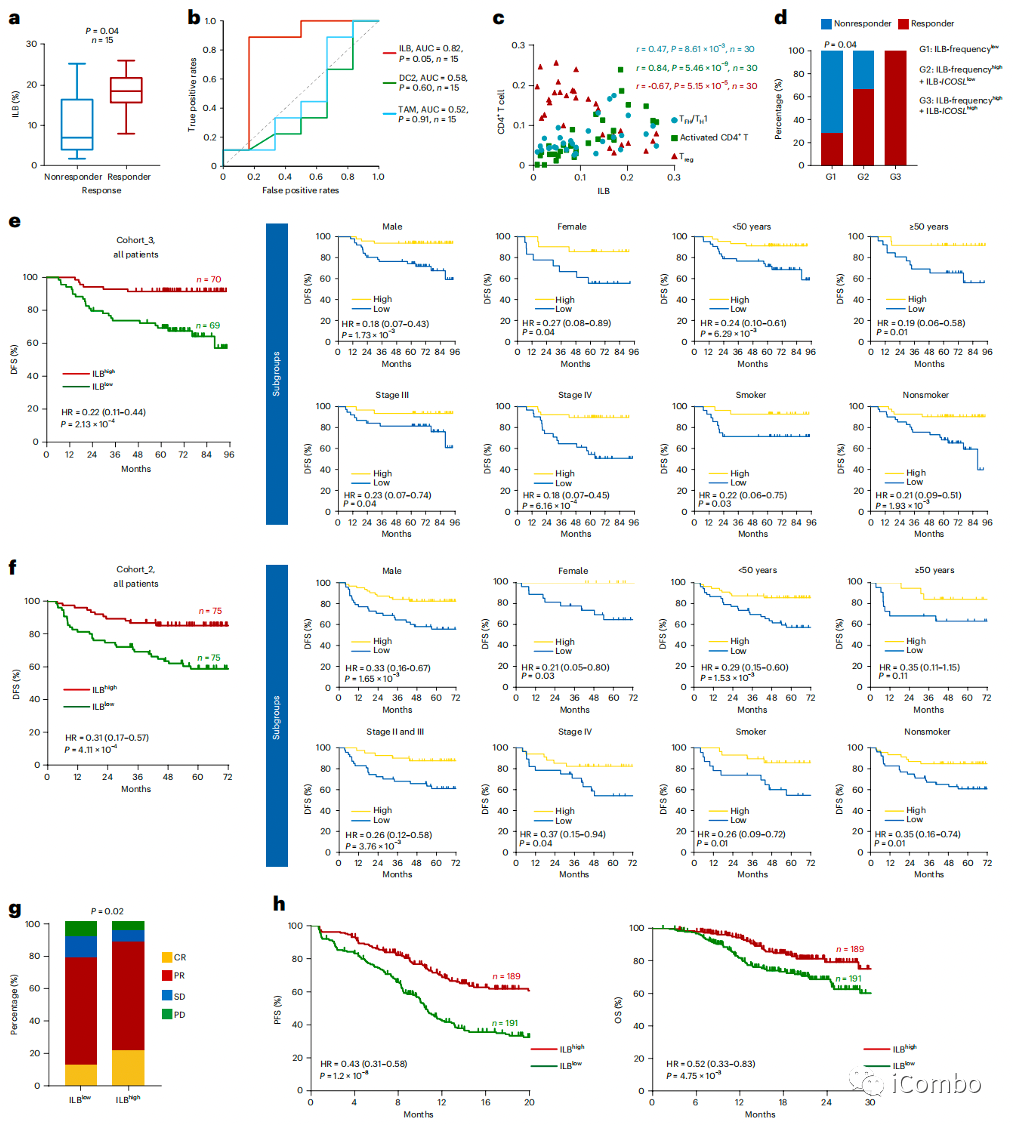
a:在SYSUCC_E队列中,化疗后样本中ILB的频率可以有效区分有应答和无应答样本(分别为18.5%和7.0%,P=0.04)
b:ILB预测化疗疗效优于髓系DC和巨噬细胞(曲线下面积(AUC)ILB=0.82, AUC DC2=0.58, AUC TAM=0.52)
c:ILB的频率与TFH、TH1和活化T细胞的频率呈正相关,但与Treg的细胞频率不相关
d:与ILB频率低或ILB中ICOSL低的患者相比,ICOSL高的ILB人群也表现出最有利的化疗反应
e:本研究使用了已发表的多中心3期临床试验(NCT01872962)中收集的患者样本后发现,在接受GP化疗的所有鼻咽癌患者亚组中,肿瘤浸润ILBs频率的增加与良好的DFS和OS显著相关
讨论
免疫反应的激活对于通过化疗实现长期肿瘤控制至关重要;然而,人们对临床有效的化疗如何引发肿瘤特异性免疫应答的知之甚少。在这项研究中,对化疗后的时间演变进行了全面的单细胞分析,提供了临床有效化疗诱导以B细胞为中心的抗肿瘤免疫应答的证据。
本文呼应了先前的报道,即化疗后TIME中的髓系DC在促进效应T细胞应答方面无效。
本文揭示了ILBs亚群通过ICOSL-ICOS轴触发TFH和TH1扩增,这进一步增强了CTL的效应功能。
以上数据为免疫疗法联合策略的临床管理提供了新的线索,表明除了旨在恢复传统DC功能的治疗外,在未来的实践中,激活特定B细胞亚群的方案与免疫疗法联合可能是一个有前途的选择。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言