Cell:酵母蛋白质可破坏淀粉样蛋白,为神经变性疾病治疗提供希望
2013-05-06 T.Shen 生物谷
2012年11月21日 讯 /生物谷BIOON/ --一些致命性的脑功能障碍,如帕金森疾病,是由于特殊蛋白质的错误折叠形成稳定的、不易溶解的淀粉样蛋白所引发的病症,淀粉样蛋白由于其原纤维非常稳定因此不易被破坏,比如,α-突触核蛋白形式的淀粉样蛋白质原纤维就可以在帕金森患者的路易氏小体中进行积累。变性蛋白质团的积累可以对环境压力,如热休克产生反应,进而产生更不稳定,混乱的蛋白结构。 Hsp10
2012年11月21日 讯 /生物谷BIOON/ --一些致命性的脑功能障碍,如帕金森疾病,是由于特殊蛋白质的错误折叠形成稳定的、不易溶解的淀粉样蛋白所引发的病症,淀粉样蛋白由于其原纤维非常稳定因此不易被破坏,比如,α-突触核蛋白形式的淀粉样蛋白质原纤维就可以在帕金森患者的路易氏小体中进行积累。变性蛋白质团的积累可以对环境压力,如热休克产生反应,进而产生更不稳定,混乱的蛋白结构。

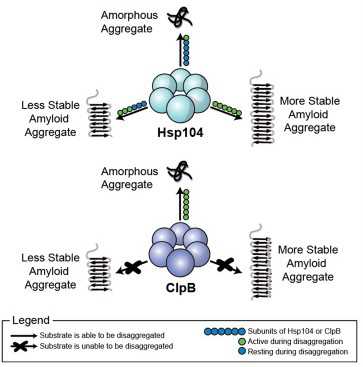
Hsp104,是酵母细胞中的一种酶类,其可以破坏淀粉样纤维和混乱的蛋白质团,刊登在近日的国际杂志Cell上的一篇研究报告中,来自宾夕法尼亚大学的研究者揭示了,Hsp104破坏粉样纤维及无序蛋白质团的分子机制。对于稳定的淀粉样结构来说,Hsp104需要其所有的6个亚单位结合在一起形成六聚物来将蛋白质团分离,相比,对于许多无定性的,非淀粉样的蛋白质团来说,Hsp104仅仅需要6个亚单位中的一个便可以正常发挥作用。
在细菌中的酶类-Hsp104,名为ClpB,相比酵母中的Hsp104作用完全不同。细菌中的ClpB可以使用所有的6个亚单位来破坏无定形的蛋白质团,但是并不能破坏淀粉样蛋白。
研究者表示,我们很惊奇的是,很多生物化学家认为Hsp104和ClpB六聚物以相同的方式来发挥作用的,Hsp104可以通过六聚体形成的通道,牵拉单一的多肽链来完成破坏蛋白质团的作用,更值得注意的是,Hsp104可以破坏不同类别的淀粉样蛋白质,包括和阿尔兹海默氏症(tau和Ab42),帕金森疾病(α-突触核蛋白)等疾病。
未来研究中,研究者希望以Hsp104作为潜在的治疗靶点来对相关疾病进行靶向治疗。相关研究成果由NIH等机构提供资助。
与神经相关的拓展阅读:
- Chest:依维莫司开启肺神经内分泌肿瘤治疗新时代
- JACC:第三军医大学新桥医院报道心脏副神经节瘤一例
- J Physiol:开发出治疗胃肠道疾病的神经递质靶向疗法
- Pain:抗焦虑药治疗神经性疼痛
- JCS:IPP5通过调控PP1和TGF-β信号通路抑制初级感觉神经元突起生长 更多信息请点击:有关神经更多资讯

Operational Plasticity Enables Hsp104 to Disaggregate Diverse Amyloid and Nonamyloid Clients
It is not understood how Hsp104, a hexameric AAA+ ATPase from yeast, disaggregates diverse structures, including stress-induced aggregates, prions, and α-synuclein conformers connected to Parkinson disease. Here, we establish that Hsp104 hexamers adapt different mechanisms of intersubunit collaboration to disaggregate stress-induced aggregates versus amyloid. To resolve disordered aggregates, Hsp104 subunits collaborate noncooperatively via probabilistic substrate binding and ATP hydrolysis. To disaggregate amyloid, several subunits cooperatively engage substrate and hydrolyze ATP. Importantly, Hsp104 variants with impaired intersubunit communication dissolve disordered aggregates, but not amyloid. Unexpectedly, prokaryotic ClpB subunits collaborate differently than Hsp104 and couple probabilistic substrate binding to cooperative ATP hydrolysis, which enhances disordered aggregate dissolution but sensitizes ClpB to inhibition and diminishes amyloid disaggregation. Finally, we establish that Hsp104 hexamers deploy more subunits to disaggregate Sup35 prion strains with more stable “cross-β” cores. Thus, operational plasticity enables Hsp104 to robustly dissolve amyloid and nonamyloid clients, which impose distinct mechanical demands.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Cell#
64
#白质#
55
#疾病治疗#
73
#CEL#
56
#蛋白质#
57
#神经变性疾病#
91
#淀粉样蛋白#
54
#变性#
45
#神经变性#
61