复旦大学附属中山医院董健/江立波等ACS Nano:高尔基体靶向光动力疗法通过引发 NLRP3 蛋白依赖性焦亡来增强肿瘤免疫原性
2024-01-01 BioMed科技 BioMed科技 发表于威斯康星
团队发现高尔基体靶向光动力疗法可以显着上调NLRP3的表达,促进细胞内促炎成分如IL-1β或IL-18的释放,形成炎症风暴,增强先天免疫。
先天性和适应性免疫对于启动和维持免疫功能很重要。核苷酸结合寡聚化结构域样受体家族含pyrin结构域3 (NLRP3)炎症小体作为先天性和适应性免疫的检查点,促进促炎细胞因子的分泌和gasdermin D介导的细胞焦亡。作为一种与细胞凋亡不同的高度炎症性细胞死亡形式,细胞焦亡可以触发免疫原性细胞死亡并促进实体瘤中的全身免疫反应。先前的研究提出,NLRP3 通过易位至线粒体而被激活。然而,最近复旦大学附属中山医院董健教授&江立波副研究员团队的一项研究对这一模型提出了挑战,并证明高尔基体可能是NLRP3激活的先决条件。在这项研究中,首先开发了一种高尔基体靶向光动力策略,通过精确定位细胞器来诱导 NLRP3 的激活。团队发现高尔基体靶向光动力疗法可以显着上调NLRP3的表达,促进细胞内促炎成分如IL-1β或IL-18的释放,形成炎症风暴,增强先天免疫。此外,这种急性NLRP3上调还激活了其下游经典的caspase-1依赖性细胞焦亡,以增强肿瘤免疫原性,引发适应性免疫。细胞焦亡最终导致免疫原性细胞死亡,促进树突状细胞成熟,有效激活抗肿瘤免疫和长效免疫记忆。总体而言,这种高尔基体靶向策略提供了对免疫原性焦亡发生的分子见解,并提供了重塑肿瘤微环境的平台。
相关工作以“Golgi Apparatus-Targeted Photodynamic Therapy for Enhancing Tumor Immunogenicity by Eliciting NLRP3 Protein-Dependent Pyroptosis”为题发表在ACS Nano上。


在这项研究中,基于ChS和经典光敏剂二氢卟酚e6(Ce6),通过简单且可重复的制备过程报道了一种具有良好水溶性和高尔基体靶向能力的自组装纳米囊泡,以探索其潜在的作用机制。对于ChS-Ce6聚合物,其亲脂侧链通过分子间疏水相互作用插入纳米囊泡的疏水核心,而纳米囊泡表面的亲水主链是实现肿瘤和高尔基体靶向的靶向配体。从机制上讲,这种高尔基体靶向 PDT 可以强烈促进 NLRP3 的激活,随后依赖 caspase-1 释放促炎细胞因子,并通过 GSDMD 依赖的细胞焦亡的经典炎症小体途径,最终导致癌细胞中的 ICD,促进肿瘤细胞的成熟。树突状细胞(DC),增加肿瘤中细胞毒性T淋巴细胞(CTL)的浸润,并激活持久的免疫记忆。这种精确靶向高尔基体重塑先天免疫中高度炎症的肿瘤杀伤环境和诱导适应性免疫中免疫原性焦亡的策略可以有效促进癌症治疗,并为细胞器靶向纳米治疗提供技术。
【文章要点】
研究评估了纳米囊泡对Lewis肺癌(LLC)细胞的细胞毒性,以确定其体外肿瘤杀伤作用。CCK-8检测结果表明,游离Ce6和ChS-Ce6纳米囊泡对LLC细胞的活力影响可以忽略不计,表明它们具有良好的细胞相容性。与相同Ce6剂量下的游离Ce6组相比,ChS-Ce6组表现出更好的抗肿瘤能力,进一步表明基于ChS的纳米平台更有效地靶向肿瘤。还进行了活/死细胞的双重染色以评估不同组中的细胞死亡。同样,ChS-Ce6+激光组肿瘤细胞的增殖受到显着抑制,进一步证实了ChS-Ce6的高效杀瘤能力。
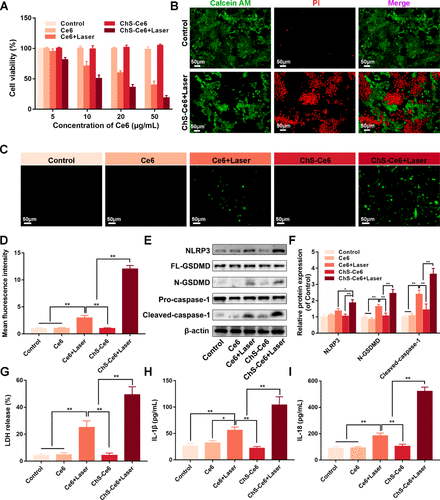
ChS-Ce6 纳米囊泡通过 NLRP3 介导的细胞焦亡诱导癌细胞死亡
基于光动力ChS-Ce6纳米囊泡在细胞研究中显示出预期的结果,研究人员使用C57BL/6小鼠脊柱转移模型来评估其体内抗癌功效,结果表明,ChS-Ce6 在减少循环中的非特异性结合和实现肿瘤积累方面比游离 Ce6 更有效。生物发光图像、离体肿瘤图像、肿瘤重量和体积显示盐水、Ce6 和 ChSCe6 组的癌症快速增殖。在Ce6+激光组中,癌症增殖受到适度抑制。此外,ChS-Ce6+激光组的抗肿瘤作用强于其他组,这表明ChSCe6纳米囊泡可以有效地在肿瘤部位积聚,从而提高NSCLC-SM的治疗效率。此外,ChS-Ce6+激光组的体重损失较少,这可能是由于肿瘤相关的恶病质所致。瘫痪是脊柱转移的严重并发症,可缩短生存时间,也是另一个原因,盐水组、Ce6 组和 ChS+Ce6 组瘫痪发生率较高;然而,在接受激光治疗的组中,这种发生率有所下降;具体而言,ChS-Ce6+激光组的麻痹发生率最低。

ChS-Ce6 纳米囊泡的体内抗肿瘤活性
【结论与展望】
在这项研究中,制备了自组装的 ChS-Ce6 纳米囊泡来靶向高尔基体。这种基于ChS和Ce6的靶向策略被用来阐明细胞器靶向肿瘤消融的机制。结果表明,针对高尔基体的光动力疗法可以强烈促进NLRP3的上调,创造炎症性肿瘤杀伤环境并激活其下游经典焦亡途径。此外,这种以高尔基体为靶点的细胞焦亡通过释放失控的细胞内免疫刺激因子和特异性 DAMP 表达而引发更强大的 ICD 效应,从而促进肿瘤微环境的重塑,从而激活强大的抗肿瘤免疫反应。这种免疫原性焦亡也有效抑制远处癌症的发展。研究描述了通过高尔基体促进 NLRP3 激活和焦亡转变的方法,旨在揭示该过程中潜在的分子机制。此研究结果为进一步开发细胞器靶向癌症治疗提供了替代策略。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c05005
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#光动力疗法# #高尔基体# #肿瘤免疫原性#
56