Cancer Res:蓝柯等发现卡波氏肉瘤病毒致瘤的新机制
2014-02-21 上海巴斯德研究所 上海巴斯德研究所
2月12日,国际学术期刊Cancer Research在线发表了中国科学院上海巴斯德研究所研究员蓝柯研究组的研究论文Latency Associated Nuclear Antigen of Kaposi’s Sarcoma Associated Herpesvirus Promotes Angiogenesis through Targeting Notch Signaling Effector
2月12日,国际学术期刊Cancer Research在线发表了中国科学院上海巴斯德研究所研究员蓝柯研究组的研究论文Latency Associated Nuclear Antigen of Kaposi’s Sarcoma Associated Herpesvirus Promotes Angiogenesis through Targeting Notch Signaling Effector Hey1(《卡波氏肉瘤相关疱疹病毒潜伏态核抗原靶向Notch信号通路效应分子Hey1促进血管生成》)。【原文下载】
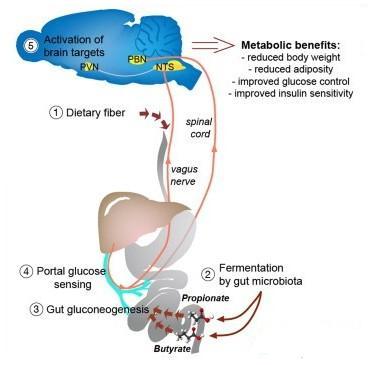
卡波氏肉瘤(KSHV)是一种致瘤性疱疹病毒,可通过多种途径参与并促进宿主细胞的恶性转化。病毒蛋白能够直接调控宿主细胞的某些信号通路,与其中的关键分子相互作用,促进肿瘤形成过程。研究组在前期工作中发现KSHV LANA蛋白通过稳定宿主细胞Notch分子,促进KSHV相关肿瘤细胞的增殖 (Lan, et al. PNAS 2007),但是其调控机制和生物学功能仍未完全阐明。根据文献报道,Notch下游关键效应分子Hey1在哺乳动物血管生成和发育的过程中起重要作用,而KS(卡波氏肉瘤)典型的病理学表现之一即为大量新生血管的生成和红细胞渗透。血管增生和炎症是促使正常细胞发生转化并最终导致KS发生的关键步骤,因此Hey1在KSHV致瘤机制中的功能值得进一步阐明。
研究人员通过收集并深度测序分析新疆经典型KS患者的病灶和近旁标本,证实Hey1、HeyL和Dll4等Notch通路成员在肿瘤标本中显著上调。在功能实验中,Hey1表现出显著的促血管增生和促细胞迁移的作用,同时发现病毒蛋白LANA通过抑制Hey1的泛素化降解而使其稳定存在,由此增加细胞内Hey1的表达水平。研究表明LANA通过“劫持”Hey1的促血管生成和促细胞迁移作用,从而参与肿瘤的发生发展。此项研究为发展以Notch信号通路为靶标的治疗手段提供了线索。
该项研究在蓝柯的指导下,与新疆医科大学教授温浩合作,由博士后王星和研究组其他成员共用完成。研究获得了国家自然科学基金重点项目、国家“973”项目和赛诺菲-安万特人才奖励基金等经费的支持。
原始出处
Wang X1, He Z, Xia T, Li X, Liang D, Lin X, Wen H, Lan K.Latency Associated Nuclear Antigen of Kaposi's Sarcoma Associated Herpesvirus Promotes Angiogenesis through Targeting Notch Signaling Effector Hey1.Cancer Res. 2014 Feb 12.【原文下载】
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言