Brain:利用血清评估神经发生来预测阿尔茨海默病进展
2023-03-13 brainnew神内神外 brainnew神内神外 发表于安徽省
阿尔茨海默病(AD)是一种进行性神经退行性疾病,目前还没有有效的治疗药物。
成人海马神经发生对学习和记忆很重要,研究表明其在阿尔茨海默病早期已发生改变。由于海马神经发生受循环系统的调节,评估海马神经发生如何受系统环境影响,有可能作为阿尔茨海默病进展的早期生物标志物。
近期Brain期刊发表了题为《Predicting progression to Alzheimer’s disease with human hippocampal progenitors exposed to serum》一文,作者使用轻度认知障碍个体的纵向血清样本处理的人海马祖细胞,通过体外试验来模拟系统环境对海马神经发生的影响。结果显示,基线神经源性数据水平以及受教育程度能够预测阿尔茨海默病的进展。该方法为阿尔茨海默病早期预后、监测疾病进展和进一步的机制研究提供了一个重要的方法学支持。
前言
阿尔茨海默病(AD)是一种进行性神经退行性疾病,目前还没有有效的治疗药物。轻度认知功能障碍(MCI)个体发展为AD的概率(临床研究中为10-15%,人群研究中为5-10%)明显高于认知功能正常的老年人(1-2%)。然而,并不是所有MCI个体均会发展为AD,这就需要对MCI患者是否可发展为AD的可能性进行准确评估。目前基本达成共识:在AD早期阶段进行干预效果最好。最近,一些研究表明基于血液的生物标志物是监测早期疾病进展和预测认知能力下降的有希望的手段,这些生物标志物大多与AD的重要病理特征有关。然而,它们提供的关于系统环境如何在细胞水平上影响大脑的信息是有限的,这就需要探寻新的生物标志物来更好地了解早期AD在“细胞阶段”发生了什么。海马神经发生(HN)贯穿哺乳动物的生命周期,主要发生在哺乳动物齿状回的颗粒下层。海马神经源性生态位由海马祖细胞(HPCs)、其子代细胞(即神经元和胶质细胞)、内皮细胞和高度血管化的细胞外基质组成。虽然成人神经发生的存在一直受到质疑,但绝大多数现有文献都明确表明了这一点,HN是一个终生的过程,发生在许多哺乳动物物种中,包括人类,对于依赖海马的学习和记忆非常重要。
有趣的是,HN对循环系统环境高度敏感,这在异种共生实验中得到了很好的证明,在异种共生实验中,两只动物的循环系统通过手术连接起来。幼鼠的血液可以通过改善HN对老龄鼠的认知功能起到返老还童的作用。此外,针对系统环境的干预措施(即药物、运动、饮食)已被证明可以调节HN。重要的是像运动和饮食这样的干预“增加HN”与“降低阿尔茨海默病风险”有关。
最近对AD尸检脑组织的研究表明早在AD Braak II期就可以观察到HN的显著变化,这与啮齿动物模型研究一致,HN确实是AD进展的早期迹象。值得注意的是,海马是AD早期受影响的大脑区域之一,其萎缩与记忆丧失和学习障碍显著相关。虽然这些证据共同表明HN的变化可以作为早期疾病进展的潜在生物标志物,但无论是针对啮齿类动物还是人的研究都还不能确定这些变化的方向性和幅度。大多数研究报告海马神经发生减少,但也有报告增加。现有研究之间的这种差异有必要通过了解HN如何随着AD进展的而变化来解决。显性遗传AD网络研究的证据表明,纵向分析可以提供更准确的疾病进展。然而,缺乏足够的技术来研究“活着的”人类大脑中的HN。
在本研究中,作者提出了一种体外异种共生试验,该试验模拟了系统环境对HN的影响,作者将其作为研究HN随时间变化的方式。使用人类HPCs和MCI患者的纵向血清样本,这些参与者要么进展为AD (MCI转换者),要么保持认知稳定(MCI非转换者),作者的目标是在体外建立人类系统环境在疾病进展中的作用。作者还试图确定该检测方法是否可以作为生物标志物预测MCI进展为AD的可能性。
MCI转换者的血清的神经源性水平的纵向变化
首先,作者团队仅使用来自MCI转换者的纵向血清样本,使用线性混合效应回归,以年为单位模拟了时间到转换之间的关系作为解释变量,并将实验中的每个读数作为响应变量。由于年龄本身对HN水平的影响不显著(P > 0.05),作者以年为单位的时间转换作为解释变量。0指定为AD的诊断时间,它等于每个MCI转换者收集最后一个血清样本的时间点。在此之前收集的其他样本被记为负值(即在转换前1年采集的血清标记为-1)。
当随机截距模型拟合到增殖阶段数据时(图2A-D),转换时间对平均细胞数量的影响显著为正[beta = 17.37, 95% CI: 6.87至27.87,t(81) = 3.29, P = 0.001]。这与增殖本身的增加(Ki67+ 细胞)无关,因为在同一时期内,转化时间的影响显著为负[beta =-1.44,95% CI:-2.03至-0.86,t(81) =-4.94,P < 0.001]。此外,转换时间对凋亡细胞死亡(CC3+细胞)的影响呈显著正相关[beta = 0.12, 95% CI: 0.01 ~ 0.23, t(80) = 2.19, P = 0.031],而教育程度(在10.5岁时一分为二)对凋亡细胞死亡的影响显著为负[beta =−0.60,95% CI:−1.20 ~−0.01,t(80) =−2.03,P = 0.046]。
当模型拟合到分化阶段数据时(图2E-H),观察到平均细胞数量[beta=12.17, 95% CI: 2.24 to 22.11, t(81)=2.44, P=0.017]、成神经细胞数量[% DCX+ cells, beta=1.20, 95% CI: 0.27 to 2.12, t(79)=2.58, P=0.012]和成熟神经元数量[%MAP2+ cells, beta=0.95, 95% CI: 0.10 to 1.79, t(80)=2.22, P=0.029]随转换时间的增加而增加。对于神经母细胞的数量而言,基线MMSE评分(27分)也被发现是一个显著的解释变量,其中基线MMSE评分较高对DCX+细胞整体有显著的负面影响[beta =−3.91,95% CI:−6.75至−1.08,t(79) =−2.75,P = 0.007]。同样,性别(女性分配1)是成熟神经元数量的显著负解释变量[beta =−3.39,95% CI:−5.90至−0.89,t(80) =−2.70,P = 0.009]。
在分化期数据中,作者没有检测到转换时间对凋亡细胞死亡的任何显著影响[beta = 0.16, 95% CI:−0.09至0.40,t(81) = 1.28, P = 0.203],当包括在增殖和分化期数据集的混合效应模型中时,诸如APOE ϵ4状态和共病(如表1所示)等变量没有显著的解释价值。在作者测试的模型中,预测因子之间没有显著的相互作用。
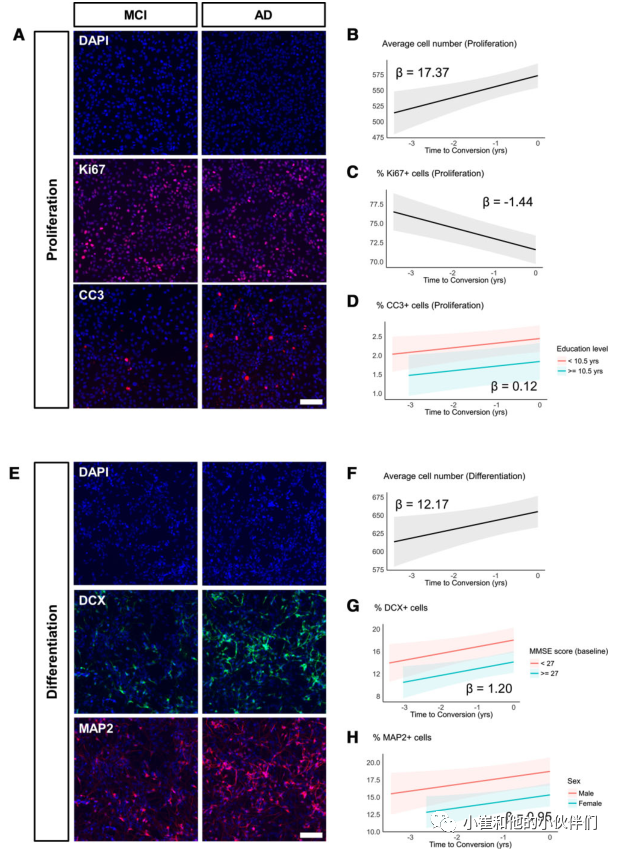
图2:MCI转换者的血清导致细胞增殖减少,死亡增加和神经发生增加
MCI转换者和非转换者的血清对神经源性数据有不同的影响
接下来,作者分析来自MCI转换者和非转换者的血清是否会对HN的轨迹产生不同的影响。作者使用变量“MCI到AD进展”来表示参与者是否进展到AD(转换者赋值为1)。
对增殖期数据进行线性混合效应模型拟合(图3A和B),观察到最后一次就诊时间或转换时间[beta = 18.23, 95% CI: 10.81至25.65,t(154) = 4.85, P < 0.001]和MCI[beta = 74.71, 95% CI: 36.96至112.46,t(154) = 3.91, P < 0.001]对AD进展的平均细胞数量均有显著正向影响。另一方面,它们对增殖(Ki67+cell)呈负向影响[最后一次访问或转换时间:beta =−1.24,95% CI:−1.59至−0.89,t(155) =−7.03,P < 0.001;MCI对阿尔茨海默病进展的影响:beta = 5.58, 95% CI: 2.53 ~ 8.63, t(155) = 3.61, P < 0.001]。
在分析的分化阶段(图3C和D),作者观察到最后一次就诊或转换时间对平均细胞数量呈显著正向影响[beta = 11.48, 95% CI: 5.65-17.32,t(156) = 3.89, P < 0.001],MCI对AD进展的显著负向影响[beta =−47.64,95% CI:−85.13至−10.15,t(156) =−2.51,P = 0.013]。另一方面,它们对成熟神经元数量(%MAP2+细胞)的影响显著正相关[上一次访问或转换时间:beta = 0.56, 95% CI: 0.11 ~ 1.02, t(153) = 2.47, P = 0.015;MCI对AD进展的影响:beta = 2.96,95% CI: 0.62 ~ 5.31, t(153) = 2.50, P = 0.014。在分化期数据中,作者未检测到最后一次就诊时间或转换对凋亡细胞死亡的任何显著影响[beta = 0.02, 95% CI:−0.09至0.14,t(153) = 0.41, P = 0.680],但MCI对AD进展的影响显著为正[beta = 1.62, 95% CI:0.89至2.36,t(153) = 4.36, P < 0.001]。
以上数据表明:与非转化者相比,转化者在实验的增殖阶段具有更高的平均细胞数量和增殖,然后在实验的分化阶段具有更低的平均细胞数量和更成熟的神经元。
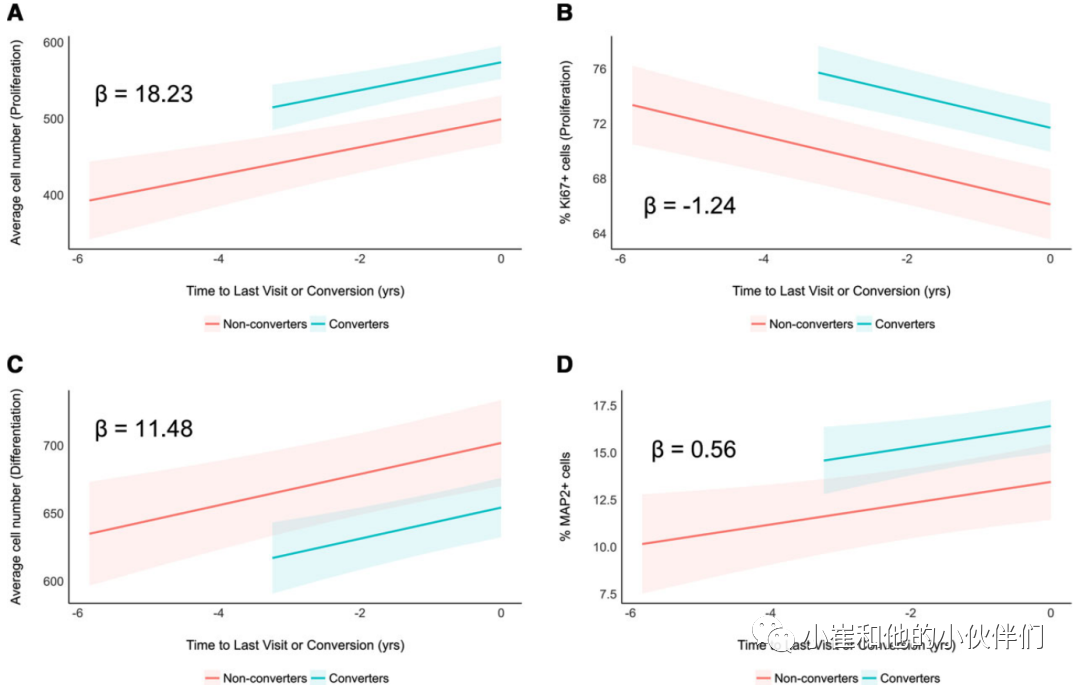
图3:MCI转换者的血清对细胞数量、增殖和神经元分化的影响
基线神经源性读数和教育水平可预测MCI到AD的进展
接下来,作者研究了该试验的基线神经源性读数与一些基线参与者特征是否可以预测MCI向阿尔茨海默病的进展。使用逐步logistic回归分析发现从MCI发展到临床AD的最佳预测因子是:受教育年限、增殖期平均细胞数、增殖期Ki67+细胞百分比和分化期CC3+细胞百分比(表2)。
通过Hosmer-Lemeshow拟合优度(P=0.324)和Stata链接检验验证logistic回归模型的拟合性,无规范误差(_hat=0.001,_hatsq=0.110)。作者观察到教育对实验中增殖期平均细胞数、增殖期Ki67+细胞百分比和分化期CC3+细胞百分比均无显著影响。
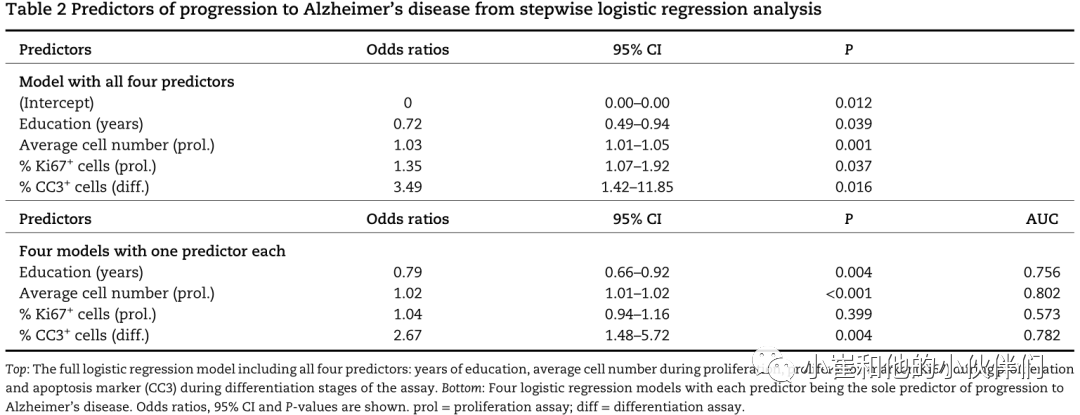
表2:逐步logistic回归分析阿尔茨海默病进展的预测因子
为了评估预测因子准确分类转换者和非转换者的能力,计算了ROC曲线下面积(图4A)。完整逻辑回归模型的值为0.967,高于单独基于每个预测因子建立的其它模型(图4B和表2)。作者还发现,转换为阿尔茨海默病的几率随着受教育年限的增加而降低0.72倍。然而,在实验的分化阶段,凋亡细胞死亡每增加一个百分点,转换为阿尔茨海默病的几率就增加3.49倍(图4C)。
由于纳入的样本量有限(n = 56),并且在本研究中无法获得单独的纵向验证队列,因此对模型进行了基于机器学习的内部验证。使用支持向量机分类器(径向基函数核)进行重复k-fold交叉验证(k = 51000次重复),其中每轮重复测试均使用20%的数据。结果发现,使用三个选择的神经源性读数作为预测因子的分类器实现了曲线下面积为0.93,敏感性为90.3%,特异性为79.0%(图4D)。
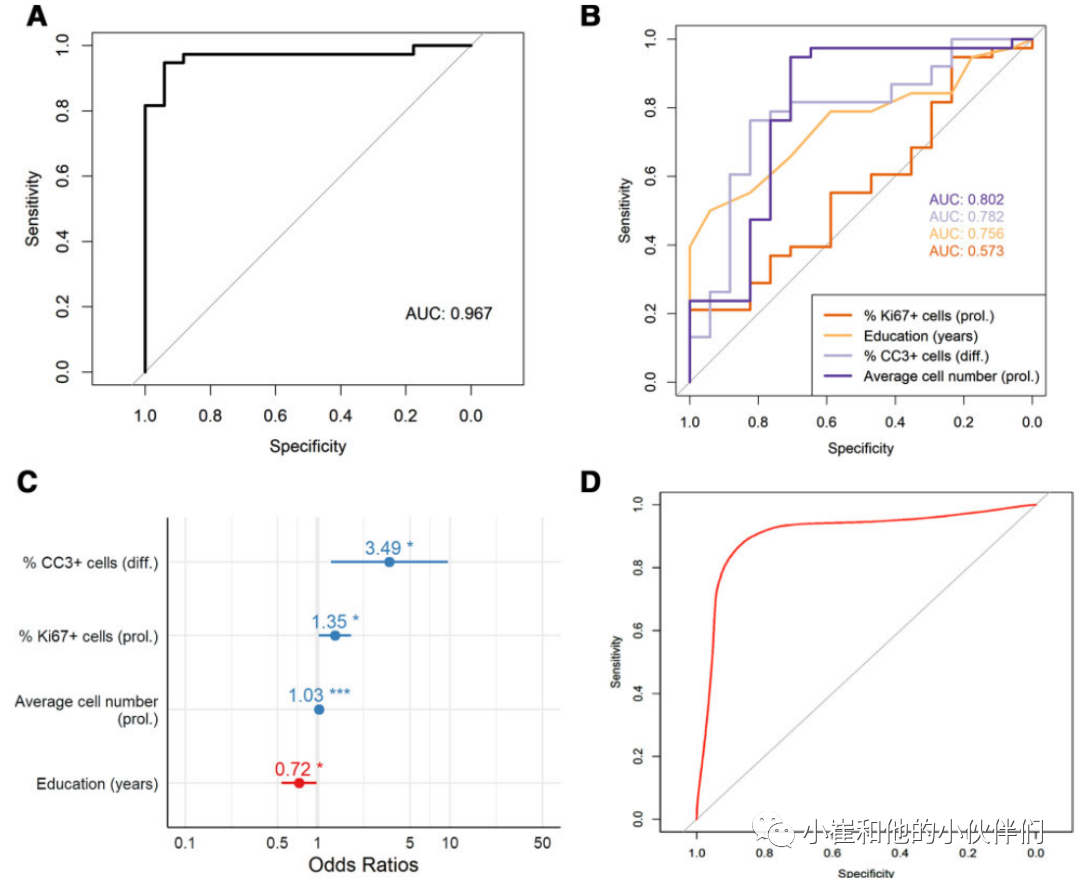
图4:增殖期平均细胞数、Ki67、分化期CC3,结合教育年限可预测MCI向AD的进展
MCI转换者和非转换者基线血清的蛋白质组学分析
为了探索是否可以使用不同的模式实现类似的预后准确性,作者使用SomaLogic对所有基线血清样本进行蛋白质组学分析。血清中205种蛋白水平在MCI转换者和非转换者之间有显著差异(图5A)。然而,这些都没有通过错误发现率的修正。在差异表达蛋白中,有的蛋白参与神经发生过程(如GDF11)或参与阿尔茨海默病(如LRRK2, RCAN1, NTRK2),或参与神经发生和阿尔茨海默病(如CREBBP, SFRP1, IL1RAP)。然后,作者执行了基于机器学习的重复k-fold交叉验证(k = 10),以找到区分MCI转换者和非转换者的最小信号。在训练集和测试集中,不同数量输入特征的曲线下面积如图5B所示。一个由15个蛋白质组成的小组在区分MCI转换者和非转换者血清样本时达到了最高的预测值曲线下面积,为0.77(图5C)。
然后,作者的目标是进一步了解血清中的蛋白质可能调节海马干细胞命运和阿尔茨海默病进展的分子途径和网络。使用IPA软件上的典型通路分析和网络分析来确定差异表达蛋白可能构成的通路。分析中确定的一些典型通路包括:“凝血系统”(P = 0.000192,比例7/26)、“急性期反应信号通路”(P = 0.00345,比例12/100)、“外源性凝血酶原激活通路”(P = 0.0111,比例3/10)、“FXR/RXR激活通路”(P = 0.0146,比例7/53)、“Notch信号通路”(P = 0.0237,比例3/13)、“甲硫氨酸降解超通路”(P = 0.0321,比例2/6)和“Wnt/β-catenin信号通路”(P = 0.0353,比例6/50)。在分析中确定的三个顶级网络是:“血液系统发育和功能,有机体功能,有机体损伤和异常”(图5D),“细胞死亡和存活,胚胎发育,有机体发育”(图5E),以及“细胞间信号和相互作用,细胞功能和维持,炎症反应”(图5F)。

图5:MCI转换者和非转换者血清蛋白差异表达分析
讨 论
本研究采用体外共生试验,将人HPC细胞暴露于人血清样本中。作者模拟全身环境对HN影响的方法可以作为体内HN的潜在替代,因为HPCs可以对在不同时间点采样的给定系统环境(如血清)做出反应。该研究证明试验产生的基线数据能够在临床诊断前3.5年预测从MCI到阿尔茨海默病的进展,为了解阿尔茨海默病进展早期HN的时间变化提供了机会。
作者报告了在阿尔茨海默病进展过程中,MCI时间更近的血清诱导的神经发生的增加。虽然先前的人体尸检研究显示阿尔茨海默病中HN的调控异常,但一直存在争论,即HN是增加,还是减少,或是不变。由于这些研究大多描述的是阿尔茨海默病“晚期”阶段的HN,因此很难将其结果推断到阿尔茨海默病的“早期”阶段。作者注意到,体外测量仅是体内HN的潜在替代,体内神经源性过程的全身性影响可能比我们在体外观察到的更晚。然而数据显示,在该实验的分化阶段MCI转换者的细胞增殖增加,这与最近的一项啮齿动物研究一致,该研究调查了“前驱性”阿尔茨海默病中的HN,在APP-PS1小鼠模型中,海马中DCX+神经母细胞的增殖在斑块前阶段显著且特异性 “升高”。有趣的是,他们观察到平均细胞数量增加,增殖细胞百分比下降。这可能是由于在较早的时间点增殖增加,随后在治疗后48小时增殖被抑制,表明在试验中纳入较早的时间点可能是有意义的。此外,他们还观察到细胞凋亡的增加,这可能与细胞过度融合时营养物质的消耗和乳酸盐等代谢物的增加有关。
目前尚不清楚HN的增加是通过提供认知弹性来发挥代偿作用,还是有助于阿尔茨海默病的持续病理。例如,在海马选择性神经元损失的小鼠模型中,神经发生的增加与行为恢复相关(CaM/Tet-DTA),尽管这种影响仅在年轻小鼠(6个月大)中明显,而在老年小鼠(14个月大)中不明显。这表明,阿尔茨海默病晚期HN的增加可能不足以促进认知恢复。与HN的正向作用相反,一些功能研究表明,HN的增加可以干扰旧记忆的检索,而神经发生的消融可以通过减少干扰来改善海马体依赖的工作记忆。虽然HN“增加”在阿尔茨海默病中的确切作用仍有待确定,但作者对研究结果进行谨慎的总结,其中神经发生增加可能是对衰老/神经退行性系统环境的一种代偿机制,但它可能不是一种功能恢复机制来完全阻止认知能力下降。
本研究中的预测模型能够使用来自检测和教育年限的基线数据子集来区分MCI转换者和非转换者。作者认为,受教育程度是“生活方式”的代表,它可能会影响职业选择、社会经济地位以及一生中暴露于阿尔茨海默病风险因素的程度。虽然他们的研究支持先前关于低教育程度和高阿尔茨海默病风险之间的关系的发现,但也需要注意到该研究没有直接检查可能提供更好预测HN的各种生活方式因素。这包括(但不限于)社交/认知参与、体育活动和饮食。对于那些可用于本研究的患者,他们报告除少数人口统计学特征外,如10.5岁时的教育水平、基线MMSE评分和性别对试验中模拟的HN轨迹没有显著影响。此外,作者报告APOEε4状态没有显著影响,增加了现有文献关于ε4在海马体中“有争议的”作用。从实验中得到的基线神经源性读数比从蛋白质组学分析中鉴定出的15种血清蛋白组更准确地预测临床阿尔茨海默病的进展。这可能是因为神经源性读数代表了血清中“所有成分”(即全身环境)的影响,而不是少数蛋白质的影响。建议在MCI和阿尔茨海默病参与者的独立队列中验证这些蛋白质,并进行后续假设驱动的研究,重点关注由血清分析物调节的特定分子通路和/或网络,这可以更好地了解这些蛋白质如何影响海马细胞命运和阿尔茨海默病进展。一个候选的是p38 MAPK通路,因为它的激活已被证明可以触发增殖抑制,诱导凋亡和刺激祖细胞的分化。
本研究存在一些局限性。首先,阿尔茨海默病的诊断仅为临床诊断,没有一个研究参与者在死后被诊断为阿尔茨海默病。其次,在纵向队列中没有神经影像学或脑脊液生物标志物数据可供作者确定改变的神经源性过程与其它阿尔茨海默病相关致病过程之间的关系。第三,尽管样本来自两个独立的多中心队列,但他们的样本量和随访时间有限,而且他们缺乏关于参与者潜在混杂的生活方式因素(如身体活动水平)的数据。虽然该模型在本研究中已经被交叉验证,但理想情况下是在包括相关生活方式信息的更大队列中测试作者的模型。探索作者的结果是否可以推广到家族性阿尔茨海默病也将是有趣的。此外,本文中的队列包含有大量共病的MCI患者,因此有一个更大的队列将使作者能够研究他们对神经源性数据水平的影响,使作者更有信心相信,神经源性数据水平是MCI发展为阿尔茨海默病的可靠预测指标。第四,作者认识到在本研究中使用的实验并没有完全重建神经源性生态位,未来的实验应该看到这种体外模型的扩展,以包括阿尔茨海默病的其它关键参与者,如小胶质细胞或延长实验的持续时间,以监测突触的形成和可塑性。包括其它标记物并表征细胞凋亡在分化阶段增加的时间点可能提高分析的预后准确性。第五,作者之前已经表明,本试验中使用的细胞系含有单核苷酸多态性,可能会减少炎症下的神经发生,因此,未来的研究应该比较具有不同基因组背景的HPC系或阿尔茨海默病特异性诱导的多能干细胞来源的神经祖细胞。第六,体外观察到的效果可能与体内的不一致(即用重组生长因子培养的胎儿细胞可能与原生成人神经前体表现不同)。
综上所述,本研究提出的体外异种共生试验可以模拟人体系统环境(即血清)对HN的影响。该方法可以使用基线神经源性水平和教育年限,在临床诊断前3.5年预测阿尔茨海默病的进展。尽管本研究存在局限性,但提出的测定方法有可能促进阿尔茨海默病的早期预后,并有助于临床试验中研究参与者的有效分层。该分析也为我们提供了方法学,以促进我们理解人类HN在健康和疾病背景下的潜在改变机制。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言