上海交大章雪晴研究员ACS Nano:通过靶向mRNA纳米药物调节斑块炎症以治疗动脉粥样硬化
2023-09-12 BioMed科技 BioMed科技 发表于上海
该研究开发了一种靶向型mRNA纳米药物,该方法能够选择性地将编码抗炎因子白介素-10的信使RNA(mRNA)传递到斑块内的巨噬细胞,促进晚期AS病变部位斑块微环境中炎症的消退,以阻止AS的进展。
动脉粥样硬化(Atherosclerosis, AS)是当前心血管疾病发生的主要诱因,而心血管疾病已超越传染病,成为世界范围导致死亡的首要原因。AS以脂蛋白和凋亡免疫细胞在动脉及其分支的血管壁内膜积聚形成斑块为特征,炎症与脂质代谢紊乱相伴并协同促进AS病变和内膜损伤。近期研究表明,炎症消退功能障碍是AS临床发展的主要致病因素,斑块微环境持续的炎症反应以及血管内皮结构和功能的损伤贯穿于AS起始和病变进展的全过程。然而,目前AS的临床治疗策略主要为降脂疗法,缺乏有效靶向AS斑块的临床抗炎治疗药物。据统计,心血管疾病的发生率和死亡率仍呈现上升趋势,这说明此领域仍存在大量未满足的临床需求。
2023年9月5日,上海交通大学药学院章雪晴研究员团队在ACS NANO上发表了题为“Modulating plaque inflammation via targeted mRNA nanoparticles for the treatment of atherosclerosis”的研究论文。该研究开发了一种靶向型mRNA纳米药物,该方法能够选择性地将编码抗炎因子白介素-10(Interleukin-10, IL-10)的信使RNA(mRNA)传递到斑块内的巨噬细胞,促进晚期AS病变部位斑块微环境中炎症的消退,以阻止AS的进展。上海交通大学药学院博士研究生高明珠为该论文的第一作者。

最近的证据表明,由于含有脂蛋白的载脂蛋白B在动脉内皮下驻留,巨噬细胞对此产生适应不良的炎症反应,推动了AS斑块的形成。这种不适应反应导致炎症无法消退,主要表现为凋亡细胞清除程序受损、炎症细胞排出缺陷,以及持续的氧化应激和炎症状态,最终形成易破裂的不稳定斑块,易导致血栓形成和心肌梗死。IL-10是一种有效的抗炎因子,通过调节巨噬细胞的脂质代谢、降低促炎细胞因子和基质金属蛋白酶9的产生,以及抑制氧化应激和细胞凋亡,发挥多重抗AS作用。但由于IL-10血浆半衰期短(~3分钟),以及高剂量全身给药存在免疫抑制和感染的风险,其临床转化受到限制。相关研究尝试使用纳米载体携载IL-10蛋白以治疗AS,但由于纳米制剂的制备过程易造成IL-10蛋白活性丧失,难以向产业转化阶段推进。
mRNA理论上可以产生任意蛋白,且具有设计灵活、插入诱变的风险低、生产工艺成熟等独特优势,已迅速成为预防和治疗多种疾病的药物。为了充分释放mRNA药物的治疗潜力,迫切需要研发能够特异性地将mRNA递送到特定器官和细胞的载体。然而,大多数已开发的核酸纳米载体经系统给药后优先将mRNA非特异性的递送至肝脏和脾脏,这极大地限制了mRNA药物的临床应用。
已知巨噬细胞,特别是M2极化巨噬细胞,大多定位于斑块坏死核心周围的纤维帽中,并且该细胞表面表达高水平的生物标识物,如甘露糖受体(CD206)。因此,研究团队开发了一种靶向巨噬细胞的mRNA纳米治疗方法,能够选择性地将IL-10 mRNA传递到斑块炎症环境中,促进巨噬细胞向M2抗炎表型极化,从而形成有益的正反馈回路,增强了NPs到AS病变区域的归巢。
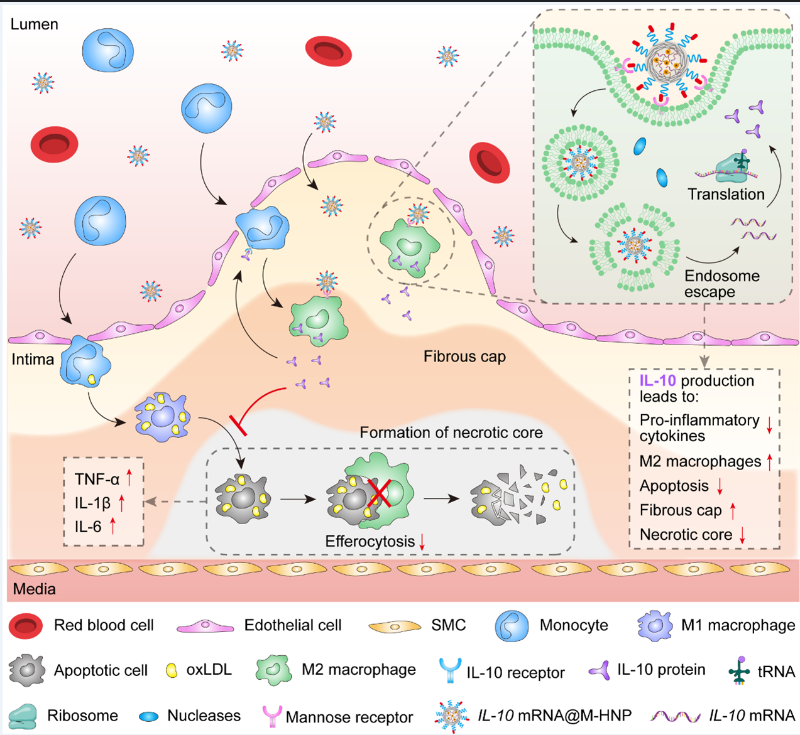
将IL-10 mRNA特异性递送至AS病变巨噬细胞以促进炎症消退的示意图
在西方饮食诱导的Ldlr-/-小鼠AS模型中,装载IL-10 mRNA的靶向型纳米药物(IL-10 mRNA@M-HNPs)可以通过受体介导的相互作用被M2样巨噬细胞充分内化,并有效诱导IL-10的产生。分泌的IL-10促使巨噬细胞向M2表型极化,这反过来增强NPs在富含巨噬细胞的斑块内累积,放大了IL-10 mRNA治疗药物的抗炎作用。由此产生的正反馈回路抑制了氧化应激和细胞凋亡,并通过减少脂质沉积和坏死核心面积以及增加纤维帽厚度来发挥抗AS作用。这项工作在治疗AS方面显示出巨大的希望,并向抗炎治疗的临床转化迈出了鼓舞人心的一步,为其他相关心血管疾病提供了新的治疗选择。
章雪晴团队在靶向型核酸递送系统的研究领域具有逾十年的研究经验,近期关于靶向型核酸纳米药物治疗非酒精性脂肪肝炎及相关肝纤维化的工作发表于ACS NANO(2023, 17(15), 14852-14870, DOI: 10.1021/acsnano.3c03217);关于mRNA-LNP介导的肿瘤免疫治疗的工作发表于Nature Communications(2023, 14(1), 4223, DOI: 10.1038/s41467-023-39938-9);关于吸入式核酸纳米递送系统的工作发表于Science Advances(2022, 8(25), eabn7162, DOI: 10.1126/sciadv.abn7162)和ACS Applied Materials & Interfaces杂志(2023, 15(26), 31273-31284, DOI: 10.1021/acsami.3c05007);关于新型可离子化脂质分子库的设计和相关核酸纳米递送平台构建的工作发表于ACS NANO(2022, 16(11), 18936-18950, DOI: 10.1021/acsnano.2c07822)和Advanced Functional Materials(2022, 32(40), 2204462, DOI: 10.1002/adfm.202204462)。上述研究工作得到了国家生物药技术创新中心核酸药物“揭榜挂帅”重点项目、上海市自然科学基金面上项目、上海交通大学前瞻重点布局基金重点突破项目、转化医学国家重大科技基础设施(上海)开放课题重点项目、上海交通大学医工交叉基金重点项目以及国家高层次人才计划青年项目的支持。
【通讯作者信息】
章雪晴,博士,现任上海交通大学药学院博导,研究方向围绕核酸递送系统和生物医用材料,以临床需求为导向,(i)探索新型 mRNA 疫苗及其在预防传染病的应用研究,和(ii)开展靶向核酸纳米递送系统在器官纤维化、肿瘤、心脑血管疾病等治疗领域的应用和机制研究。研究成果在Science Advances、Nature Communications、PNAS、Science Translational Medicine、Advanced Materials等著名期刊发表了48篇SCI;申请多项专利,获得2项美国授权,6项中国授权。获中组部“海外高层次引进人才”青年项目、江苏省“双创计划”领军人才、美国百特青年科学家奖等支持。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c00958
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言