俯卧位对机械通气COVID-19相关呼吸衰竭患者临床预后的影响
2023-02-09 网络 网络 发表于上海
对于2019新冠病毒(the novel coronavirus disease 2019,COVID-19)相关呼吸衰竭患者的治疗问题亟待解决。急性呼吸窘迫综合征患者进行早期俯卧位通气能够显著改善患


东南大学附属中大医院 潘纯/杨毅 译
苏州大学附属第一医院 王俊 审
东南大学附属中大医院 潘纯/邱海波 潘纯/杨毅 述评
目的:对于2019新冠病毒(the novel coronavirus disease 2019,COVID-19)相关呼吸衰竭患者的治疗问题亟待解决。急性呼吸窘迫综合征患者进行早期俯卧位通气能够显著改善患者的预后,但目前仍缺少俯卧位通气对于COVID-19患者预后的影响。本研究的目的评估早期俯卧位通气对于COVID-19相关呼吸衰竭的临床预后。
设计:本研究的数据采自“COVID-19重症患者的治疗和结局”研究的数据库,这是一个多中心队列研究,纳入了美国68家医院的重症新冠患者。利用这些数据,我们将机械通气的低氧血症患者(PaO2/FiO2 ≤ 200 mmHg)在入ICU后的前2天内是否开始俯卧位通气来分组,进行目标试验。我们拟合了一个逆概率加权Cox模型来评估是否进行早期俯卧位通气对病死率的危险度。患者随访的终点为死亡、出院或终止随访。
机构:68家美国ICU。
患者:实验室结果确诊为COVID-19、接受有创机械通气及PaO2/FiO2≤ 200 mmHg的重症患者。
干预:无。
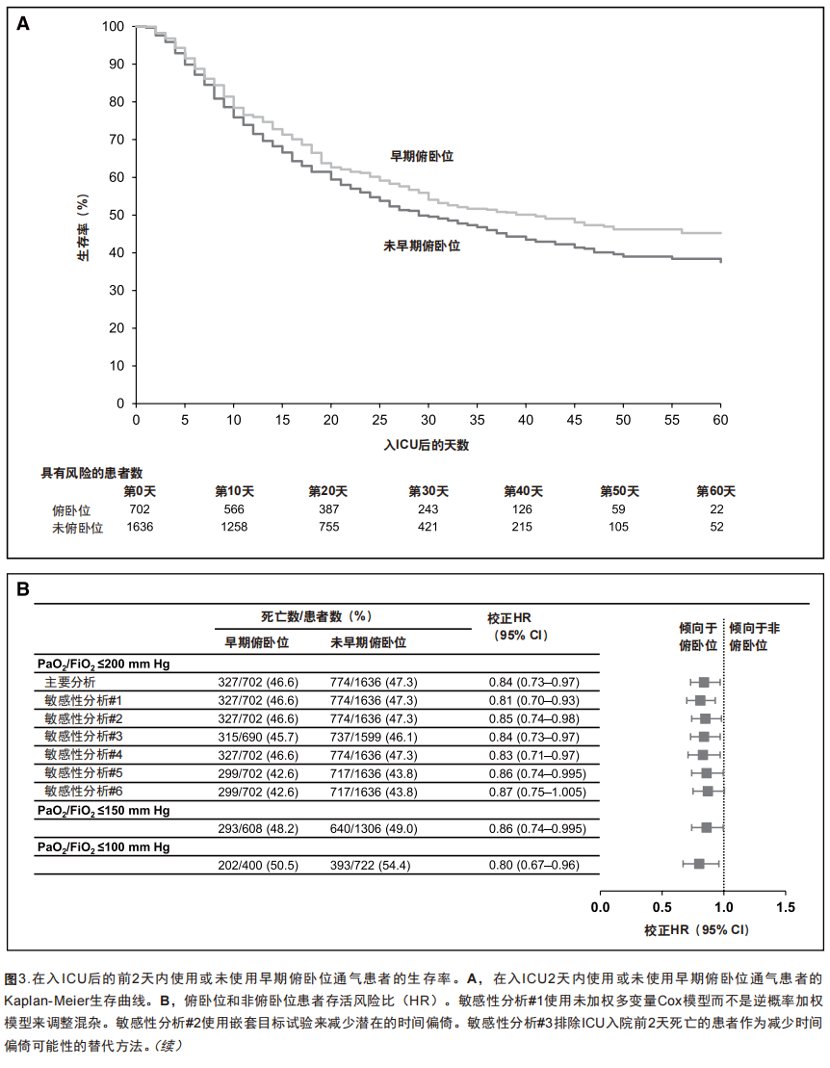
测量与主要结果:在2338例符合入选标准的患者中,702例(30.0%)患者在入ICU后2天内接受了俯卧位通气。在逆概率加权后,患者的基线情况和疾病严重程度在两组间更为均衡。在2338例患者中,共有1017例(43.5%)患者出院时存活,1101(47.1%)患者死亡,220例(9.4%)患者在末次随访时依然在院。在入ICU后的前2天内接受俯卧位通气的患者较未接受俯卧位通气的患者,校正后的死亡危险度更低(HR 0.84;95% CI 0.73 ~0.97)。
结论:对于接受机械通气的COVID-19相关低氧血症患者,早期俯卧位通气能够降低住院病死率。
关键词:成年人;2019新冠病毒;重症医学;俯卧位通气;急性呼吸窘迫综合征;呼吸功能衰竭。
新冠病毒2019(the novel coronavirus disease 2019,COVID-19)席卷了全美国的ICU,导致大量的重症低氧血症和急性呼吸窘迫综合征(Acute Respiratory Distress Syndrome,ARDS)的患者。截止到2020年12月,美国已有超过1400万COVID-19患者,ICU住院率为11.5%[1,2]。对于COVID-19相关呼吸衰竭患者,目前仍缺乏改善其病死率的治疗手段[3]。俯卧位通气是ARDS中被广泛研究的治疗方式,早期实施能够改善病死率[4],但在COVID-19患者中依然缺乏研究。
美国胸科协会(American Thoracic Society,ATS)、欧洲重症医学协会(European Society of Intensive Care Medicine,ESICM)和重症医学协会(Society of Critical Care Medicine,SCCM)在2017年联合推荐俯卧位通气用于治疗重症ARDS的成年患者[5]。尽管如此,俯卧位通气在接受插管的中重度低氧血症患者中实施的比例依然很低[6,7]。相关的原因可能是与血流动力学不稳定[8]、医院资源受限、医务工作者的感受和教育程度相关[9,10]。这些局限性在COVID-19疫情时代更加明显。
虽然缺乏强有力的证据证明俯卧位是COVID-19特异性的治疗方式,它依然被列为COVID-19相关ARDS的主要治疗手段[11]。近期研究发现俯卧位能够改善接受机械通气的COVID-19患者的氧合[12]。然而,俯卧位通气对这群患者病死率的影响仍缺乏研究。鉴于COVID-19相关呼吸衰竭患者的呼吸力学有所不同,目前对于俯卧位通气能否改善这群患者的生理变化和预后依然缺乏共识[13,14]。俯卧位通气对于重度ARDS的影响(the Effect of Prone Positioning on Mortality in Patients With Severe and Persistent Acute Respiratory Distress Syndrome,PROSEVA)研究虽然提供了阳性结果,但COVID-19治疗的不均衡,导致在机械通气COVID-19患者中进行随机对照研究的可行性较低[4]。
当无法通过随机试验得到研究结果时,可以通过目标试验模拟方法,即利用试验设计原则来分析观察性数据,来指导临床实践[15-17]。我们利用了一个以COVID-19重症患者为研究对象的多中心研究中的数据来模拟目标试验,探究俯卧位通气对患者生存的影响。
方法概况
我们使用了重症COVID-19治疗和结局的研究(the Study of the Treatment and Outcomes in Critically Ill Patients with COVID-19,STOP-COVID)数据来模拟一个假设的目标试验,其中患者被分配为在入ICU后的前2天内接受或不接受俯卧位通气[18]。
研究人群
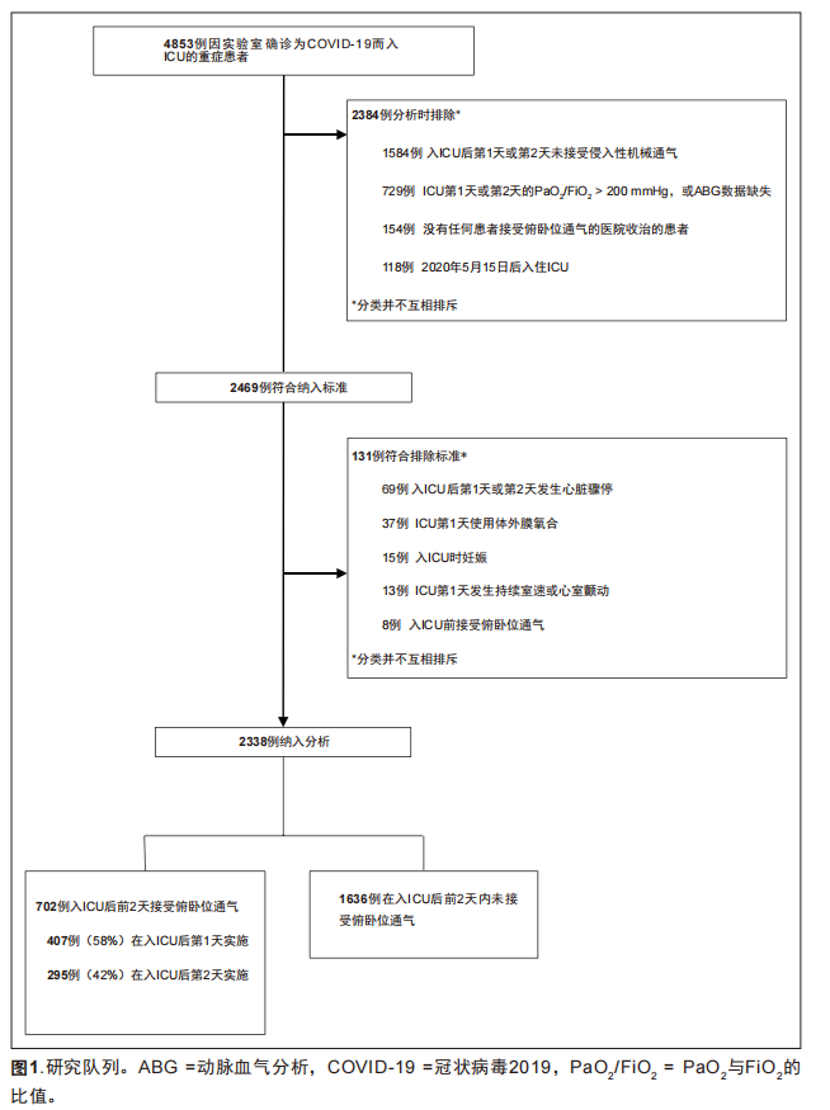
STOP-COVID是一个纳入美国68家ICU的实验室确诊COVID-19患者的多中心队列研究[18]。每个中心的研究团队都进行了标准化信息采集并将其录入一个安全的在线平台(Research Electronic Data Capture),数据库收集了人口学、症状、实验室结果、用药、非用药治疗和器官支持等数据。对于目前的分析,我们纳入了在2020年3月4日至2020年5月15日期间入住ICU的患者,68家中心中有的66家中心的至少使用一次俯卧位(附表1,http://links.lww.com/CCM/G204)。
患者接受随访至首次出院、死亡或2020年6月22日(即随访终点)。患者在出院后不再随访。收集患者入ICU后14天内的详细实验室和生理指标,包括每日氧合指数(PaO2/FiO2),此外还记录俯卧位开始的时间、其它重症干预措施、用药和器官支持情况。俯卧位治疗的持续时间没有记录,其它与STOP-COVID研究设计相关的结果已经发表在其他的期刊[18]。本研究受到参研中心的机构审查委员会(Institutional Review Board,IRB)审核通过,本研究无需知情同意(美国麻总百翰国际部IRB方案号 2007P000003)。
纳入标准
我们纳入了在入ICU最初2天内被诊断为中重度低氧血症(柏林标准:PaO2/FiO2≤ 200 mmHg)且使用有创机械通气的成年(≥18岁)患者[19]。因为STOP-COVID研究中有相当一部分插管患者在PaO2/FiO2> 150 mmHg的时候启动早期俯卧位,因此与PROSEVA试验中使用的≤150 mmHg的PaO2/FiO2相比,本研究选择了这种临床治疗相关的、范围更广的低氧血症[4]。使用PaO2/FiO2≤ 200 mmHg的阈值,能够得到82.9%的在入ICU后的前2天内使用俯卧位通气的患者。
我们排除了在入住ICU后的前2天内没有一次PaO2/FiO2≤ 200 mmHg 的患者,无论他们是否俯卧位。我们还排除了在ICU第一天内使用体外膜氧合的患者、心跳骤停或恶性心律失常(持续室性心动过速或室颤)的患者、在入ICU前已经使用过俯卧位的患者、孕妇[4]。
治疗策略
我们比较了在入ICU后的前2天内启动俯卧位和未启动俯卧位的患者,采用2天的时间是为了提供患者间更好的同质性并方便更长时间的随访。虽然PROSEVA研究将患者的纳入限
制在入住ICU后的前36小时内[4],STOP-COVID研究的事件采集依然将入ICU以及早期俯卧位的时间限制为以天为单位,而非小时为单位。
治疗分组
我们按照患者在入ICU后的前2天内是否启动俯卧位通气将患者进行分组。即使患者在入住ICU后延迟使用俯卧位通气仍被纳入非俯卧位组,以减少可能的时间偏倚以及模拟随机试验的意向性分析策略。
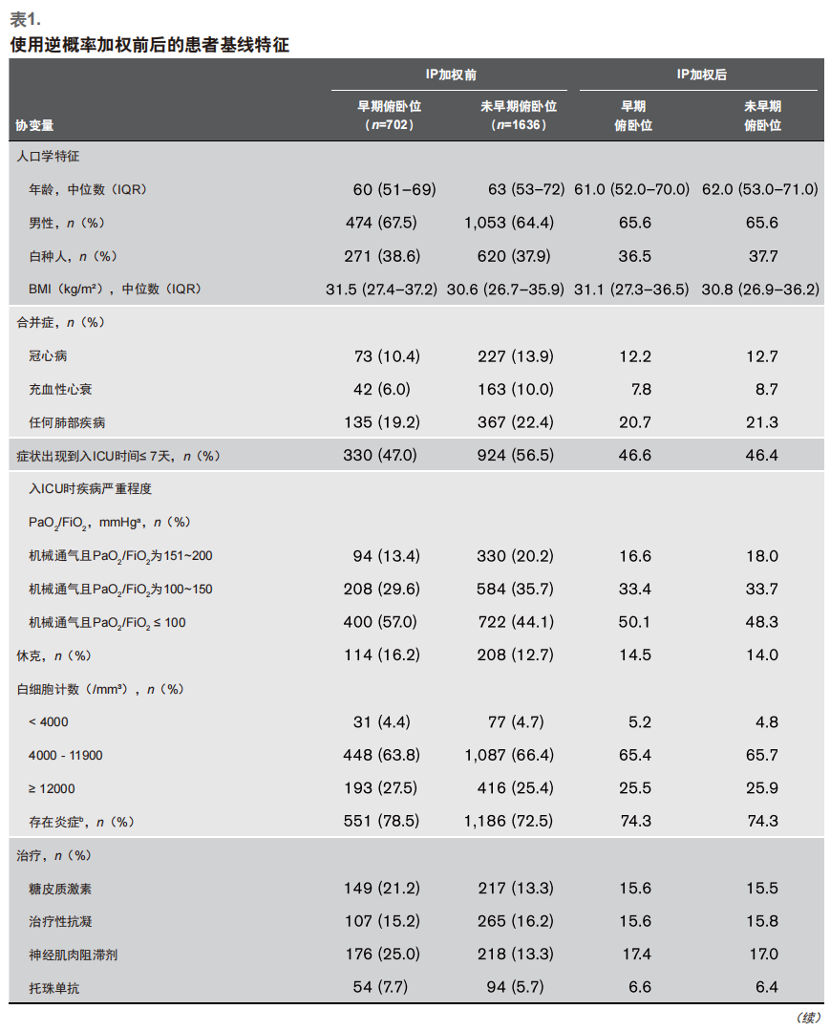
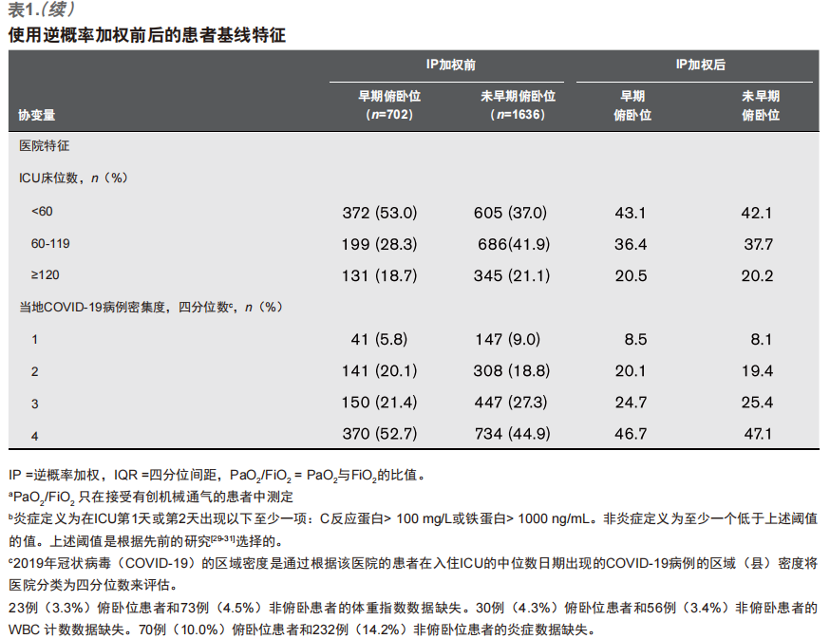
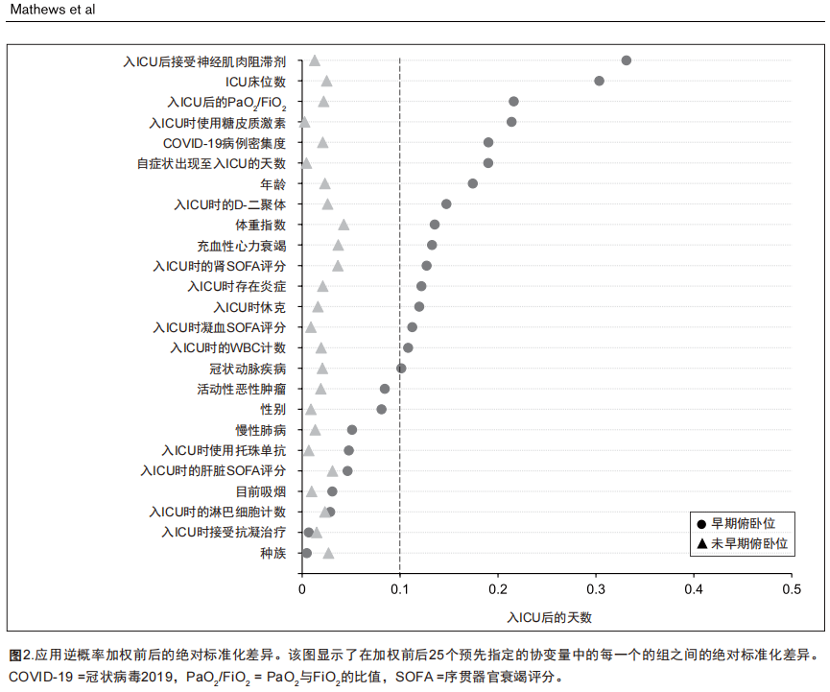
我们假设可比性取决于以下基于临床判断预先指定的协变量:年龄;性别;种族(白人或非白人);体重指数;基础病(肺病、吸烟史、冠心病、充血性心衰、恶性肿瘤);入ICU前症状持续时间;入ICU时疾病严重程度[PaO2/FiO2、序贯器官衰竭(SOFA)评分中的肾脏、肝脏和凝血评分[20]、休克、白细胞计数、淋巴细胞计数、炎症指标(C反应蛋白或铁蛋白的升高程度)和D二聚体水平];入ICU第一天的治疗情况(糖皮质激素、托珠单抗、治疗性抗凝、神经肌肉阻滞)。其它的协变量还包括COVID-19前的ICU床位数,以及该地COVID-19的密集程度。更多细节详见附录数字内容(http://links.lww.com/CCM/G204)。
结局
主要结局为住院开始到院内死亡的时间,而出院或最后一次随访认定为删失。
统计方法
我们比较了在入ICU 后的前2天开始或未开始俯卧的患者的生存状况,通过Kaplan-Meier生存曲线和Cox模型得到风险比(Hazard ratio,HR)进行评估。我们使用逆概率(Inverse Probability,IP)加权来调整生存曲线和HR中的混杂因素,并计算IP前和IP后权重之间的标准化差异[21,22]。
为此,我们拟合了一个逻辑回归模型,其中早期俯卧位作为上述变量的条件结果。我们使用模型的预测概率来计算稳定的IP权重[23],然后我们将其应用于加权每个个体对生存曲线和Cox模型的贡献[24,25]。我们使用了一个稳健(夹心)方差估计的方法来解释IP加权引起患者的潜在重复,这会导致保守(更宽)的95% CI。
我们进行了两项预先和四项事后敏感性分析。
首先,我们将IP加权模型中的每一个协变量都放在未加权的Cox模型中。
第二,为了减少潜在的时间偏倚[26-28],我们将患者分为入ICU第1天启动或未启动俯卧位组,并且我们在入ICU的第2天对剩余符合标准的患者重复了这个过程。我们通过从入ICU第一天和第二天的嵌套目标试验模拟中合并数据,并采用IP加权得到了评估结果。
第三,作为减少潜在时间偏倚的可选方式,我们排除了在入ICU后的前2天内死亡的患者。
第四,我们在调整了每个参研中心入ICU后的前2天内俯卧位患者的百分比的同时重复了主要分析。
第五,我们重复了主要分析,但删失了第30天的患者。第六,我们重复了主要分析,删失了第30天的患者,并且假设在30天前存活出院的患者在第30天依然存活。
我们在接受有创机械通气且入ICU后的前2天内PaO2/FiO2≤ 150 mmHg的患者[4]以及PaO2/FiO2≤ 100 mmHg的患者中进行了两个亚组分析。进一步详细信息在附录数字内容中呈现(http://links.lww.com/CCM/G204)。所有的分析采用SAS 9.4 软件(SAS研究所,Cary,NC)实现。
研究结果
本研究筛查了在4,853例考虑入组的患者,2,338例患者符合纳入标准并纳入分析(图1)。共有702例(30.0%)患者在入ICU后的前2天内启动俯卧位,其中407例(58.0%)患者在第1天启动,而295例(42.0%)患者在第2天启动。另有457例 ( 19.5% )患者在入ICU后期才启动(附图1 ,http://links.lww.com/CCM/G204)。
患者使用IP加权前后的基础状况如表1所示(其余特征见附表2,(http://links.lww.com/CCM/G204)。在加权前,俯卧位患者较非俯卧位患者更年轻、基础病更少。俯卧位患者和非俯卧位患者的SOFA评分中肾脏和肝脏评分相似,白细胞计数、淋巴细胞计数和D二聚体水平在入ICU第1天均相似 (附表2,http://links.lww.com/CCM/G204)。但是,俯卧位患者在入ICU第1天发生休克的概率更高[114(26.2%)vs 208(12.7%)],使用糖皮质激素和神经阻滞剂比例更高[149(21.2%)vs 217(13.3%);176(25.1%)vs 218(13.3%)]。 接受俯卧位患者收入到ICU床位少的医院的几率更大,并且该地区COVID-19的发病密度更为密集。
图2显示了25个协变量加权前后每一个的组间标准化差异。所有25个协变量的加权样本标准化差异均低于0.1,表明加权后的组间平衡良好。
在纳入的2,338例患者中,俯卧位和非俯卧位患者的中位随访时间分别为34天(IQR,25 ~ 46 天)和30天(IQR,20 ~ 42天),总体人群为31天(IQR,22 ~ 4天) 。在末次随访时,共有1,017例(43.5%)患者存活出院,1,101例(47.1%)患者死亡,220例(9.4%)患者仍然住院。早期俯卧位治疗的702例患者中有327例(46.6%)死亡,未接受早期俯卧位治疗的1636例患者中有774例 (47.3%) 死亡[未调整 HR,0.89(95% CI,0.79 ~ 1.02)]。
在主要分析中,早期俯卧位相较非早期俯卧位的患者,病死率的HR值为0.84(95% CI,0.73 ~ 0.97)(图3)。在前两个敏感性分析中,加入所有协变量进行未加权的Cox模型时HR为0.81(95% CI,0.70 ~ 0.93)(附表3,http://links.lww.com/CCM/G204),当使用嵌套目标试验手段以及IP加权时,HR为0.85(95%CI,0.74 ~ 0.98)。在预设的次要分析中,使用IP加权模型和依据PaO2/FiO2 ≤ 150 mmHg及PaO2/FiO2≤ 100 mmHg进行主要分析也得到了类似的结果,HR分别为0.86(95% CI,0.74 ~ 0.995)和0.80(95% CI,0.67 ~ 0.96)(图3B)。

讨论
使用具有国家代表性的机械通气的重症COVID-19中重度低氧血症患者的队列,我们发现入ICU后的前2天内接受早期俯卧位通气的患者死亡风险更低。既往小型的观察性研究发现俯卧位能够改善COVID-19机械通气患者的氧合,我们的发现与其研究结果一致,且在他们的基础上有所扩充[12]。此外,我们的研究结果亦与PROSEVA研究一致,PROSEVA研究提示早期俯卧位有益于重度低氧血症的非COVID-19的ARDS患者的预后[4],而且我们的结果还包括了那些有中度低氧血症的患者。
我们的研究中在入ICU后的前2天内启动俯卧位治疗的结果和既往对于俯卧位的研究一致。尽管它们有更高的休克率和糖皮质激素使用率[4],与COVID-19感染的临床严重程度和指南推荐的治疗一致[32]。在我们的研究中,在入ICU后的前2天内早期俯卧位的患者相较未俯卧位的患者年龄更轻、合并症更少,提示这些临床因素可能会影响俯卧位的决策。ICU床位更少的医院和当地COVID-19发病密度更高的医院更常使用俯卧位,因此,有限的资源在决定使用俯卧位通气治疗可能起到一些细微的作用[6]。尤其是当价格高昂或者支持力度更高的重症干预手段不能获得时(比如体外膜氧合),更小规模ICU的医院可能会更优先考虑实施俯卧位。本地病例数较高的医院也已经建立了俯卧位小组作为应急支援,但是还需要更多的研究去探讨不同医院间俯卧位的差异原因。
令人注意的是,在我们中重度低氧血症机械通气的患者队列中,30%在入ICU后的前2天内接受了俯卧位治疗。与以往俯卧位有关的研究相比,这个比例较高。在探究重度急性呼吸窘迫综合征的全球性影响的大型观察性研究(Large observational study to Understand the Global impact of Severe Acute respiratory Failure,LUNG SAFE)中,只有16.3%和5.5%的重度和中度ARDS患者接受了俯卧位治疗[7]。这提示在COVID-19流行中,ICU的医务工作者更倾向于使用俯卧位,这可能也反映了缺乏COVID-19患者循证治疗的替代方案。
尽管与过去的研究相比,俯卧位的使用率相对较高,但在疫情前针对急性呼吸衰竭治疗的指南都支持俯卧位通气作为COVID-19的推荐治疗措施,但绝对俯卧位的使用率仍然很低 [4,11]。尽管不做俯卧位通气治疗的合理动机是存在的,例如血流动力学受损和脊柱不稳定,但不太可能完全解释如此低的使用率。在COVID-19流行中,许多医院经历了空间和医务人员的挤兑,会导致了这样的治疗决策。俯卧位被认为是一种劳动密集型的干预;由于个人防护设备供应有限且为了尽量减少医务人员的暴露,可能是导致这种干预措施使用较少的原因 [10]。ICU压力增加与其他流程化干预措施的依从性下降有关,例如静脉血栓栓塞预防 [33,34]。
同样,在 COVID-19 大流行期间,患者数量的增多可能导致俯卧位通气的使用率较低。随着越来越多的机构采用俯卧位通气作为标准治疗,许多管理文件和清单已经发布来协助 ICU 实施 [35]。更好地了解俯卧位通气的真正风险可能会减轻对并发症的恐惧[36]。幸运的是,后来的研究发现俯卧位的使用率增加[37];检查医院之间的操作差异可能会阐明如何在COVID-19大流行中更好地实施标准治疗。
我们的研究有几个优势。首先,我们使用观察数据来明确模拟目标试验。在随机研究中选择合适的纳入标准进行比较,并且纳入标准仅限于入住ICU后的前2天的中重度低氧血症的有创机械通气患者,这与来自非 COVID-19的证据一致。对于非COVID-19的研究提示如果在机械通气的前36小时内开始俯卧位通气是能够改善ARDS预后[4]。
我们调整了多个潜在的混杂因素,包括医院层面的协变量,并减少了潜在时间偏差。此外,STOP-COVID在美国各地不同的参研点使用了统一和标准化的病例录入系统。最后,我们的目标试验模拟结果与使用其他方法学以及所定义的低氧血症阈值的多项敏感性分析结果一致。由于在 COVID-19中进行俯卧位的随机对照试验不太可行,因此目标试验模拟可能提供了当前实践的最佳可用证据。
我们也承认本研究的一些局限性,包括潜在的不可测量的混杂,例如PaO2/FiO2数据缺失。尽管我们没有出院后的病死率率的数据,但我们确实对整个队列进行了至少28天的完整住院随访。我们没有收集关于俯卧位持续时间、俯卧位次数、治疗目标变化或其他俯卧位禁忌症的数据,这些因素可能在决定某些患者早期未能实施俯卧位通气治疗中发挥了作用。我们也没有收集关于潮气量设置或平台压的数据,这也使得我们不能得出俯卧位通气对于不同肺顺应性患者预后的影响。
尽管本研究并未获得相关信息,但我们也发现,由于不同医院的实践差异、专业知识和资源导致了俯卧位实施的比例是不同的,而且对于患者的影响也是存在院间的差异。尽管每个中心的俯卧位治疗的标准或标准俯卧位治疗的流程数据并不完善,并且我们也无法得到每个中心的面对的医疗挤兑状况,我们确实也考虑了COVID-19病例的区域密度作为患者数量的替代,即使这并不是很完美。
结论
我们的研究结果表明,在入住ICU后的前2天内开始早期俯卧位通气可能能够改善因 COVID-19相关呼吸衰竭而导致中度至重度低氧血症的机械通气患者的生存率。需要进一步研究确定可能受益于更规范的俯卧位的COVID-19相关呼吸衰竭患者人群,以及在资源限制和能力紧张期间对俯卧位的操作和实施的一般研究。
1 Division of Pulmonary, Critical Care, and Sleep Medicine,Department of Medicine, Icahn School of Medicine at Mount Sinai, New York, NY.
2 Department of Emergency Medicine, Icahn School of Medicine at Mount Sinai,New York,NY.
3 Department of Anesthesia, Critical Care and Pain Medicine,Beth Israel Deaconess Medical Center, Boston, MA.
4 Department of Medicine and Neurology, Brigham andWomen's Hospital,Boston,MA.
5 Division of Nephrology, Department of Medicine, Icahn School of Medicine at Mount Sinai, New York, NY.
6 Division of Renal Medicine, Department of Medicine,Brigham and Women's Hospital, Boston, MA.
7 Division of Cardiology, Department of Medicine, Universityof Michigan, Ann Arbor, MI.
8 Division of Nephrology and Hypertension, Department of Medicine, Center for Translational Metabolism and Health, Institute for Public Health and Medicine, Northwestern University Feinberg School of Medicine, Chicago, IL.
9 Department of Internal Medicine, Hackensack Meridian School of Medicine, Nutley, NJ.
10 Department of Internal Medicine, Heart & Vascular Hospital,Hackensack Meridian Health, Hackensack University Medical Center,Hackensack,NJ.
11 Department of Medicine, Rutgers Robert Wood Johnson Medical School, New Brunswick, NJ.
12 Division of Critical Care Medicine, Department of Medicine,Cooper University Health Care, Camden, NJ.
13 Division of Pulmonary and Critical Care Medicine,Department of Medicine, Rutgers New Jersey Medical School, Newark, NJ.
14 Division of Renal-Electrolyte and Hypertension, Department of Medicine, Perelman School of Medicine, University of Pennsylvania,Philadelphia,PA.
15 Department of Medicine, Hackensack Meridian Health Mountainside Medical Center,Glen Ridge,NJ.
16 Division of Pulmonary and Critical Care Medicine, Department of Medicine Weill Cornell Medicine, New York, NY.
17 Larner College of Medicine, University of Vermont,Burlington,VT.
18 Department of Epidemiology, Harvard T.H. Chan School of Public Health, Boston, MA.
19 Department of Biostatistics, Harvard T.H. Chan School of Public Health,Boston,MA.
20 Division of Health Sciences and Technology, Harvard-Massachusetts Institute of Technology,Boston,MA.
A full list of Study of the Treatment and Outcomes in Critically III Patients with Coronavirus Disease(STOP-COVID)Investigators is provided in the Supplemental Digital Content (http://links. /ww.com/CCM/G204).
Supplemental digital content is available for this article. Direct URL citations appear in the printed text and are provided in the HTML and PDF versions of this article on the journal's website (http://journals.lww.com/ccmjournal).
Dr. Mathews reported receiving grants from the National Institute of Health (NIH) and the National Heart, Lung, and Blood Institute (NHLBI) during the conduct of the study and serves on the steer-ing committee for A Multi-Center, Adaptive, Randomized, Double-blind, Placebo-controlled Study to Assess the Efficacy and Safety of Gimsilumab in Subjects With Lung Injury or Acute Respiratory Distress Syndrome Secondary to COVID-19(BREATHE) trial,funded by Roivant/Kinevant Sciences; she received support for ar-ticle research from NIH.
Dr. Shaefireported receiving grants from the NIH and the National Institute on Aging and the National Institute of General Medical Sciences; he received support for article research from NIH. Dr. Coca received funding from RenalytixAl, Relypsa, Takeda Pharmaceuticals, CHF Solutions, Bayer, Boehringer Ingelheim, Akebia, inRegen, Renal Research Institute, and XORTX Therapeutics, Inc.; he owns equities in RenalytixAl and pulseData. Dr. Gupta reported receiving grants from the NIH and is a scien-tific coordinator for GlaxoSmithKline's Anemia Studies in Chronic Kidney Disease: Erythropoiesis via a Novel Prolyl Hydroxylase Inhibitor Daprodustat trial. Dr. Srivyastava's institution received fund-ing from the NIH and National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK); he reported receiving funding from the NIH, NIDDK, Horizon Therapeutics PLC, AstraZeneca, Tate &Latham, and CVS Caremark. Dr. Hernan reported receiving grants from the NIH. Dr. Chan's institution received funding from NIH and Renal Research Institute; she received funding from Gerson Lehrman Group consulting and NIH; she received support for ar-ticle research from NIH. Dr. Leaf's institution received funding from NIH, NIDDK, and NHLBI; he received funding from BioPorto. The remaining authors have disclosed that they do not have any poten-tial conflicts of interest.
For information regarding this article, E-mail: kusum.mathews@mssm.edu
参考文献
1. Centers for Disease Control and Prevention: Coronavirus Disease 2019(COVID-19),Cases,Data&Surveillance,2020. Available at: https://www.cdc.gov/coronavirus/2019-ncov/cases-updates/cases-in-us.html.Accessed December 6,2020
2. CDC COVID-19 Response Team: Severe outcomes among patients with coronavirus disease 2019(COVID-19)-United States, February 12-March 16, 2020. Morb Mortal Wkly Rep 2020;69:343-346
3. Lim WS,Emberson JR,Mafham M,et al;The RECOVERY Collaborative Group: Dexamethasone in hospitalized patients with COVID-19-preliminary report. N Eng/ J Med 2020 Jul 17.[online ahead of print]
4. Guérin C, Reignier J, Richard JC, et al; PROSEVA Study Group: Prone positioning in severe acute respiratory distress syndrome.NEng/JMed2013;368:2159-2168
5. Fan E, Del Sorbo L, Goligher EC, et al; American Thoracic Society, European Society of Intensive Care Medicine, and Society of Critical Care Medicine: An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syn-drome.Am J Respir Crit Care Med 2017;195:1253-1263
6. Guerin C, Beuret P, Constantin JM, et al; investigators of the APRONET Study Group, the REVA Network, the Reseau recherche de la Société Francaise dAnesthesie-Reanimation (SFAR-recherche) and the ESICM Trials Group: A prospective international observational prevalence study on prone posi-tioning of ARDS patients: The APRONET (ARDS prone posi-tion network) study. Intensive Care Med 2018; 44:22-37
7. Bellani G,Laffey JG,Pham T,et al;LUNG SAFE Investigators;ESICM Trials Group: Epidemiology, patterns of care, and mor-tality for patients with acute respiratory distress syndrome in-tensive care units in 50 countries. JAMA 2016; 315:788-800
8. Hepokoski ML, Odish M, Malhotra A: Prone positioning in acute respiratory distress syndrome: Why aren't we using it more? J Thorac Dis 2018;10:S1020-S1024
9. Chertoff J: Why is prone positioning so unpopular? J Intensive Care 2016; 4:70
10. Poor AD, Acquah SO, Wells CM, et al: Implementing automatedprone ventilation for acute respiratory distress syndrome via simulation-based training. Am J Crit Care 2020;29:e52-e59
11. Poston JT, Patel BK, Davis AM: Management of critically ill adults with COVID-19.JAMA 2020;323:1839-1841
12. Ziehr DR, Alladina J, Petri CR, et al: Respiratory pathophysi-ology of mechanically ventilated patients with COVID-19:A co-hort study. Am J Respir Crit Care Med 2020; 201:1560-1564
13. Gattinoni L, Coppola S, Cressoni M, et al: COVID-19 does not lead to a "typical" acute respiratory distress syndrome. Am J Respir Crit Care Med 2020;201:1299-1300
14. Gattinoni L, Chiumello D, Rossi S: COVID-19 pneumonia:ARDS or not? Crit Care 2020;24:154
15. Dickerman BA, Garcia-Albeniz X, Logan RW, et al: Avoidable flaws in observational analyses: An application to statins and cancer. Nat Med 2019; 25:1601-1606
16. Petito LC, Garcia-Albeniz X, Logan RW, et al: Estimates of overall survival in patients with cancer receiving different treatment regimens: Emulating hypothetical target trials in the surveillance, epidemiology, and end results (SEER)-medicare linked database.JAMA Netw Open 2020;3:e200452
17. Admon AJ, Donnelly JP, Casey JD, et al: Emulating a novel clinical trial using existing observational data. Predicting results of the PreVent study. Arn Am Thorac Soc 2019; 16:998-1007
18. Gupta S, Hayek SS, Wang W, et al: Factors associated with death in critically ill patients with coronavirus disease 2019 in the US. JAMA Intem Med 2020; 180:1-12
19. Ferguson ND, Fan E, Camporota L, et al: The Berlin definition of ARDS: An expanded rationale, justification, and supplemen-tary material. Intensive Care Med 2012; 38:1573-1582
20. Vincent JL, Moreno R, Takala J, et al: The SOFA(sepsis-related organ failure assessment) score to describe organ dysfunc-tion/failure. On behalf of the working group on sepsis-related problems of the European society of intensive care medicine, Intensive Care Med 1996;22:707-710
21. Austin PC: Balance diagnostics for comparing the distribution of baseline covariates between treatment groups in propen-sity-score matched samples. Stat Med 2009; 28:3083-3107
22. Yang D, Dalton JE: A unified approach to measuring the effect size between two groups usingSAS®. SAS Glob Forum 2012:335-2012
23. Xu S, Ross C, Raebel MA, et al: Use of stabilized inverse pro-pensity scores as weights to directly estimate relative risk and its confidence intervals. Value Health 2010; 13:273-277
24. Robins JM, Hernan MA, Brumback B: Marginal structural mod-els and causal inference in epidemiology. Epidemiology 200;11:550-560
25. Hernan MA, Brumback B, Robins JM: Marginal structural mod-els to estimate the joint causal effect of nonrandomized treat-ments. JAm Stat Assoc 2001; 96:440-448
26. Hernan MA, Robins JM: Using big data to emulate a target trial when a randomized trial is not available. Am J Epidemiol 2016183:758-764
27. Danaei G, Garcia Rodriguez LA, Cantero OF, et al: Electronic medical records can be used to emulate target trials of sus-tained treatment strategies. J Clin Epidemiol 2018; 96:12-22
28. Gupta S, Wang W, Hayek SS, et al: Association between early treatment with tocilizumab and mortality among critically ill patients with COVID-19.JAMA Intern Med 2020;181:41-51
29. Herold T, Jurinovic V, Arnreich C, et al: Elevated levels of IL-6 and CRP predict the need for mechanical ventilation in COVID-19.JAllergy Clin Immunol 2020;146:128-136.e4
30. Landry A, Docherty P, Ouellette S,et al: Causes and outcomes of markedly elevated C-reactive protein levels. Can Fam Physician2017;63:e316-e323
31. Moore C Jr, Ormseth M, Fuchs H: Causes and significance of markedly elevated serum ferritin levels in an academic medical center. JClin Rheumato/2013; 19:324-328
32. Sanders JM, Monogue ML, Jodlowski TZ, et al: Pharmacologic treatments for coronavirus disease 2019(COVID-19): A re-view.JAMA 2020;323:1824-1836
33. Weissman GE, Gabler NB, Brown SE, et al: Intensive care unit capacity strain and adherence to prophylaxis guidelines. J Crit Care 2015;30:1303-1309
34. Tarnow-Mordi WO,Hau C,Warden A,et al:Hospital mortality in relation to staff workload: A 4-year study in an adult intensive-care unit. Lancet 2000; 356:185-189
35. Messerole E, Peine P, Wittkopp S, et al: The pragmatics of prone positioning. Am J Respir Crit Care Med 2002;165:1359-1363
36. Munshi L, Del Sorbo L, Adhikari NKJ, et al: Prone posi-tion for acute respiratory distress syndrome. A systematic review and meta-analysis. Ann Am Thorac Soc 2017; 14:S280-S288
37. COVID-ICU Group on behalf of the REVA Network and the COVID-ICU Investigators: Clinical characteristics and day-90 outcomes of 4244 critically ill adults with COVID-19:A prospective cohort study. Intensive Care Med 2020; 49:1-14
专家述评
潘纯/邱海波 东南大学附属中大医院重症医学科
新型冠状病毒肺炎(COVID-19)已成为全球流行性疾病,目前已经导致全球约450万人死亡[1]。重症COVID-19相关呼吸衰竭是导致临床上预后不良的主要因素,然而,针对重症COVID-19目前尚无特效病因治疗的措施。因此,呼吸功能支持是COVID-19相关呼吸衰竭治疗的主要手段。俯卧位通气是治疗中重度急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的重要措施[2], 然而其对于重症COVID-19相关呼吸衰竭预后的影响,目前尚无循证医学研究证实。
基于68家美国医院的“COVID-19重症患者的治疗和结局”数据库,进行了一项多中心回顾性队列研究[3]。该研究将接受机械通气的低氧血症COVID-19患者(PaO2 /FiO2 ≤ 200 mmHg),依据入ICU两天内是否开始俯卧位通气进行分组,并且使用逆概率加权Cox模型,评价早期俯卧位通气对预后的影响。研究发现,早期俯卧位通气能够降低重症COVID-19患者(PaO2 /FiO2 ≤ 200 mmHg)的住院病死率。
该研究是第一个证实早期俯卧位通气能够改善重症COVID-19患者(PaO2 /FiO2 ≤ 200 mmHg)预后的研究,具有以下几个特征:首先,在COVID-19流行期间,组织俯卧位通气的前瞻性随机对照研究非常困难,该研究基于68家医院ICU数据库,使用逆概率加权均衡两组的基线情况,统计学方法值得的学习和参考;其次,PROSEVA研究证实了俯卧位通气能够改善PaO2 /FiO2 ≤ 150 mmHg的ARDS患者预后,该研究扩展了对于COVID-19机械通气患者的适应症,俯卧位通气能够降低PaO2 /FiO2 ≤ 200 mmHg患者的病死率;第三,该研究也展现了美国医院规模和医疗资源对俯卧位通气实施的影响,这也可以作为医院管理的借鉴。
该研究也仍然存在一些缺陷,首先,本研究为回顾性研究,统计学方法校正了一些混杂因素,但仍有一些潜在的混杂因素, 如俯卧位通气的时长、俯卧位的次数等无法校正;其次,研究中没有记录机械通气中肺保护性通气的情况;第三,每个中心俯卧 位通气的指征和标准是不同的,而且每个中心医疗挤兑的状况对俯卧位通气实施的影响也是不同的。
总之,目前缺乏俯卧位通气对于重症COVID-19患者(PaO2 /FiO2 ≤ 200 mmHg)预后影响的随机对照研究,但该研究已经证实早期应用俯卧位通气能够改善重症COVID-19患者预后。仍然期待患者分层、俯卧位通气的时机、终止指征等方面的研究。
参考文献
1.WHO: WHO Coronavirus Disease (COVID-19) Dashboard.Updated August 31st. Available at: https://covid19.who.int/. Accessed
2.Guerin C, Reignier J, Richard JC, et al: Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368(23):2159-2168
3.Mathews KS, Soh H, Shaefi S, et al: Prone Positioning and Survival in Mechanically Ventilated Patients With Coronavirus Disease 2019-Related Respiratory Failure. Crit Care Med 2021; 49(7):1026-1037
潘纯/杨毅 东南大学附属中大医院重症医学科
新型冠状病毒肺炎(COVID-19)已经被世界卫生组织宣布为全球流行性疾病,已经造成了2亿多人的感染和400多万人的死 亡[1]。重症COVID-19是导致患者死亡的主要原因,而针对重症COVID-19的治疗策略在控制原发病的基础上,呼吸功能支持尤其是俯卧位通气已经成为COVID-19的标准治疗[2]。
一项来自于美国68家ICU关于俯卧位通气对机械通气COVID-19患者临床预后影响的回顾性研究,通过使用逆概率加权均衡患者的基础状况和预先及事后敏感性分析评价患者的临床预后,发现早期俯卧位通气能够改善COVID-19患者的临床预后。
该研究首次证实了俯卧位通气能够改善机械通气COVID-19的预后,其研究方法值得我们学习,研究结论也证实了前期研究的一些结果。
首先,基于大数据的数据分析能够弥补回顾性研究的一些不足,该研究中使用逆概率加权均衡了患者的基础水平,从而使得两组的基线可比,后续的预先及事后敏感性分析可以通过不同的模型证实干预措施对预后的影响,然而,回顾性研究中仍然存在很多的混杂因素,就如文章所说,俯卧位的次数、俯卧位的起始时间、俯卧位的时长等都没有办法进行校正,不过这种方法可以用来进行数据的分析和整合;
其次,该研究选择了早期COVID-19患者进行俯卧位通气治疗,这一纳入标准与PROSEVA研究的标准是一致的[3],针对收入ICU 2天内的机械通气COVID-19患者进行俯卧位通气治疗,能够改善患者的临床预后,这一结果与近期的研究结果是一致的[4];
第三,研究中纳入了PaO2 /FiO2 ≤ 200 mmHg的患者,并且分别对于PaO2 /FiO2 ≤ 150 mmHg和PaO2 /FiO2 ≤ 100 mmHg的患者进行分层,结果发现俯卧位通气不仅可以改善PaO2 /FiO2 ≤ 200 mmHg患者的预后,而且对于两个亚组的患者也都能从俯卧位通气获益,因此,对COVID-19机械通气患者,在PaO2 /FiO2 ≤ 200 mmHg时就需要启动俯卧位通气治疗了;
第四, COVID-19的流行对造成医疗资源的挤兑,该研究也发现,在对于一些ICU床位少及COVID-19发病密度高的地区,由于高级的支持设备,比如ECMO等设备并不充足,俯卧位通气也作为COVID-19机械通气患者的挽救性治疗措施,然而,俯卧位通气不仅可以作为挽救性治疗,本课题组的江苏经验也发现清醒俯卧位通气能够阻止COVID-19的恶化[2],并且改善患者的预后[5]。
总之,该研究提示俯卧位通气能够改善COVID-19机械通气患者的预后,虽然这一结果仍需要前瞻性随机对照研究证实,但这 对于医疗资源不足的状况下,俯卧位通气策略能够缓解COVID-19造成医疗挤兑,进而阻止COVID-19患者病情的恶化。
参考文献
1.WHO: WHO Coronavirus Disease (COVID-19) Dashboard.Updated August 31st. Available at: https://covid19.who.int/. Accessed
2.Sun Q, Qiu H, Huang M, et al: Lower mortality of COVID-19 by early recognition and intervention: experience from Jiangsu Province. Ann Intensive Care 2020; 10(1):33
3.Guerin C, Reignier J, Richard JC, et al: Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368(23):2159-2168
4.Qadri SK, Ng P, Toh TSW, et al: Critically Ill Patients with COVID-19: A Narrative Review on Prone Position. Pulm Ther 2020; 6(2):233-246
5.Ehrmann S, Li J, Ibarra-Estrada M, et al: Awake prone positioning for COVID-19 acute hypoxaemic respiratory failure: a randomised, controlled, multinational, open-label meta-trial. Lancet Respir Med 2021
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







