2021年,这14款重磅新药将在中国获批
2020-12-16 医药魔方 医药魔方
国家药品监督管理局2020年至今已经批准了40款新药(不包括新适应症),数量与往年基本持平,恩美曲妥珠单抗(赫赛莱®)、氯苯唑酸(维达全®)等重磅创新药的上市极大提高了国内癌症和罕见病治疗药物的可及性
国家药品监督管理局2020年至今已经批准了40款新药(不包括新适应症),数量与往年基本持平,恩美曲妥珠单抗(赫赛莱)、氯苯唑酸(维达全)等重磅创新药的上市极大提高了国内癌症和罕见病治疗药物的可及性。 2019年末我们预测的16款重磅新药中已有13款批准上市,在2020年接近尾声之际,我们再来梳理一下2021年有较大希望在国内批准上市的重磅新药,供大家参考。
NO.1 玛巴洛沙韦(Xofluza)
预计批准时间:2021Q1
玛巴洛沙韦是一款由Shionogi和Roche开发的帽状结构依赖性核酸内切酶(cap-dependent endonuclease)抑制剂,是近20年来获批上市的第一个全新药理机制的流感药物,也是唯一一个只需单剂量口服一次的流感药物。 玛巴洛沙韦于2015年10月在日本被授予用于治疗甲型和乙型流感的突破性疗法资格,并于2018年2月正式获批,随后在美国于2018年10月批准上市,目前获批的适应症为流感的治疗和暴露后预防。玛巴洛沙韦结构式 在流感患者中开展的III期临床试验CAPSTONE-2(NCT02949011)结果显示,玛巴洛沙韦 vs. 奥司他韦 vs. 安慰剂的流感症状改善中位时间为73.2 vs. 81.0 vs. 102.3 小时,证明了玛巴洛沙韦单剂给药治疗流感的疗效和安全性。
临床结果 在中国,玛巴洛沙韦被列入临床急需境外新药名单,于2020年6月提交上市申请(JXHS2000074、JXHS2000075),并被纳入优先审评审批程序,目前正在审评中,预计2021Q1获批。
NO.2 吉瑞替尼(Xospata)
预计批准时间:2021Q1
吉瑞替尼是一种口服选择性FLT3激酶抑制剂,由Astellas与Kotobuki Pharmaceutical合作研发,在日本被授予用于FLT3 mut+ 复发性难治性AML的突破性疗法资格,于2018年9月批准上市。吉瑞替尼在美国于2018年11月获批,成为FDA批准的第一个用于复发性难治性AML的FLT3抑制剂,在欧洲于2019年10月获批上市。
吉瑞替尼结构式 急性髓系白血病是原始造血干细胞和祖细胞异常增殖引起的,在所有类型白血病中存活率最低,5年生存率只有约28%。大约30% AML患者存在FLT3突变,包括25%的内部串联重复(ITD)和7%-10%的酪氨酸激酶结构域(TKD)点突变,这些患者的无病生存期和总生存期都更差。而吉瑞替尼已显示出对这两种不同突变ITD和TKD的抑制活性。 在二线治疗FLT3突变的复发/难治性AML的III期临床试验(NCT02421939)中,吉瑞替尼 vs. 化疗显着延长了mOS达到9.3vs. 5.6个月,降低了患者的疾病进展和死亡风险(HR为0.64)。
临床结果 吉瑞替尼于2020年4月在中国提交了治疗FLT3突变的复发/难治性AML的上市申请(JXHS2000033),并被纳入优先审评审批程序,目前该药物的技术审评完成,预计2021Q1获批。
NO.3 奥妥珠单抗(Gazyva)
预计批准时间:2021Q1
Glycart Biotechnology(已被Roche收购)研发的奥妥珠单抗被认为是新一代的anti-CD20单抗,其CDC比利妥昔单抗更弱,但ADCC更强,并且具有更强的直接B细胞杀伤效应。奥妥珠单抗是FDA批准的第一个糖基化修饰的单抗,最早于2013年11月批准上市,用于治疗慢性淋巴细胞白血病和滤泡性淋巴瘤,且已被FDA授予用于狼疮性肾炎的突破性疗法资格。 在一线治疗FL的III期临床试验GALLIUM(NCT01332968)中,奥妥珠单抗联合化疗与利妥昔单抗联合化疗进行对比,受试者的3年无进展生存率明显提升(80.0% vs 73.3%)。在一线治疗CLL的III期临床试验(NCT01010061)中,奥妥珠单抗+苯丁酸氮芥vs. 利妥昔单抗+苯丁酸氮芥vs. 苯丁酸氮芥的mPFS达到26.7vs. 16.3 vs. 11.1个月(HR为0.18)。
销售数据 上市之后,奥妥珠单抗的销售额稳步上升,2019年销售额为5.52亿瑞士法郎。奥妥珠单抗于2019年9月在中国提交进口新药上市申请(JXSS1900059),于2019年12月被纳入优先审评程序,目前处于1轮发补阶段,预计2021Q1获批用于治疗滤泡性淋巴瘤。
NO.4 伊匹木单抗(Yervoy)
预计批准时间:2021Q1
Medarex(已被BMS收购)研发的伊匹木单抗是一种IgG1型靶向CTLA-4单抗,最早于2011年3月在美国获批用于治疗不可切除或转移性黑色素瘤,是FDA批准的第一个针对CTLA4的癌症免疫疗法,也是近十年来FDA批准的第一个黑素瘤药物。 伊匹木单抗在全球范围内开展了多项肿瘤领域不同适应症的临床研究。此前伊匹木单抗联合纳武利尤单抗用于肝细胞癌被FDA授予突破性疗法资格,后批准该适应症,这是目前唯一经FDA批准用于该适应症的双免疫疗法,其通过靶定两个不同的检查点(PD-1和CTLA-4)且以互补方式展现潜在的协同作用机制。 CTLA-4在效应T细胞和调节性T细胞上都有表达,但功能相反。肿瘤组织中存在大量免疫抑制性的Treg,并且CTLA-4的表达水平高于肿瘤浸润CD8+ T细胞。伊匹木单抗具有较强的ADCC/CDC,可以选择性清除Treg,随后扩大特异性识别肿瘤抗原的CD8+T细胞。 在一项针对黑色素瘤的III期临床试验(NCT00094653)中,伊匹单抗单药 vs. 伊匹单抗+ gp100疫苗 vs.gp100疫苗明显改善了mOS达到10.0 vs. 10.1vs. 6.4个月,降低了患者的疾病进展和死亡风险(HR为0.68)。针对肝细胞癌的I/II期临床试验CheckMate -040(NCT01658878)结果显示,在纳武利尤单抗+伊匹木单抗队列中,至少随访28个月后,ORR达到33%,CR达到8%,PR为24%。 伊匹木单抗的2019年销售额为14.89亿美元。伊匹木单抗于2019年12月在中国首次提交进口新药上市申请(JXSS1900071、JXSS1900072),目前处于1轮发补阶段,预计2021Q1获批。
NO.5阿基仑赛(Yescarta)
预计批准时间:2021Q2
阿基仑赛是复星凯特与KitePharma(Gilead Sciences子公司)开发的靶向CD19的自体CAR-T细胞治疗产品,于2017年10月率先在美国获批,成为FDA批准的第一个用于治疗成人复发性难治性大B细胞淋巴瘤的CAR-T细胞疗法,后于2018年8月在欧洲批准上市,已获批的适应症包括弥漫性大B细胞淋巴瘤和原发纵隔B细胞淋巴瘤。
知识卡片 注册临床研究ZUMA-1(NCT02348216)长期随访数据显示,接受治疗的DLBCL患者中ORR为82%,CR为58%,中位随访期51.1个月时患者中位OS为25.8个月,4年OS为44%。用于一线治疗高危LBCL患者的临床研究ZUMA-12(NCT03761056)最新数据显示,单次输注阿基仑赛后,27例疗效可评估患者的ORR达85%,CR达74%,中位随访期9.3个月时中位缓解持续时间 (DOR)、中位总生存期 (OS)、中位无进展生存期 (PFS) 尚未达到。 阿基仑赛的2019年全球销售额为4.56亿美元,于2020年2月在中国提交了上市申请(CXSS2000006),这是首个在中国申请上市的CAR-T产品,并被纳入优先审评审批程序,后于2020年10月进行了现场核查,预计2021Q2获批。此外,药明巨诺的瑞基仑赛也已处于注册审评阶段,也有望于2021年批准上市。
NO.6 Satralizumab(Enspryng)
预计批准时间:2021Q3
Roche的satralizumab最先于2020年6月在日本获批上市,后于2020年8月在美国上市。这是FDA批准的第一个也是唯一一个用于治疗视神经脊髓炎(NMOSD)的IL-6R抑制剂,也是唯一一个可以皮下注射的NMOSD药物,适用于anti-aquaporin-4抗体阳性的患者。 Satralizumab采用了最新的再循环抗体技术,具有较长的半衰期,可以由患者自己或看护人完成注射,每四周一次。 在针对NMOSD的III期试验SAkuraStar(NCT02073279)中,接受satralizumab单药治疗与安慰剂相比,患者疾病复发的比例为30% vs 50%(HR为0.45, p=0·018);III期试验SAkuraSky(NCT02028884)结果显示,接受satralizumab+背景疗法 vs.安慰剂+背景疗法的患者疾病复发比例为20% vs 43%(HR为0.38)。 Satralizumab于2020年5月在中国提交了用于治疗患有NMOSD的成年及青少年患者,作为单药治疗或者与免疫抑制剂联合治疗的上市申请(JXSS2000011),并于7月被正式纳入优先审评审批程序,预计2021Q3获批。
NO.7 美泊利单抗(Nucala)
预计批准时间:2021Q3
美泊利单抗由GSK研发,最早于2015年11月在美国批准上市,是第一个用于治疗嗜酸性粒细胞性哮喘的anti-IL5单抗,也是第一个用于治疗嗜酸性肉芽肿性血管炎和显着降低嗜酸性粒细胞增多综合征发作的生物靶向药物。 在针对变应性肉芽肿性血管炎的III期临床试验(NCT02020889)中,接受美泊利单抗vs. 安慰剂治疗的患者,≥24周的缓解率达到28% vs. 3%。在针对慢性鼻-鼻窦炎伴鼻息肉的III期临床试验SYNAPSE(NCT03085797)中,美泊利单抗+SoC相比于安慰剂内窥镜鼻息肉评分较基线变化之差为-0.73,成为第一个治疗鼻息肉并报道积极III期临床结果的anti-IL-5生物制品。
临床结果 美泊利单抗的2019年全球销售额为7.68亿英镑。该药在2020年7月提交了用于治疗嗜酸性肉芽肿性多血管炎的上市申请(JXSS2000021),随后被纳入优先审评审批程序,目前处于1轮发补阶段,预计2021Q3获批。
NO.8 迪妥昔单抗(Qarziba)
预计批准时间:2021Q3
百济神州从EUSA Pharma(已被Jazz Pharmaceuticals收购)引进的迪妥昔单抗是一种anti-GD2单抗,最早于2015年3月在美国获批,是FDA批准的第一个专门治疗儿童高风险神经母细胞瘤的药物,同年8月在欧洲批准上市。 神经母细胞瘤是儿童最常见的颅外实体瘤,也是婴儿最常见的癌症,美国每年大约新发700例,其中50%被诊断为高风险。 III期临床试验(NCT00026312)数据显示,迪妥昔单抗联合GM-CSF和阿地白介素免疫治疗与高危神经母细胞瘤患者的标准治疗相比可显着改善预后,2年存活率达到86% vs. 75%。
临床试验 迪妥昔单抗自上市以来,销售额稳步上升,2019年销售额为1.14亿美元。2018年11月,迪妥昔单抗被纳入第一批临床急需境外新药名单。该药在中国内地没有开展临床试验,于2020年11月直接提交进口新药上市申请(JXSS2000048),并被纳入优先审评审批程序,目前正在审评中,预计2021Q3获批用于治疗≥12月龄的高危神经母细胞瘤。
NO.9 司美格鲁肽(Ozempic)
预计批准时间:2021Q3
司美格鲁肽是一种GLP-1受体激动剂,由诺和诺德研发,最早于2017年12月在美国上市,用于治疗II型糖尿病,并于2018年2月和3月分别在欧洲和日本获批上市。 在治疗II型糖尿病的SUSTAIN系列试验中,司美格鲁肽的降糖和减重效果都优于西格列汀、Bydureon (艾塞那肽微球)和度拉糖肽。此外,司美格鲁肽还在开展针对糖尿病肾病、外周动脉疾病以及非酒精性脂肪肝炎等适应症的临床研究。
临床结果 司美格鲁肽的销售额增长迅速,2019年全球销售额达到112亿丹麦克朗。该药于2020年4月在中国提交了上市申请(JXSS2000006、JXSS2000007),目前处于1轮发补阶段,预计2021Q3获批。
NO.10 risdiplam(Evrysdi)
预计批准时间:2021Q3
risdiplam是由PTC Therapeutics和Roche开发的一款SMN2剪接修饰剂,能够改变SMN2外显子7的选择性剪接,产生全长的SMNmRNA,从而表达功能性SMN蛋白。risdiplam于2020年8月7日首次在美国上市,用于2个月及以上儿童和成人患者治疗脊髓性肌萎缩症,这是FDA批准治疗该适应症的首个口服小分子药物。 在针对脊髓性肌萎缩症的II/III期试验FIREFISH(NCT02913482)中,治疗12月后,41%婴儿患者可在无辅助情况下维持至少5秒坐姿。在III期试验SUNFISH(NCT02908685)中,risdiplam 相比于安慰剂显着改善了MFM-32得分达到+1.55分。
中国研发进度 Risdiplam于2020年4月向NMPA递交了治疗脊髓性肌萎缩症的上市申请(JXHS2000042),随后于2020年6月被纳入优先审评审批程序,目前该药物的技术审评已完成,预计2021Q3获批。
NO.11 赛沃替尼(savolitinib)
预计批准时间:2021Q3
赛沃替尼是一种口服的高选择性小分子c-Met抑制剂,MET是继EGFR、ALK、HER2、ROS1等靶点之后发现的又一非小细胞肺癌靶点,在非小细胞肺癌患者中约有2-3%存在MET外显子14跳跃突变。 赛沃替尼最初由和黄医药发现,于2011年12月与AstraZeneca就赛沃替尼签订了全球专利许可、合作开发和商业化协议。目前,和黄医药与AstraZeneca合作,针对多种实体瘤在全球开展赛沃替尼单药和联合疗法的临床试验。赛沃替尼有望成为首个代表中国走向全球的肺癌靶向创新药物。
交易&权益 用于治疗MET exon 14跳跃突变的原发性肺肉瘤样癌和其他类型NSCLC的II期试验(NCT02897479)结果显示,在61例可评估患者中,ORR达到47.5%,DCR为93.4%;在所有患者中,mPFS达到6.8个月。
临床结果 赛沃替尼于2020年5月首次在中国提交了上市申请(CXHS2000012、CXHS2000013),这是中国首个选择性c-MET抑制剂的NDA申请,后于2020年7月被纳入优先审评审批程序,目前已完成技术审评,预计2021Q4获批用于MET exon 14跳变的局部晚期或转移性的非小细胞肺癌。
NO.12 奥瑞巴替尼(olverembatinib)
预计批准时间:2021Q4
奥瑞巴替尼是一种新型口服第三代Bcr-Abl抑制剂,靶向Bcr-Abl突变(包括T315I),也是中国首个针对慢性髓系白血病耐药的Bcr-Abl抑制剂。奥瑞巴替尼由亚盛医药开发,此前被FDA授予快速通道资格和孤儿药资格。 第一代酪氨酸激酶抑制剂(TKI)伊马替尼作为一线治疗药物使 CML 的治疗有了重大突破。2001年8月,发现T315I突变会消除伊马替尼等药物与蛋白的关键氢键作用力,使CML患者对目前的一代、二代BCR-ABL抑制剂均耐药。
转化医学- Bcr-Abl相关文献 奥瑞巴替尼在两项治疗TKI耐药的CML的II期临床试验(NCT03883100)和(NCT03883087)中,T315I突变CML-AP患者CHR为60.9%,MCyR为52.2%,CCyR为39.1%,MMR为26.1%;T315I突变CML-CP患者CHR为96.8%,MCyR为75.6%,CCyR为65.9%,MMR为48.8%,均显示出积极的临床疗效。 奥瑞巴替尼于2020年9月在中国递交了上市申请(CXHS2000038),于2020年10月被纳入优先审评审批程序,目前在审评中,预计2021Q4获批。
NO.13 阿泊替尼(Ayvakyt)
预计批准时间:2021Q3
基石药业从Blueprint Medicines引进的阿泊替尼是第一个针对胃肠道间质瘤的精准疗法,也是唯一一个对PDGFRA exon 18 (包括PDGFRA D842V)突变型GIST具有高活性的药物,并于2020年1月和9月先后在美国和欧洲上市,此前FDA曾两次授予阿泊替尼突破性疗法资格,用于PDGFRA D842V突变型GIST和SM。 在针对GIST的I期临床试验NAVIGATOR(NCT02508532)中,ORR达到88%。
II期中国桥接试验(NCT04254939)结果显示,在PDGFRA D842V突变的GIST患者中,ORR达到62.5%。在4L+ GIST患者中,ORR达到26.1%。 阿泊替尼于2020年4月向NMPA递交了上市申请(JXHS2000050,JXHS2000051,JXHS2000052),并于2020年7月被纳入优先审评程序,目前处于1轮发补阶段,预计2021Q4获批用于治疗PDGFRA外显子18突变(包括PDGFRA D842V突变)GIST。
NO.14 纬迪西妥单抗(disitamab vedotin)
预计批准时间:2021Q4
纬迪西妥单抗由荣昌生物研发,是一种新型anti-HER2抗体偶联药物,也是首个国内自主研发申请上市的ADC药物。纬迪西妥单抗用于治疗晚期或转移性胃癌以及胃食管交界处癌获FDA临床试验许可并授予其快速通道资格,以及用于二线治疗HER2阳性的局部晚期/转移性尿路上皮癌被FDA授予快速通道和突破性疗法资格。
数据来源:NextPharma
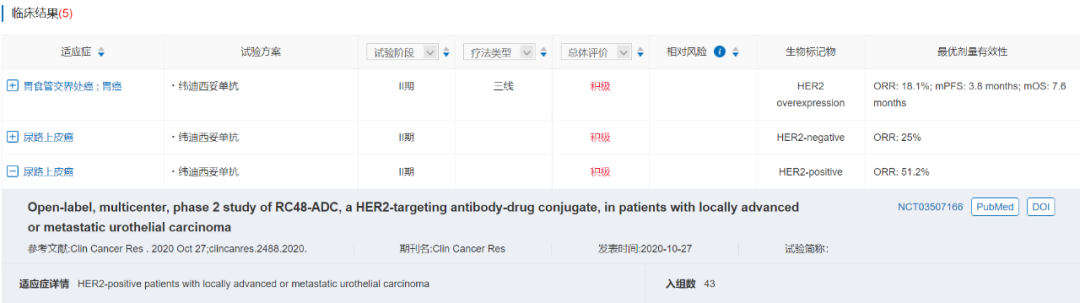
生物序列 三线治疗胃癌或胃食管交界处癌的II期临床试验(NCT03556345)结果显示,纬迪西妥单抗整体ORR为18.1%,mPFS达到3.8个月,mOS达到7.6个月。在针对局部晚期/转移性UC的II期临床试验(NCT03507166)中,纬迪西妥单抗整体ORR为51.2%。
数据来源:NextPharma
临床结果 2020年8月,纬迪西妥单抗提交上市申请(CXSS2000044),适应症为复发/转移后至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部癌),随后于9月被纳入优先审评审批程序,目前处于审评阶段,预计2021Q4获批。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#重磅#
88
中国患者能越来越早用到新药了
124
新药上市获批,使得更多的患者获益,利好的消息。#新药#
202
加油
178
大进展。希望价格也合适。
121
哇
173
#签到#
83