Genes Dev:顾伟实验室解析p53抑癌功能的终极武器——铁死亡和mTOR
2020-12-31 Bio生物世界 Bio生物世界
众所周知, p53是一个拥有广泛而强大功能的抑癌基因。超过一半的肿瘤患者带有p53突变。p53基因敲除(KO)小鼠会在发育早期就形成肿瘤。
众所周知, p53是一个拥有广泛而强大功能的抑癌基因。超过一半的肿瘤患者带有p53突变。p53基因敲除(KO)小鼠会在发育早期就形成肿瘤。
自从1979年p53基因被发现以来,p53一直是分子生物学和肿瘤学的一个研究热门。在 Nature 杂志2017年的一项统计中,p53以绝对优势位列过去几十年最热门研究基因榜第一名。

40多年的研究,揭示了p53在抑制肿瘤中的多种作用机制。p53主要作为转录因子,激活或者抑制多种下游靶基因的转录来形式功能。这些靶基因的作用主要包括诱导细胞周期停滞,DNA修复,细胞代谢改变,细胞衰老,细胞凋亡,以及新近发现的诱导细胞发生铁死亡(ferroptosis)。
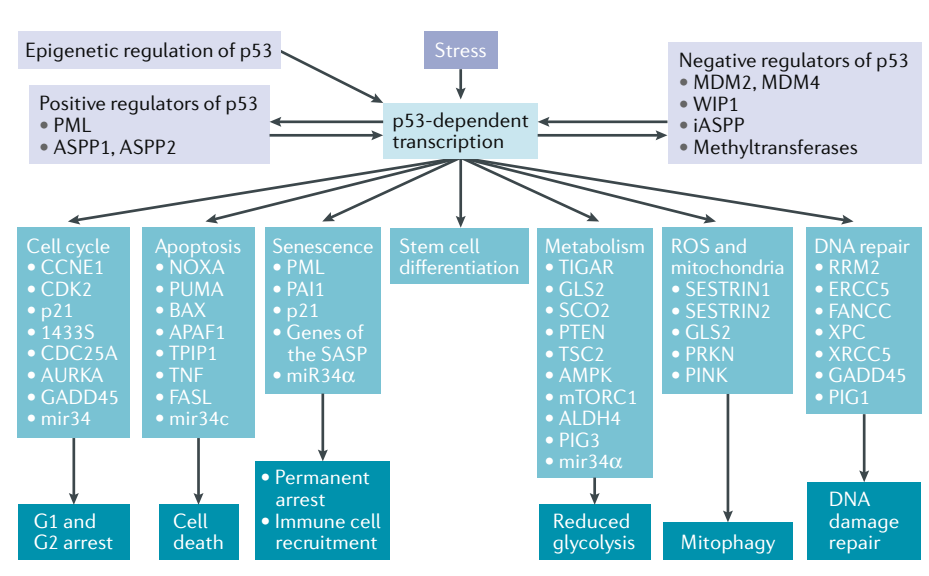
但是,p53是如何调节这些功能,以及这些功能里哪一项/哪几项才是真正起到抑制肿瘤的作用的?关于这两个问题,学术界一直存在一些争议。
2012年以前,学界认为p53的诱导细胞周期停滞,衰老或者凋亡(cell cycle arrest, senescence and apoptosis)已经足以解释其抑癌功能。
然而在2012-2013年,三项研究(两篇Cell + 一篇 Cell Reports)推翻了这一观点。其中最著名的一篇文章来自于美国哥伦比亚大学医学院顾伟教授实验室(Cell,2012)。
顾伟教授是p53领域的国际权威科学家之一。在过去二十多年的研究里,顾伟教授实验室诞生了p53功能及调控的多项重要成果(主要结论发表在十余篇CNS正刊+数篇CNS子刊之上)。其中最主要的发现之一是揭示了乙酰化修饰对于p53功能的重要性。
早在1997年,顾伟教授率先发现p53的C端结构域可以被CBP乙酰化修饰从而促进其蛋白稳定和功能(Cell,1997)。这是学术界在蛋白乙酰化修饰被发现之后,最早报道非组蛋白也能发生乙酰化修饰的研究之一。这项研究也开启了非组蛋白乙酰化修饰的研究热潮。
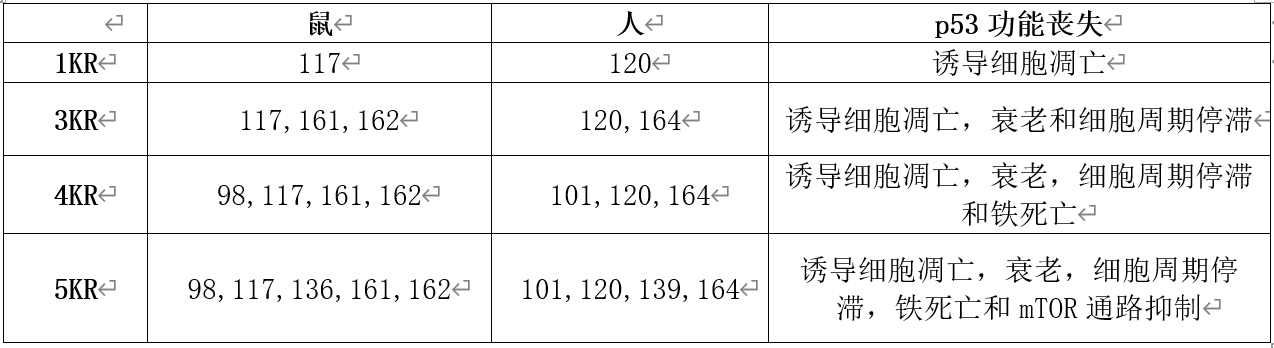
随后在2006年,顾伟实验室发现p53 K120可以被乙酰化修饰(Mol cell, 2006)。p53 K120R的乙酰化缺失突变体失去对PUMA基因的激活能力,从而无法诱导细胞凋亡。这一突变体p53也被称为p53 1KR。
两年之后,顾伟实验室继续鉴定了p53 164位(对应于小鼠的161和162位)可以发生乙酰化(Cell,2008)。该位点的KàR突变将使p53失去激活p21以及诱导细胞周期停滞和细胞衰老的功能。
接下来的2012年,利用p53 3KR(120,161和162)突变小鼠,顾伟教授等发现p53在失去诱导三项经典抑癌功能的诱导细胞周期停滞,衰老或者凋亡后,依然可以有抑癌功能(Cell,2012)。特别地,p53 3KR在丧失激活多个传统经典p53靶基因(PUMA,NOXA以及p21等)的同时,依然可以激活一些代谢相关的靶基因。这提示了调节代谢的功能可能是p53抑制肿瘤的关键。
2015年,顾伟教授课题组首次揭示了p53能够通过抑制胱氨酸—谷氨酸转运子SLC7A11从而促进细胞铁死亡(Nature,2015)。而这一功能受到p53 101位(对应小鼠98位)乙酰化修饰的调控(Cell Reports,2017)。
那么是否在3KR的基础上,再消除p53介导铁死亡的功能,就可以使p53不再能够抑制肿瘤?
在12月10号提前online在 Genes & Development 期刊的一篇文章里,顾伟团队的最新研究回答了这一问题。
根据之前的研究成果,顾伟团队首先构建了p53 4KR(3KR基础上加上98位KR突变)小鼠。3KR的小鼠和正常小鼠近似,很少产生肿瘤。但是在进一步失去诱导铁死亡的功能后,4KR小鼠在生长后期产生肿瘤的比例大幅提高。这个结果表明诱导铁死亡是p53抑制肿瘤的重要机制之一。
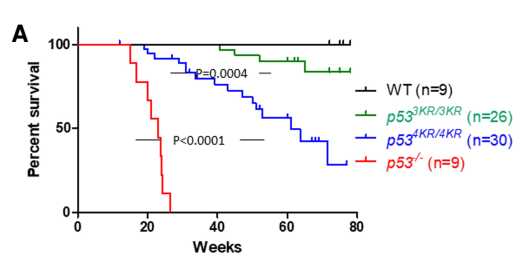
但奇怪的是,4KR小鼠虽然得癌症的几率比正常小鼠高很多,但却并不像p53 KO小鼠一样在生长早期就发生肿瘤。这表明4KR的p53对肿瘤仍然具有一定的抑制功能,可以延缓肿瘤发生。另外,在MDM2 KO的小鼠中,由于p53的过度激活,小鼠会在胚胎期死亡。如果KO MDM2的同时也KO p53,则可以逆转这种胚胎死亡。但是4KR的小鼠只能部分地修复MDM2 KO带来的胚胎致死。这也反映了4KR的p53仍然具有某些功能。
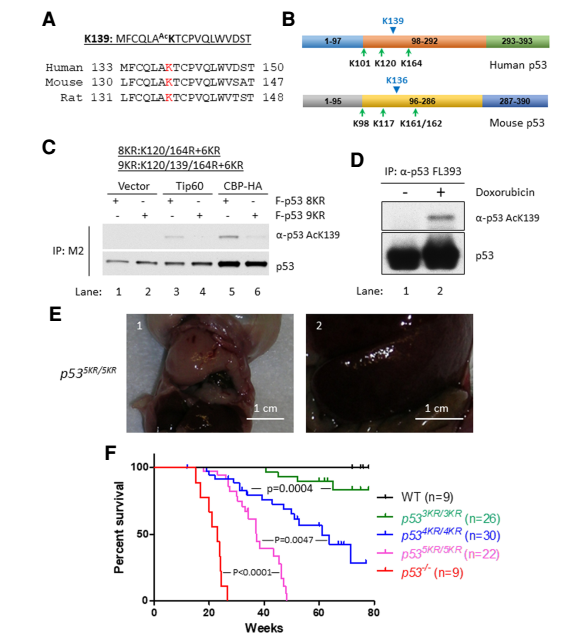
那么除了铁死亡之外,p53还能通过什么机制来抑制肿瘤呢?
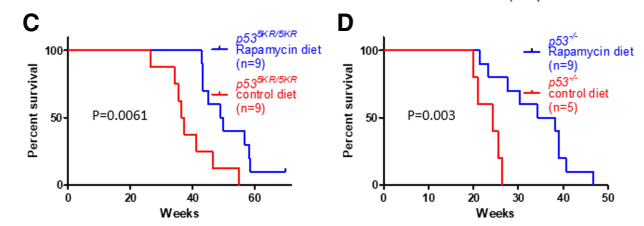
作者进一步分析p53可能发生乙酰化的位点,顺利找到了p53 139位赖氨酸(对应小鼠136位)可以发生乙酰化修饰。并且如果在4KR基础上把小鼠p53 136位也进行KR突变,产生的5KR小鼠100%在50周之前产生了肿瘤。这一结果已经十分接近p53 KO的小鼠。并且5KR小鼠基本不会发生胚胎致死。这表明139位乙酰化,是调节p53抑制肿瘤和导致胚胎致死的最终关键。
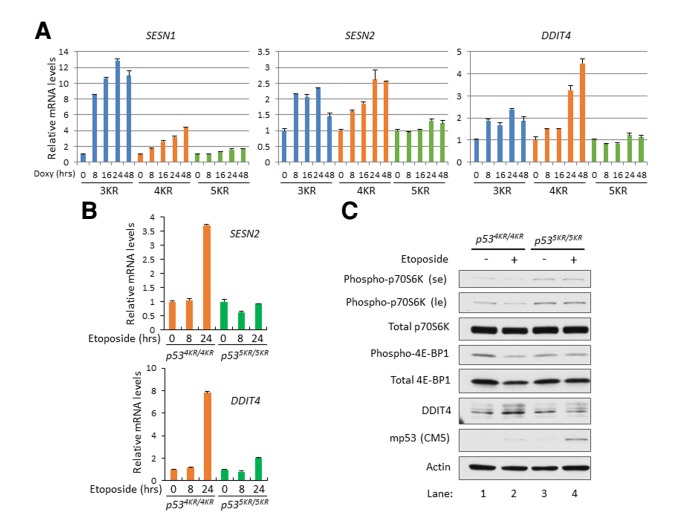
那么139位乙酰化到底通过什么机制来发挥作用?
进一步的研究表明139位点的乙酰化对于p53抑制mTOR通路有重要作用。p53可以通过多种方式抑制mTOR通路,其中诱导SESTRIN家族蛋白SENS1和SENS2,以及激活DDIT4(也称为REDD1)是两个重要途径。果然,5KR p53相对于4KR丧失了激活这几个基因的能力,从而不再能抑制mTOR通路。
进一步的回复实验,在p53 5KR和KO小鼠中,通过向鼠粮添加mTOR抑制剂雷帕霉素(rapamycin),果然能够有效减缓小鼠肿瘤的发生。
综上,该研究延续和发展了顾伟教授实验室十多年的研究方向。证明了调节铁死亡和mTOR通路对于p53抑癌功能的重要性。另外,铁死亡本质上也是一种代谢性细胞死亡形式,可见p53对于肿瘤代谢的调控是其抑癌功能不可或缺的一环。
至此,顾伟教授团队通过层层分解剖析,成功将p53这个可能是最重要的抑癌基因的功能解析了出来,为未来靶向p53通路,特别是在p53突变的肿瘤中进行针对性治疗提供了理论基础。
附p53乙酰化突变及相应功能列表
通讯作者介绍:顾伟,1986年毕业于北京大学,1995年获美国哥伦比亚大学博士学位,2007年至今在哥伦比亚大学医学中心担任正教授、哥伦比亚大学Irvine Cancer Center的Abraham and Mildred Goldstein Professor。
顾伟教授主要从事p53在肿瘤抑制和老化两方面的课题研究。他在p53相关调控通路(乙酰化和去泛素化)研究领域取得了杰出成就,在 Cell、Nature、Science、Nature Cell Biol.、Nature Genetics、Molecular Cell和Cell Metab.等国际权威杂志上发表论文50余篇,包括以通讯作者在Cell(7篇)、Nature(6篇)和Science(1篇)发表论文14篇,论文总被引38844次,并担任Cell、Nature、Science和PNAS等国际权威期刊的特约评审人。
原始出处:
Ning Kon , Yang Ou , Shang-Jui Wang ,et al.mTOR inhibition acts as an unexpected checkpoint in p53-mediated tumor suppression. Genes Dev . 2020 Dec 10. doi: 10.1101/gad.340919.120.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Dev#
0
#抑癌#
80
#Gene#
76
#解析#
66
#p53#
59