盘点:肠道菌群如何影响患癌风险及机体对疗法的反应
2017-05-18 生物谷 生物谷
我们机体的肠道中居住着数以万亿计的细菌(肠道微生物),其能够帮助决定机体患癌的风险,以及对癌症疗法所产生的反应;每个人机体中特殊的肠道微生物菌群都同其免疫系统之间保持着持久的联系;而且肠道微生物对于确保机体免疫系统能否有效抵御疾病非常关键,比如流感,甚至更为严重的癌症等疾病。 目前研究人员正在通过研究来确定机体中特殊的肠道细菌如何能够
我们机体的肠道中居住着数以万亿计的细菌(肠道微生物),其能够帮助决定机体患癌的风险,以及对癌症疗法所产生的反应;每个人机体中特殊的肠道微生物菌群都同其免疫系统之间保持着持久的联系;而且肠道微生物对于确保机体免疫系统能否有效抵御疾病非常关键,比如流感,甚至更为严重的癌症等疾病。
目前研究人员正在通过研究来确定机体中特殊的肠道细菌如何能够帮助确定个体的患癌风险,以及是否“修改”肠道微生物的组成就能够帮助控制个体癌症的进展以及预测癌症患者对疗法所产生的反应。
你的肠道菌群
每个人的肠道菌群都是非常特殊的,其就好像指纹一样;在我们出生的最初几年里,这些肠道菌群都是可塑的,同时其也能够反映我们在出生时的一些状况。比如相比顺产的婴儿而言,经过剖腹产出生的婴儿机体中有益菌群的水平较低,而有害菌群的水平却较高;相比母乳喂养的婴儿而言,研究者也在人工喂养的婴儿机体中发现了类似的模式,这也就表明,通过饮食影响婴儿机体对细菌的暴露或许能够改变其早期机体中的肠道微生物组成。
然而研究人员并不清楚随着婴儿慢慢长大后期机体所发生的变化,但研究者们认为,通过剖腹产出生的婴儿不仅机体中含有不同种类的细菌,而且其很有可能患上过敏症和免疫系统相关的疾病,比如哮喘症等。
微生物群落和癌症风险
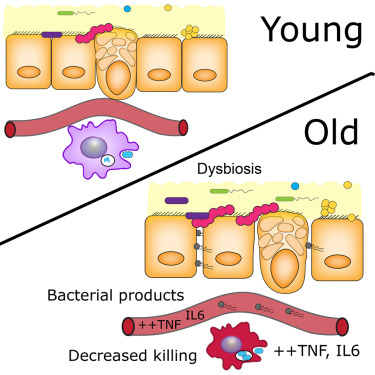
机体肠道和免疫系统之间存在着密切的关联,正如我们机体肠道菌群能够控制免疫系统一样,机体的免疫系统还能够控制肠道菌群,有研究表明,这种相互作用在决定个体患癌风险上扮演着关键的角色。
缺失特定免疫分子(抗炎性细胞因子)的小鼠往往免疫反应会变得迟缓,而且其机体肠道中有害细菌的水平较高,这意味着,强大的免疫反应能够确保有害细菌在肠道中的水平并不会太高。相比机体中抗炎性细胞因子水平充足的小鼠而言,这些小鼠同时对肠癌也较为易感,这种升高的癌症风险能够通过粪便移植而转移到正常小鼠机体中,这其中就包括从供体小鼠机体中收集粪便,随后移植到受体小鼠机体中。
来自供体小鼠机体中的粪便中含有能够反映其肠道菌群的细菌,这种高风险小鼠机体的粪便中含有许多有害细菌,一旦其被转移到受体小鼠机体后,这些细菌就会在受体小鼠肠道中迅速繁殖,并且改变受体小鼠肠道的微生物组成。研究人员通过研究发现,当新型的肠道菌群在受体小鼠机体中建立后,其患肠癌的风险就会增加。
最近一项在人类机体中进行的研究就得出了与上述研究平行的结果,而且研究者还发现,长期使用抗生素或许会增加个体患肠癌的风险。众所周知,抗生素能够干扰肠道菌群的组成,就好像在缺失抗炎性细胞因子小鼠机体的表现那样,最终会导致小鼠机体中有害细菌的水平升高以及患肠癌风险的增加。
肠道菌群和化疗
此前,一篇刊登在国际著名杂志Nature上的综述文章中,研究人员就阐明了肠道菌群在患者对化疗产生反应过程中所扮演的关键角色;研究者发现,肠道菌群能够以两种方式来确定化疗的效力,即通过激活化疗药物,或者是通过与机体免疫系统的相互作用。研究人员在缺失肠道菌群的小鼠中已经对上述机制进行了详细地描述了,诸如无菌小鼠,其在完全无菌的环境中进行繁殖,这些小鼠并没有暴露于外部的细菌中,而且其机体中的任何部分也不含有细菌。
有研究表明,相比正常小鼠而言,对无菌小鼠的化疗作用往往并不明显,而且无菌小鼠机体的肿瘤往往会发展迅速;这或许是因为化疗药物能够开启一种特殊的免疫反应,而这些免疫反应能够通过一种炎症过程来杀灭肿瘤细胞;这项研究中,研究者发现,相比正常小鼠而言,无菌小鼠在接受化疗后,其机体肿瘤中炎性标志物的水平较低。这就表明,肠道菌群和免疫系统之间的交流对于癌症疗法的成功性非常关键。
很多化疗药物都会以一种无活性的形式应用于患者机体中,随后这些药物就会被患者机体肝脏中的特殊酶类或者肠道菌群直接激活,不同水平的肝脏酶类往往会帮助决定有效的化疗方法如何对肿瘤细胞进行杀灭作用。相比正常小鼠而言,无菌小鼠的肝脏中含有大量负责对化疗药物进行解毒的肝脏酶类,因此其往往能够很快清除掉化疗药物的药效,这也就使得化疗药物无法有充足的时间来杀灭小鼠机体中的肿瘤细胞,并且也无法对药物的疗效进行调节了。
相比正常小鼠而言,肠道中有害细菌水平较高的小鼠往往会对某些化疗药物表现出过度活跃的状态,尽管研究者认为这会增加化疗药物杀灭肿瘤细胞的能力,但同时却会诱发一些不必要的副作用产生,因为很多化疗药物无法有效区分机体正常的细胞和癌细胞。
肠道菌群和腹泻
化疗药物最常见的副作用就是腹泻,化疗诱导的腹泻实际上具有致命的危害,其会让患者流失很多关键的营养物质,从而使其机体更加容易引发严重感染和死亡。类似于癌症发生和疗法一样,腹泻和肠道菌群的改变也存在一定关联,一项尚未发表的研究报告中,研究人员发现,化疗前机体肠道中较高水平的变形菌或许会使得小鼠腹泻加重并且加速小鼠体重的下降。
基于人类机体的临床试验,越来越多的证据都表明,在患者开始进行癌症疗法之前,其机体粪便中肠道菌群的水平或许能够帮助预测患腹泻的可能性,同时研究者还在放疗治疗的患者机体中发现了类似的研究结果。
我们是否能够做出改变?
相关研究为研究人员提供了一定的机会来通过修饰肠道菌群来优化患者癌症疗法的治疗效果,比如通过粪便转移疗法、摄入益生菌,甚至是改变患者的饮食习惯等等。在化疗开始之前理解个体的风险并且对其进行修饰,就能够有效确保患者机体化疗反应和毒性之间的完美平衡。
目前研究人员正在阿德莱德大学进行研究来鉴别能够帮助确定患者对化疗产生反应的特殊细菌菌群,一旦研究人员取得了相应的研究成果,很多能够降低患者患病风险的方法或许就能够被评估并且转移到人类患者机体的研究中去。
原始出处
【1】Christoph A. Thaiss,Niv Zmora,Maayan Levy & Eran Elinav. The microbiome and innate immunity.Nature 535, 65–74 (07 July 2016)
【2】Hu B1, Elinav E, Huber S, Strowig T,et al. Microbiota-induced activation of epithelial IL-6 signaling links inflammasome-driven inflammation with transmissible cancer.Proc Natl Acad Sci U S A. 2013 Jun 11;110(24):9862-7.
【3】Yin Cao, Kana Wu, Raaj Mehta,et al.Long-term use of antibiotics and risk of colorectal adenoma.BMJ DOI:10.1136/gutjnl-2016-313413
【4】Roy S,Trinchieri G.Microbiota: a key orchestrator of cancer therapy.Nat Rev Cancer doi: 10.1038/nrc.2017.13.
【5】Noriho Iida1,Amiran Dzutsev,C. Andrew Stewart,et al.Commensal Bacteria Control Cancer Response to Therapy by Modulating the Tumor Microenvironment.Science DOI: 10.1126/science.1240527
【6】Felcy Pavithra Selwyn,Sunny Lihua Cheng,Theo K. Bammler,et al.Developmental Regulation of Drug-Processing Genes in Livers of Germ-Free Mice. Toxicol Sci DOI:10.1093/toxsci/kfv110
【7】Silvia H.S.P.Pedroso1,Angélica T. Vieira1,Rafael W. Bastos,et al.Evaluation of mucositis induced by irinotecan after microbial colonization in germ-free mice.Microbiology doi: 10.1099/mic.0.000149
【8】Alan Carlotto,Virginia L.Hogsett,Elyse M. MaioriniThe Economic Burden of Toxicities Associated with Cancer Treatment: Review of the Literature and Analysis of Nausea and Vomiting, Diarrhoea, Oral Mucositis and Fatigue. PharmacoEconomics DOI: 10.1007/s40273-013-0081-2
【9】Dubin K,Callahan MK,Ren B, et al.Intestinal microbiome analyses identify melanoma patients at risk for checkpoint-blockade-induced colitis. Nat Commun doi: 10.1038/ncomms10391
【10】James A. Covington,Linda Wedlake,Jervoise Andreyev,et al.The Detection of Patients at Risk of Gastrointestinal Toxicity during Pelvic Radiotherapy by Electronic Nose and FAIMS: A Pilot Study.Sensors doi:10.3390/s121013002
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#癌风险#
79
肠道菌群影响患癌风险。
96
肠道菌群可以影响治疗。
83
肠道菌群的益处。
86
学习了,谢谢分享
82
我也正在写这方面的文章,希望共同进步!
80
#肠道菌#
64
#患癌风险#
59
#患癌#
55
肠道菌群与免疫的关系是研究热点
75