Nat Med:AI驱动的血液WGS ctDNA检测平台——MRD-EDGE,可高灵敏度预测癌症复发
2024-07-15 测序中国 测序中国 发表于上海
研究团队开发了一种由机器学习引导的血浆全基因组测序(WGS)ctDNA信号富集平台——“MRD-EDGE”,可以极高敏感度监测肿瘤负荷(TMB)。
导读
近年来,液体活检技术在癌症诊断和监测领域取得了显著进展,这是一种非侵入性的诊断方法,通过分析体液中的生物标志物(如ctDNA等)来检测疾病状态,特别是在癌症中。最近,科研人员的研究重点是将液体活检扩展应用到低肿瘤分数(TF)环境中,包括治疗反应监测或微小残留病灶(MRD)评估。为克服这些环境下ctDNA的稀缺性,人们通常采用深度靶向测序技术来捕获肿瘤信息定制panel或常见癌症驱动基因的突变;但现有检测方法普遍存在漏检现象,此外MRD灵敏度也需进一步提高。
近日,威尔康奈尔医学院、纽约基因组中心(NYGC)和纪念斯隆-凯特琳癌症中心(MSK)的科研人员合作在Nature Medicine上发表了题为“Ultrasensitive plasma-based monitoring of tumor burden using machine-learning-guided signal enrichment“。研究团队开发了一种由机器学习引导的血浆全基因组测序(WGS)ctDNA信号富集平台——“MRD-EDGE”,可以极高敏感度监测肿瘤负荷(TMB)。该研究利用MRD-EDGE识别了多种癌症类型的术后MRD,检测了肺癌中TF对新辅助免疫治疗的响应变化,并证明了癌前结直肠腺瘤中ctDNA的脱落。这项新技术有望改善癌症早期诊断及治疗,并可在治疗过程中密切监测肿瘤反应。
该研究共同通讯作者Dan Landau博士表示:“我们能够实现显著的信噪比增强,可在标准临床方法之前数月甚至数年检测到癌症复发。”

文章发表在Nature Medicine
主要研究内容
液体活检技术在具体实现方面进展缓慢。迄今为止,大多数方法都针对相对小型的癌症相关突变组合,但这些突变在血液中往往过于稀少,无法可靠地被检测到,导致无法准确、及时发现癌症复发。
几年前,Landau博士及其同事提出了一种替代方法,即通过血浆全基因组测序(WGS)进行全基因组突变整合,来整合癌症基因组中成千上万的单核苷酸变异(SNV)和拷贝数变异(CNV),以测序广度取代测序深度;此外,研究团队还设计了一种支持向量机方法( SVM)“MRDetect”(错误抑制框架),以抑制因WGS错误而产生的低质量cfDNA SNV伪影。经验证,该方法可收集更多的“信号”,从而实现对肿瘤DNA更敏感、逻辑上更简单的检测。
在上述工作的基础上,研究团队再次突破,使用先进的机器学习策略(类似于ChatGPT和其他流行的人工智能应用程序)来检测测序数据中的细微模式,特别是将提示癌症的模式与提示测序错误和其他“噪音”的模式区分开来;并基于此开发了MRD-EDGE。MRD-EDGE平台由MRD-EDGESNV和MRD-EDGECNV两个主要模块组成,分别用于SNV和CNV的检测;其可整合SNV和CNV的互补信号,提高血浆WGS中的ctDNA信号富集。
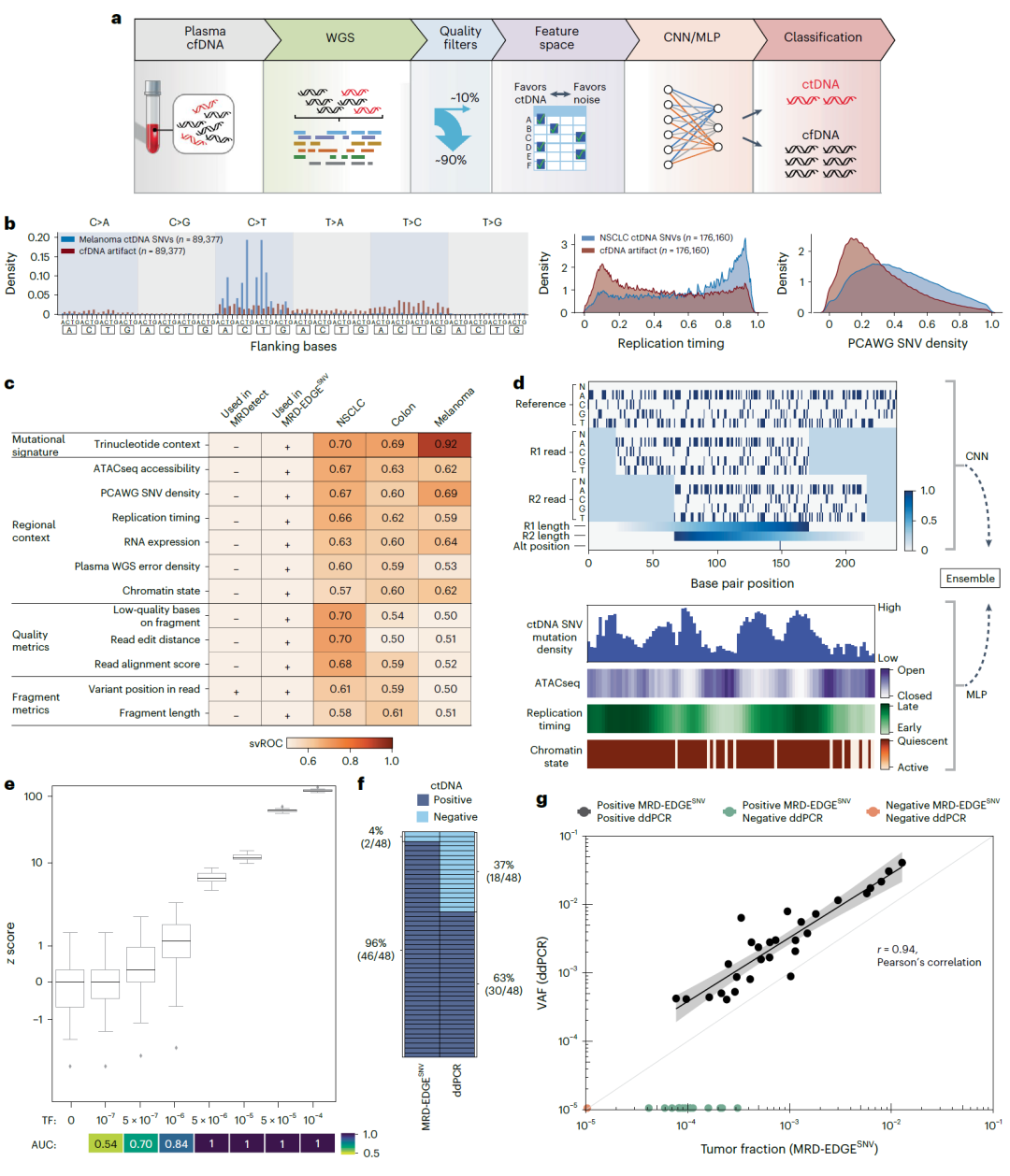
图1. MRD-EDGE SNV深度学习分类器将ctDNA SNV片段与cfDNA伪影区分开来。
MRD-EDGE SNV使用深度学习和ctDNA特异性特征空间,与之前的WGS错误抑制相比,将WGS中的SNV信噪比富集度提高了约300倍。MRD-EDGE CNV还通过WGS将超灵敏CNV检测所需的非整倍体从1Gb降低到200Mb,极大地扩展了其在实体瘤中的适用性。reads深度、次等位基因频率(BAF)和片段长度熵是CNV信号的独立且互补的来源;MRD-EDGE CNV将来自分类器的信号作为样本水平的独立输入进行组合,以全面评估血浆TF。
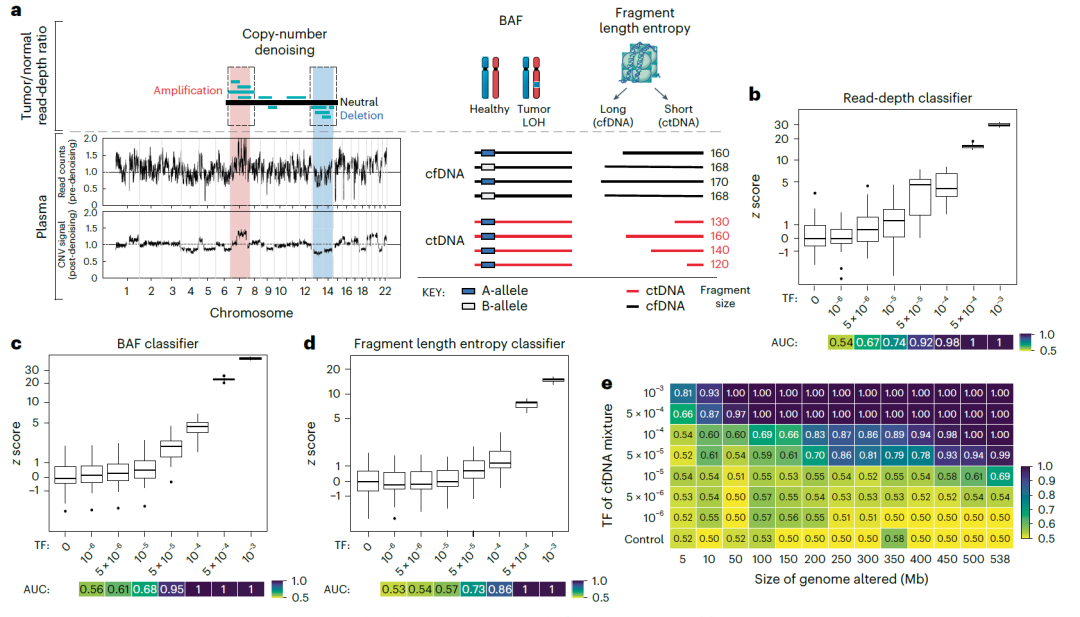
图2. 基于机器学习的错误抑制和附加功能增强了基于等血浆WGS的CNV检测灵敏度。
为验证MRD-EDGE平台的临床应用价值,研究团队在不同的癌症类型中进行了临床试验(图3)。首先,研究团队将MRD-EDGE应用于15名III期结直肠癌(CRC)患者的围手术期血浆样本中;所有样本均在术前和术后辅助化疗(ACT)时抽取。结果显示,MRD-EDGE识别了15名癌症患者的个体特异性肿瘤突变,其进行肿瘤信息术前ctDNA检测的AUC为0.998。在上述15名患者中,MRD-EDGE检测到了9名患者的MRD,其中5名患者在一个月后出现癌症复发;未检测到ctDNA的6名患者在研究窗口期内均未复发。通过比较手术前后血浆样本的ctDNA含量,MRD-EDGE平台能够准确识别手术后的MRD,并且检测结果与患者的疾病复发情况高度相关。
接下来,研究团队使用MRD-EDGE分析了接受新辅助免疫治疗方案(NCT02904954)的22名早期非小细胞肺癌(NSCLC)患者血浆样本,以评估MRD-EDGE对TMB变化的监测能力。结果显示,MRD-EDGE平台性能同样优异,其对术前癌症的敏感性很高(AUC 0.98)。对于接受免疫检查点抑制(ICI)剂治疗的患者,MRD-EDGE可在整个新辅助治疗期间监测TF趋势,准确反映患者对ICI的反应或缺乏反应。上述结果表明,MRD-EDGE能够实时监测TMB变化,捕获治疗期间ctDNA的动态变化,为治疗效果的评估提供重要依据。
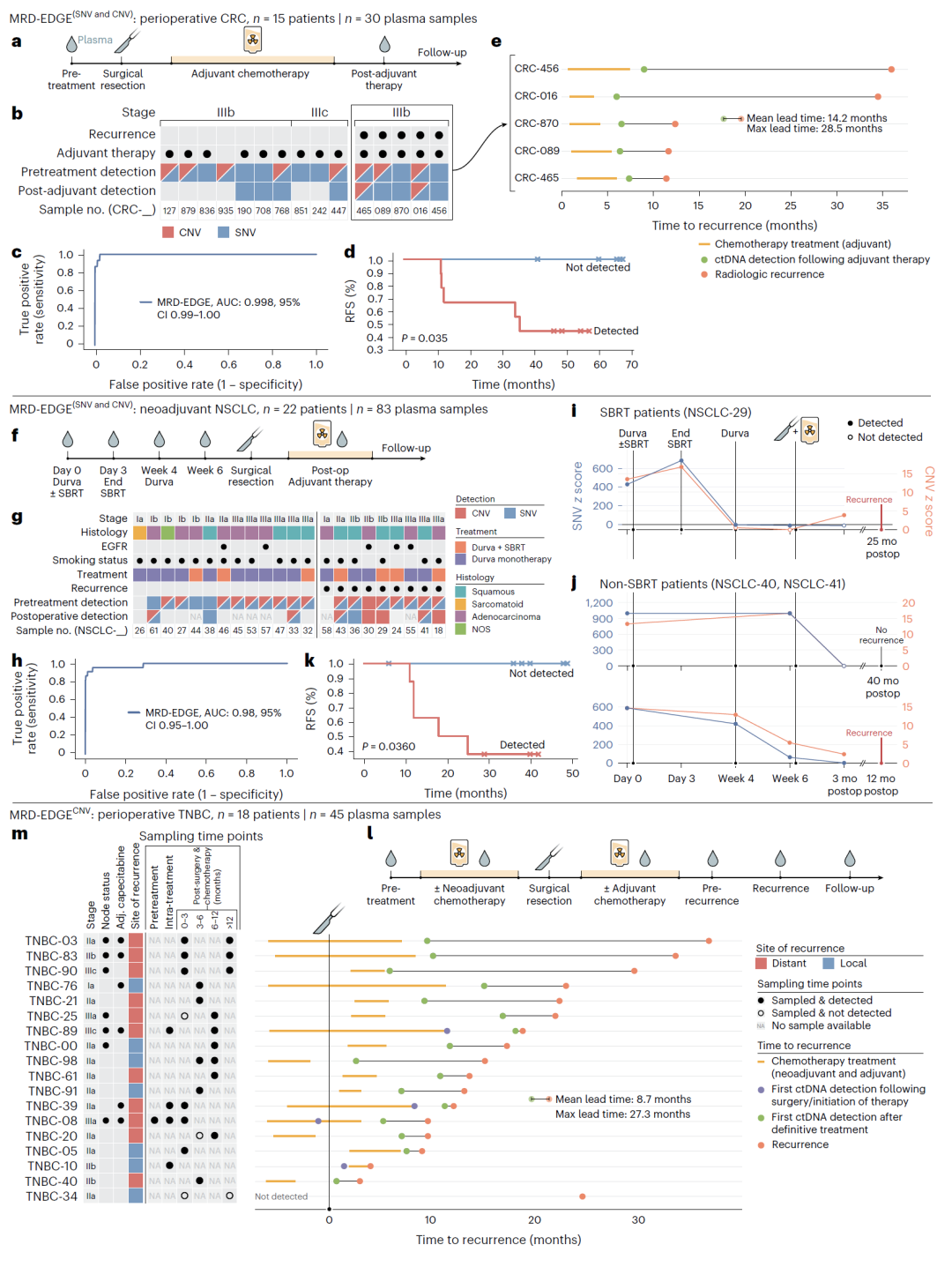
图3. 围手术期、新辅助治疗和复发性疾病环境中MRD的肿瘤知情监测。
非浸润性(癌前)病变是否会脱落ctDNA尚不清楚,为探索这一问题,研究团队使用MRD-EDGE对30名结直肠腺瘤和早期癌变(pT1病变)患者的切除前血浆样本进行分析。结果显示,MRD-EDGE显著提高了ctDNA脱落的检测灵敏度,共检测到60%pT1病变、35%癌前腺瘤存在ctDNA脱落;pT1病变的检测AUC高于腺瘤。这些数据表明,即使没有实质性的浸润成分,增生异常组织也可能脱落ctDNA;并证实了MRD-EDGE在癌症早期病变中的诊断潜力。
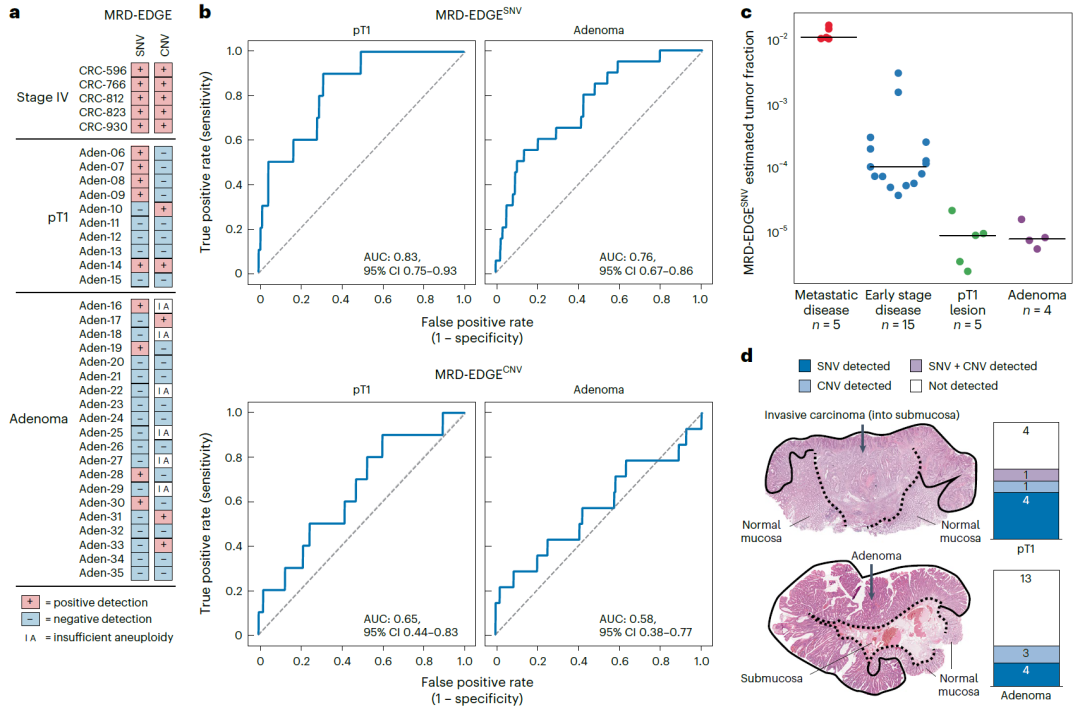
图4. MRD-EDGE肿瘤知情检测腺瘤和pT1病变的ctDNA。
MRD-EDGE在早期肺癌和三阴性乳腺癌患者的研究中显示出相似的敏感性,可以早期检测到几乎所有复发(除一次复发之外),并可在治疗期间跟踪肿瘤状态。特别地,MRD-EDGE甚至可以检测到癌前结直肠腺瘤的突变DNA,结直肠腺瘤息肉会发展为结直肠肿瘤。
此外,即使没有对肿瘤测序数据进行预先训练,在晚期黑色素瘤和肺癌患者中,MRD-EDGE中的信噪比富集技术也使仅基于血浆(非肿瘤知情)的疾病监测成为可能,能够在标准X射线成像检测的几周前为患者提供ICI的临床信息性TF监测。
结 语
综上所述,研究团队通过结合深度学习和机器学习技术开发了人工智能平台MRD-EDGE,其可根据患者血液的DNA测序数据,以非常高的灵敏度和准确性检测ctDNA;并成功应用于肺癌、黑色素瘤、结直肠癌等不同类型癌症患者中。无论是术后MRD检测、新辅助免疫治疗监测,还是早期癌变的ctDNA脱落检测,MRD-EDGE都展示了卓越的性能。这一创新平台为癌症的早期诊断和治疗监测提供了新的工具和视角,具有广泛的临床应用前景。
参考文献:
1.Widman, A.J., Shah, M., Frydendahl, A. et al. Ultrasensitive plasma-based monitoring of tumor burden using machine-learning-guided signal enrichment. Nat Med 30, 1655–1666 (2024). https://doi.org/10.1038/s41591-024-03040-4
2.https://medicalxpress.com/news/2024-06-ultrasensitive-liquid-biopsy-tech-cancer.html
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#癌症诊断# #液体活检# #MRD-EDGE#
38