Nature:Assembloid CRISPR揭示了疾病基因对人类神经发育的影响
2023-10-03 Jenny Ou MedSci原创 发表于陕西省
本文结果凸显了这个CRISPR组合平台系统地将NDD基因映射到人类发育中并揭示疾病机制的力量。
皮质GABA能(γ-氨基丁酸释放)中间神经元的发育和功能缺陷与自闭症谱系障碍(ASD)和其他神经发育障碍(NDDs)有关。这主要基于患者癫痫发作和癫痫的高患病率和神经成像研究,这些研究揭示了死后ASD组织中神经元密度和形态的变化。

同时,过去十年的全外显子组测序和全基因组关联研究发现了数百个ASD和其他NDD相关基因,包括几个与抑制性神经传输相关的GABA受体亚基基因。然而,将这些NDD基因的作用映射到长期人类内神经元发育的特定阶段是具有挑战性的。
皮质GABA能中间神经元在腹前脑产生,随后它们长距离向背前脑迁移,以整合到回路。在人类中,这个过程发生在妊娠的后期,与啮齿动物不同,持续到产后期。这种旷日持久的神经元发育被认为有助于增加脑脑的复杂性和认知能力。为了模拟人类中间神经元发育的阶段,研究人员和其他人从人类诱导的多能干细胞(hiPS)细胞中开发了类似于腹前脑-人类下颌骨类器官(hSO)的自组织类器官。
这些类器官可以与人类皮质类器官(hCO)结合,形成人类前脑组合类(hFA),并与谷氨酸能神经元模拟中间神经元迁移和电路组装。这些基于干细胞的三维(3D)发育和疾病细胞模型要么专注于研究单个基因在内核生成或迁移中的作用,要么利用屏幕来研究基因群在神经增殖的早期阶段的作用。尚未实现将数百个NDD基因对神经元间发育的几个阶段的影响并行映射,包括它们在妊娠后期迁移到皮质回路。
2023年9月27日发表在Nature的文章,将人类器官和组合技术与CRISPR筛选相结合,以映射一组亚皮层表达的NDD基因在神经元生成和迁移到皮质回路中的作用。研究人员发现,425个NDD基因中有46个(约11%)干扰了神经元的发育。值得注意的是,本文发现内质网(ER)塑造蛋白LNPK的丢失扰乱了中间神经元迁移,凸显了ER动力学在中间神经元向大脑皮层迁移中以前未被注意到的作用。
研究人员将天体与CRISPR筛选相结合,以调查425个NDD基因参与人类中间神经元发育。针对内神经元生成的第一个屏幕揭示了13个候选基因,包括CSDE1和SMAD4。随后,研究人员在1000多个前脑类体中进行了内神经元迁移筛查,确定了33个候选基因,包括细胞骨架相关基因和内质网相关基因LNPK。
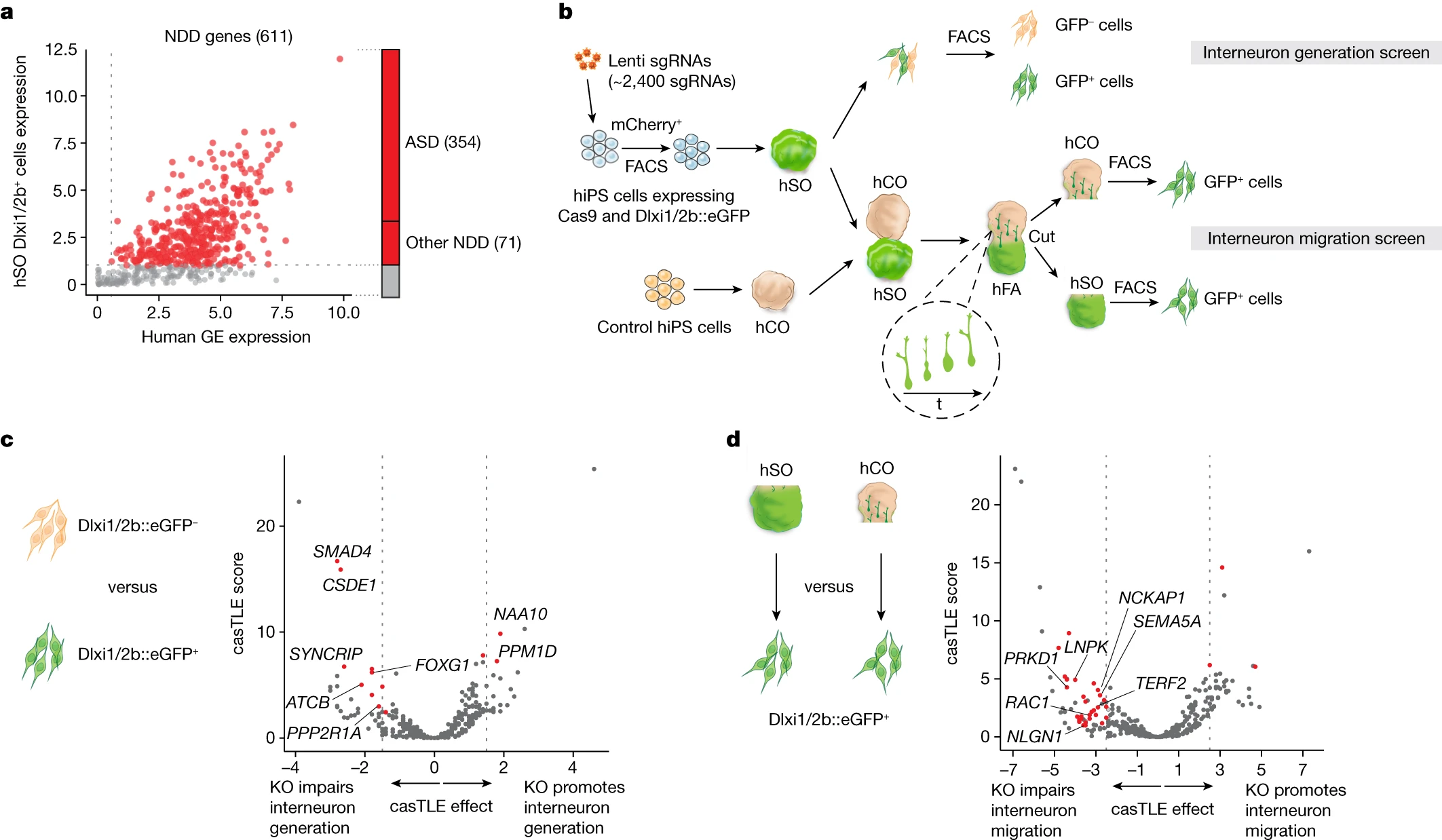
NDD基因的CRISPR筛查揭示了人类中间神经元生成和迁移的调节剂
研究结果显示,在神经元迁移期间,内质网在核易位之前沿着主要神经元分支移位。LNPK缺失干扰了这种内质网移位,并导致异常迁移。这些结果凸显了这个CRISPR组合平台系统地将NDD基因映射到人类发育中并揭示疾病机制的力量。
本文展示了一种强大的策略,为hiPS细胞衍生的前脑类体中的400多个NDD基因进行CRISPR功能丧失筛查。虽然高通量筛选不能完全反映遗传背景和突变效应之间的复杂相互作用,也不能完全反映疾病相关突变的确切基因剂量,但这个平台能够系统地将NDD基因的功能丧失表型映射到人类神经元发育阶段。
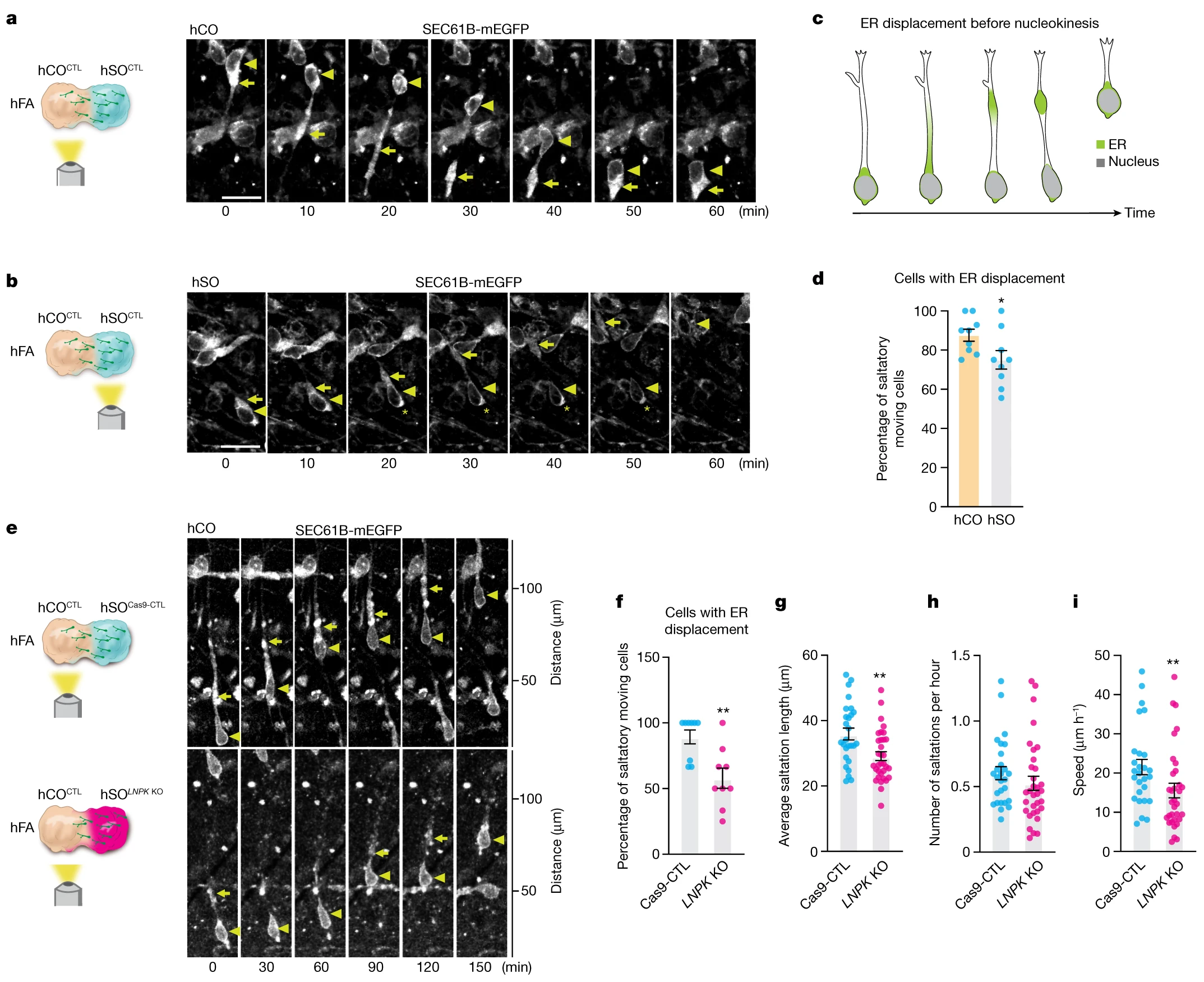
删除LNPK在核素esis期间损害了ER向前迁移
值得注意的是,它强调了细胞骨架机制和ER在迁移中的作用。编码ER稳定蛋白的LNPK的突变导致患者严重的智力残疾和癫痫。本文发现,人类中间神经元中LNPK的丢失导致盐水运动的缺陷。这促使进一步调查迁移期间ER的动态;研究人员发现核苷酸之前主要分支的ER位移。ER-tubules与微管相互作用,微管对建立迁移中间神经元的主导过程至关重要。
可能是LNPK丢失后中断的ER-管结构干扰了主导神经过程中细胞质扩张的形成,从而导致皮质神经元迁移的缺陷。更广泛地说,这些实验说明了如何将NDD相关基因列表映射到细胞通路和人类大脑发育的特定阶段,最终确定这些条件的收敛和发散分子和细胞表型,并促进治疗工作。
原文出处
Meng, X., Yao, D., Imaizumi, K. et al. Assembloid CRISPR screens reveal impact of disease genes in human neurodevelopment. Nature (2023). https://doi.org/10.1038/s41586-023-06564-w
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









不错啊!!!!!
66