武汉大学张先正/曾旋《ACS Nano》:纳米颗粒“搭便车”靶向治疗胶质母细胞瘤
2023-07-10 BioMed科技 BioMed科技 发表于上海
本研究证明了D@MLL在低剂量放疗后通过内源性单核细胞将D@MLL传递到GBM位点的治疗优势,为GBMs提供了高精度的治疗。
胶质母细胞瘤(GBMs)是侵袭性原发性脑肿瘤,通常会导致致命的后果。传统的化疗-放疗由于药物和放疗(RT)耐药、自然血脑屏障和高剂量放疗损伤,治疗效果差,副作用明显。更重要的是,肿瘤相关的单核细胞(巨噬细胞和小胶质细胞,TAMs)占GBM细胞含量的30%~50%,而GBM中的肿瘤微环境(TME)具有极大的免疫抑制作用。来自武汉大学的张先正教授及曾旋教授共同合成了纳米颗粒(D@MLL),它在小剂量放疗的帮助下搭便车在循环单核细胞上靶向颅内GBMs。D@MLL的化学结构为DOX·HCl负载的MMP-2肽脂质体,可通过表面修饰的脂磷壁酸靶向单核细胞。首先,肿瘤部位的低剂量放疗增加了单核细胞的趋化性,并诱导了TAMs的M1型极化。
随后,静脉注射D@MLL以循环单核细胞为目标,并与它们搭便车到GBM区域的中心部位。然后通过MMP-2反应释放DOX·HCl,诱导免疫原性细胞死亡,释放钙网蛋白和高迁移率组盒1。这进一步有助于TAMs的M1型极化、树突状细胞成熟和T细胞活化。本研究证明了D@MLL在低剂量放疗后通过内源性单核细胞将D@MLL传递到GBM位点的治疗优势,为GBMs提供了高精度的治疗。相关研究内容以题为“Nanoparticles Hitchhike on Monocytes for Glioblastoma Treatment after Low-DoseRadiotherapy”的论文于2023年7月5日发表在《ACS Nano》上。
本研究制备了内源性细胞搭便车纳米颗粒来克服血脑屏障(BBB)/BTB的靶向给药。简而言之,纳米颗粒(D@MLL)在循环单核细胞上搭便车,在低剂量局部放疗的帮助下将盐酸阿霉素(DOX·HCl)传递到颅内GBM部位,在局部放疗的帮助下精确释放。DOX·HCl被封装在基质金属蛋白酶2(MMP-2)反应性肽释放体(D@ML)中。合成D@MLL,用脂磷壁酸(LTA)对D@ML表面进行修饰,通过CD14受体与单核细胞结合(示意图A)。首先,肿瘤部位的低剂量放疗诱导TAMs的M1型极化并增加CCL-2的表达(示意图B)。肿瘤细胞释放的钙网蛋白(CALR)和高迁移率组盒1(HMGB1)进一步促进了TAMs的M1型极化、树突状细胞(DC)成熟和CD8阳性T细胞活化(示意图C)。
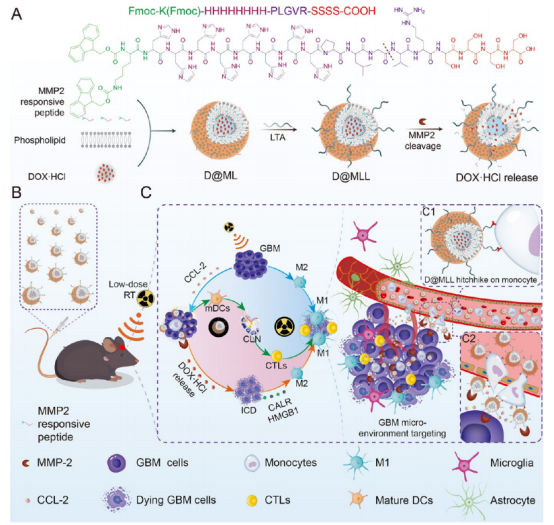
示意图 D@MLL低剂量放疗后GBM治疗单核细胞的搭便车示意图
【RT诱导神经胶质瘤组织中CCL-2的过表达】
生物信息学分析显示,CCL- 2在GBMs中的表达明显高于正常脑组织(图1A)。而Kaplan−Meier生存曲线显示,GBMs中CCL-2的表达对患者生存没有显著影响(图1B)。通过免疫组化(IHC)定量CCL-2的表达发现,与前两组相比,术前放疗的复发性胶质瘤中CCL-2表达显著上调,而术前放疗的原发性胶质瘤与复发性胶质瘤中CCL-2表达无显著差异(图1C)。这些结果证实了RT可以上调人脑胶质瘤组织中CCL-2的表达(图1D)。为了评估单核细胞的趋化性,我们提取外周血单核细胞(PBMCs),并用DiR标记(图1E)。体内DiR荧光成像结果显示,与未接受照射的组相比,接受放疗的小鼠脑肿瘤的荧光强度显著增加(图1F)。DiR荧光与GL261-luc标记的生物发光共定位,证实了单核细胞向GBM位点的趋化性(图1G)。CD68阳性的单核细胞几乎只在胶质瘤区域表达,而在正常大脑中只有少数单核细胞存在(图1H)。CCL-2和CD68的表达变化趋势一致(图1I)。以上结果提示,放疗后单核细胞可浸润到中央GBM中心部位,最合适的辐射剂量为相对低剂量的5 Gy。
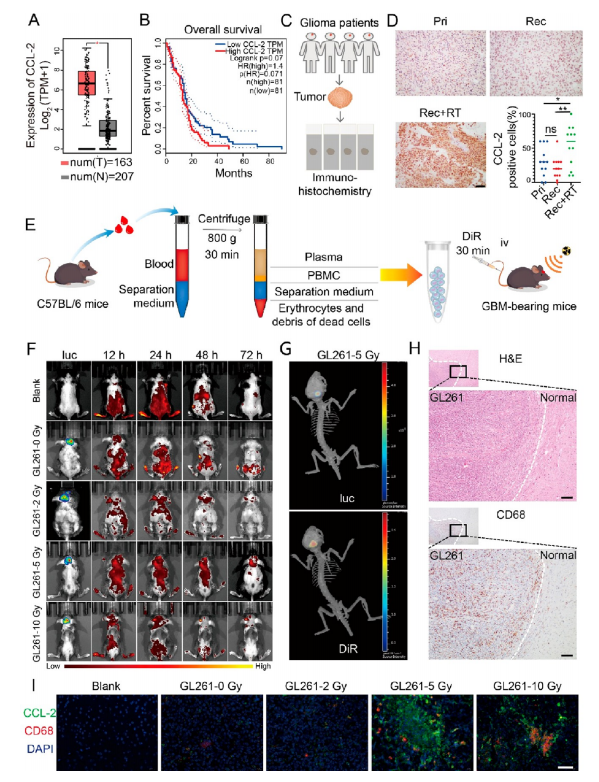
图1 RT增加了人和小鼠神经胶质瘤组织中CCL-2的表达
【D@MLL的制备和表征】
MMP-2响应性多肽-脂质体(ML)的构建是基于多肽和脂质体的自组装。当肽和脂质体以质量比(P:L)为1:6、1:4或1:2混合时,生成稳定的混合肽-脂质体纳米颗粒(图2A)。D@MLL的水合粒径约为165nm(图2B、C),TEM显示其粒径为100nm(图2D),适合于BBB的穿透。D@MLL在PBS或含血清的培养基中的粒径在1周内基本保持不变(图2E),表明D@MLL具有良好的稳定性。通过发射峰为560 nm的荧光光谱,验证了在D@MLL中成功加载DOX·HCl(图2F、G)。在含有MMP-2的环境中,zeta电位的降低和增加表明了LTA成功的表面改性(图2H)。加入MMP-2后D@MLL在PBS或含血清培养基中的药物释放率提高到60%左右(图2I),突出了D@MLL在GBMs中的药物释放潜力。
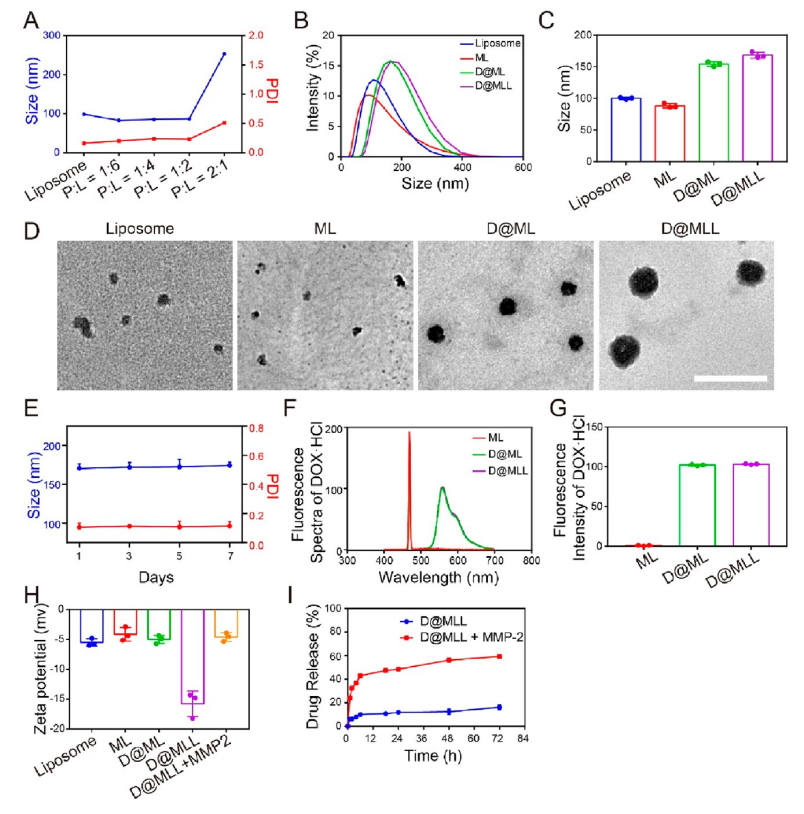
图2 D@MLL的表征和药物释放
【体外靶向和免疫调节作用】
用长波长荧光原卟啉(PpIX)取代了DOX·HCl装入纳米颗粒中,合成P@MLL。P@MLL的水合粒径约为185nm(图3A)。zeta电位的降低表明了LTA成功的表面改性(图3B)。通过荧光光谱在635 nm处观察到一个典型的发射峰,验证了PpIX的成功加载(图3C)。一种小鼠脑微血管内皮细胞系(b.End3)在24孔板中培养,构建体外BBB模型(图3D)。在CCL-2或CCL2和GL261细胞同时存在的情况下,穿过BBB进入下腔室的单核细胞数量显著增加(图3E)。当上腔室仅为P@MLL或上腔室同时添加P@ML和单核细胞时,下腔室未见PpIX荧光(图3F)。以上结果表明,在趋化因子存在的情况下,P@MLL可以在体外搭便车通过单核细胞穿过BBB并靶向肿瘤细胞。荧光显微镜显示RT、D@MLL和RT & D@MLL处理后小胶质细胞形态发生变化,向胶质瘤细胞迁移并包围它们(图3G)。与单独使用PBS组相比,RT & D@MLL组中M1型小胶质细胞的比例显著增加(图3H)。RT & D@MLL处理后,促炎因子TNF-α和IFN-γ的表达显著升高,而抗炎细胞因子(IL-10)的比例降低(图3I−K)。这些结果表明,D@ MLL与RT联合作用促进了GBM细胞的小胶质细胞M1型极化和体外吞噬作用。
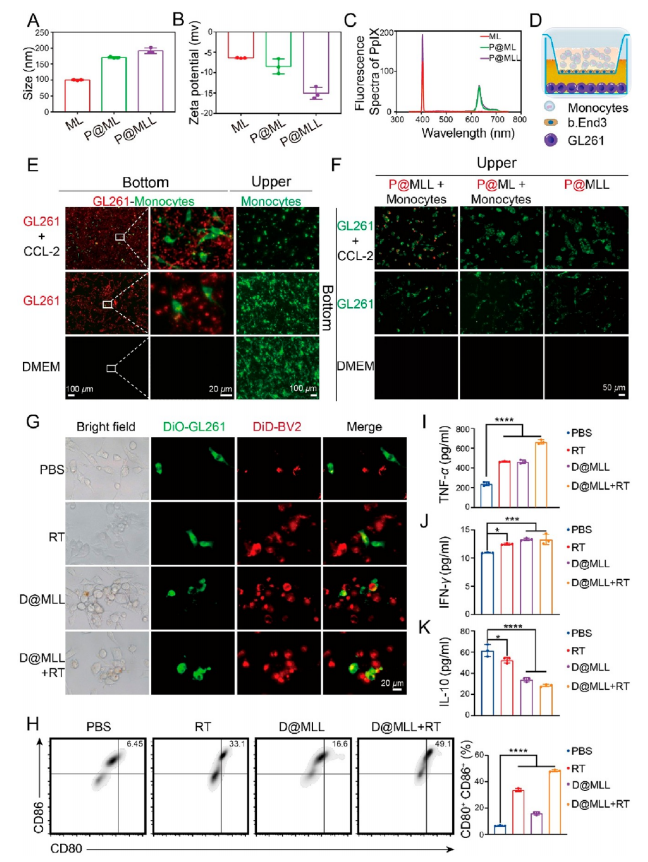
图3 P@MLL的靶向能力及D@MLL的体外免疫调节作用
【体内靶向效率】
为了进一步探索纳米颗粒在体内的GBM靶向效率,作者设计并合成了能够同时负载PpIX和DOX·HCl的纳米颗粒,命名为DP@MLL。DP@MLL的水合粒径约为340nm(图4A、B),TEM显示其粒径小于200nm(图4C)。zeta电位的降低表明LTA的表面修饰成功(图4D),在635 nm处的荧光光谱证实了PpIX的成功加载(图4E、F)。对携带GBM的小鼠进行第二次注射后在颅内肿瘤区域观察到DP@MLL的聚集(图4G)。在尾静脉注射24 h后进行荧光成像发现,与其他两组相比,RT & DP@MLL组脑肿瘤的PpIX荧光明显增加(图4H、I)。与DP@ML或DP@MLL组相比,RT & DP@MLL组的TNF-α表达显著上调(图4J)。
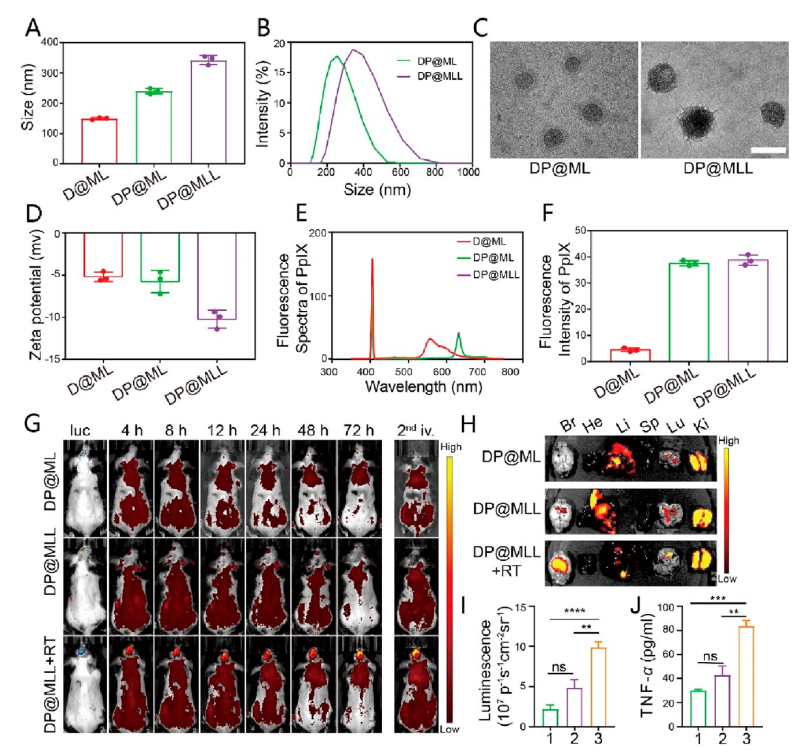
图4 DP@MLL的表征和体内靶向能力
【放疗后D@MLL的体内抗GBM作用】
接下来评价了D@MLL & RT对携带GBM的C57BL/6小鼠的治疗作用。从植入后第5天开始,携带GBM的C57BL/6小鼠每3天用不同药物治疗1次(图5A)。D@MLL & RT治疗组生存时间最长,第25天的生存率为50%(图5B),体重减轻较少(图5C)。与其他四组相比,D@MLL & RT组小鼠的肿瘤体积更小,生物发光最弱(图5D、E)。术后第15天进行磁共振成像(MRI)分析和H&E染色,测量肿瘤体积(图5F、G)。植入部位可见炎性细胞浸润、纤维组织增生、肿瘤细胞凋亡,未见明显肿瘤结节。在进一步的实验中,通过血液生化指标分析,检测了RT & D@MLL在体内的生理效应(图5H−L)。些结果表明,低剂量放疗后的D@MLL阐明了有效的抗GBM治疗效果和少数副作用。
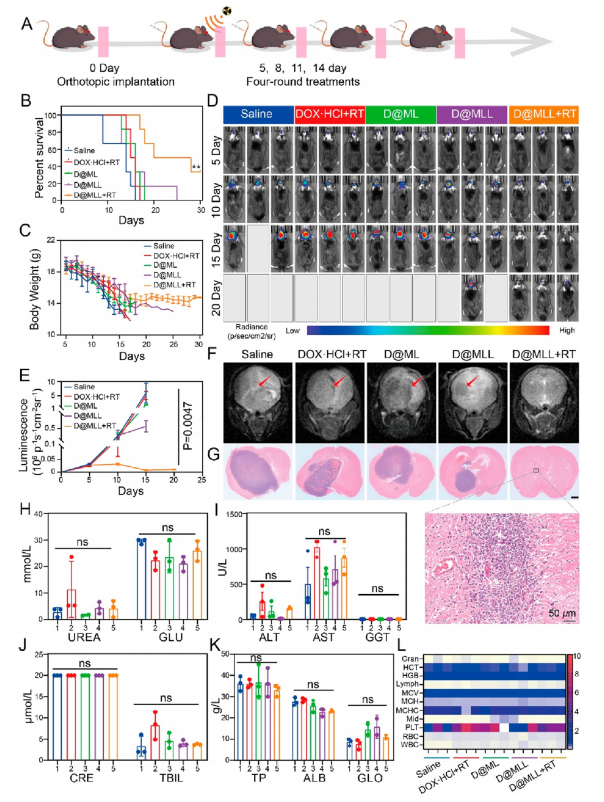
图5 D@MLL + RT对携带GBM小鼠的抗肿瘤作用
【体内抗GBM免疫力评价】
与D@MLL、D@ML、游离DOX·HCl和RT和生理盐水相比,D@MLL&RT处理组小鼠CD86+细胞比例显著增加,而CD206+细胞比例降低(图6A);D@MLL & RT处理组的iNOS表达显著上调,而Arg1的表达显著降低(图6B);D@MLL & RT组CD8+ T细胞、GrB和CD69的表达显著上调(图6C−E)。D@ MLL & RT处理的GBM携带小鼠中抗肿瘤细胞因子TNF-α和IFN-γ的浓度升高(图6F、G)。相反,D@MLL & RT组的免疫抑制因子IL-10水平显著降低(图6H)。为了验证肿瘤区域ICD相关蛋白的变化,定量分析了CALR(图6I)和HMGB1(图6J)的表达,结果显示,D@MLL & RT治疗组的CALR和HMGB1均表达上调。结果显示,D@MLL & RT组CD11c+CD80+CD86+DCs的比例明显高于暴露于其他四组(图6K)。此外还检测了外周血中CD3+ CD8+ T淋巴细胞(图6L)以及CD3+ CD4+ T淋巴细胞与CD3+ CD8+ T淋巴细胞的比例(图6M),结果表明,经D@MLL & RT治疗后,外周血中CD3+ CD8+ T淋巴细胞明显升高。以上结果表明,D@MLL & RT不仅在局部胶质瘤区域,而且在外周免疫系统中也引起了抗GBM免疫反应。
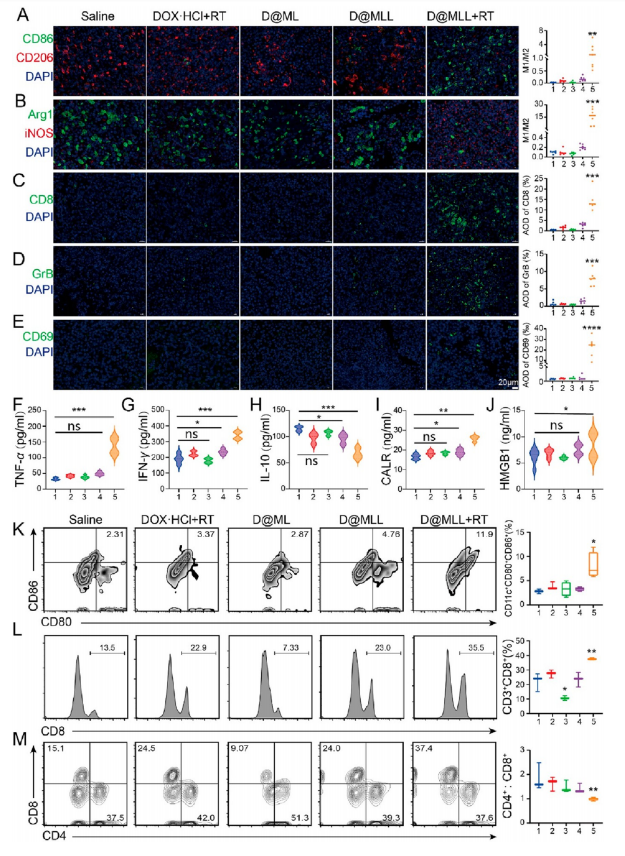
图6 D@MLL & RT调节体内GBM免疫微环境
【总结】
总之,本研究证明了纳米颗粒在放疗后搭便车在循环单核细胞上可以提供高效的抗GBM治疗。此外,还构建了由装载DOX·HCl的MMP-2响应肽质体和表面修饰的LTA组成的纳米颗粒(D@MLL)。在低剂量RT的帮助下,D@MLL可以通过搭便车循环单核细胞有效靶向GBM位点。然后通过MMP-2反应在肿瘤区域释放DOX·HCl,诱导肿瘤细胞的ICD,增加CALR的表达和细胞核中HMGB1的释放。此外,GBM微环境中的TAMs极化为抗肿瘤M1型,以及树突状细胞的成熟和CTLs的激活。综上所述,内源性循环单核细胞搭便车纳米颗粒(D@MLL)在低剂量放疗后实现了精确的颅内GBM药物传递,治疗效率高,副作用少。
原文链接:
https://doi.org/10.1021/acsnano.3c01428
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言