NEJM Evid:持续性心房颤动的低压心肌引导消融试验(ERASE-AF研究)
2022-11-04 MedSci原创 MedSci原创
对于患有持续性心房颤动 (AF) 的患者,临床上使用的各种消融策略的相对优势缺乏共识。 尽管肺静脉隔离 (PVI) 是此类患者公认的治疗标准,但总体疗效仍然有限。
对于患有持续性心房颤动 (AF) 的患者,临床上使用的各种消融策略的相对优势缺乏共识。 尽管肺静脉隔离 (PVI) 是此类患者公认的治疗标准,但总体疗效仍然有限。
随着对 AF 病理生理学认识的深入,心房组织结构中具有结构重塑的区域被认为是折返的基质——这是 AF 发展的关键组成部分。这些区域可以使用双极心房电压的窦性心律电压映射来识别 0.5 mV 作为存在致心律失常病变心房组织的替代指标。在这里,我们报告了一项对照试验,即心房低压心肌消融联合 PVI 与单独 PVI 相比,以改善持续性 AF 患者的节律控制。
ERASE-AF(持续性心房颤动的低压心肌引导消融试验)试验是一项多中心、随机、优效性、平行组、开放标签试验,具有盲法终点评估。
患者在三个国家的六个中心入组。年龄在 18 至 80 岁的患者符合条件;有症状的持续性房颤,定义为持续心电图 (ECG) 记录的持续超过 7 天的房颤;并且没有先前的 AF 消融尝试。排除标准包括阵发性 AF 和针对 AF 消融的标准禁忌症。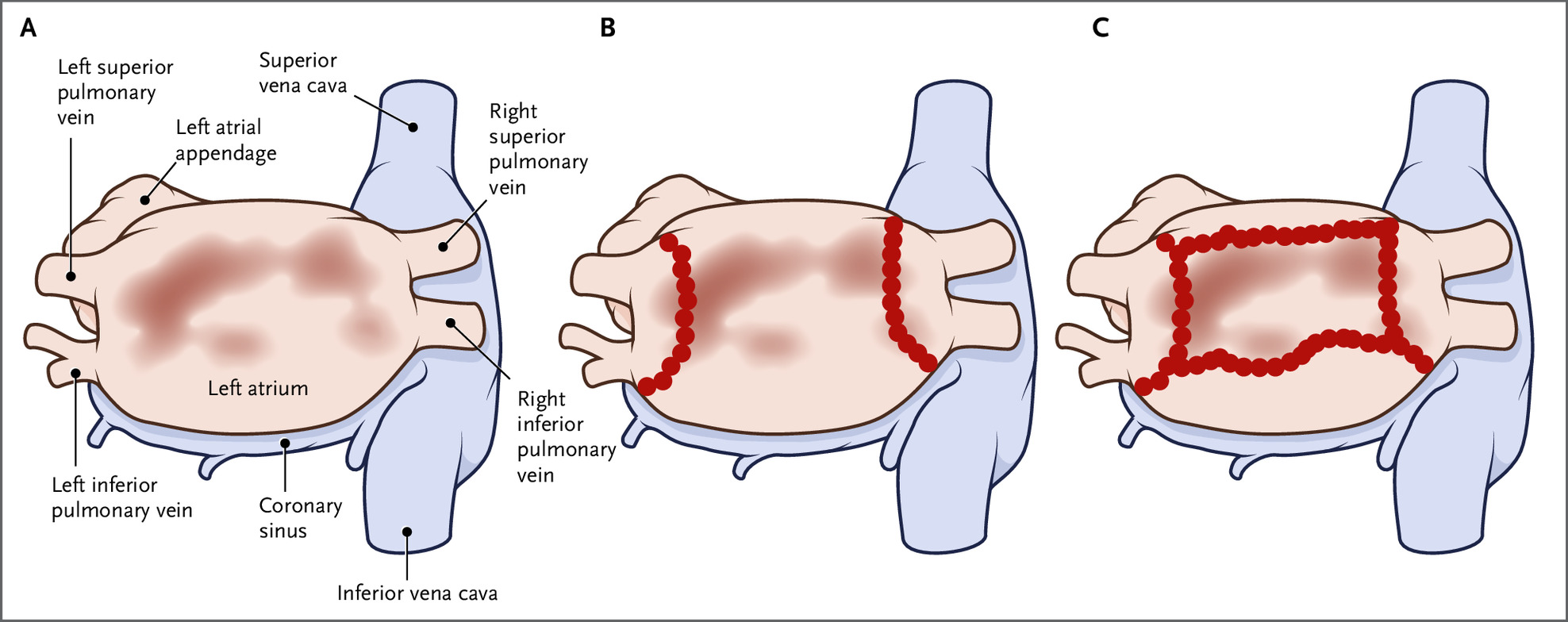
图1、低压心肌引导 AF 基底消融的概念
患者以 1:1 的比例被随机分配到以下两种策略之一:单独 PVI(以下称为仅 PVI)或 PVI 加底物修饰(以下称为 PVI+SM;SM包括线性消融 [LA] 或复杂分割心房电图 [CFAE] 消融 )。研究电子数据采集工具用于计算机化中央区组随机化设计,以根据研究地点生成和分层随机化。在手术前进行随机分配。
在手术过程中,患者处于深度镇痛状态。出现 AF 的患者在手术开始时被电复律为窦性心律。如果患者心律无法转换为窦性心律,则在 AF 患者中开始消融手术,之后根据需要进行额外的心脏复律。
随机分配到 PVI 的患者仅接受了同侧肺静脉的宽周隔离,并根据临床标准使用逐点冲洗尖端射频导管消融记录了入口和出口阻滞。随机分配到 PVI+SM 的患者接受了等效的 PVI,随后个性化低压消融。随机分配到 PVI+SM 但标测未识别心房低压心肌区域的患者仅接受 PVI,但在 PVI+SM 组内进行分析。
消融后停用Ⅰ、Ⅲ类抗心律失常药物。在心律失常复发的情况下,可根据临床判断重新开始抗心律失常药物治疗。如果在 3 个月的空白期之外有记录的心律失常复发,则安排在索引程序 3 个多月后进行再消融。
消融手术后,在 3、6 和 12 个月时获得 7 天心电图记录以监测心律。鼓励患者接受植入式心脏监测器 (ICM),以进行连续自动心律失常检测和远程数据传输。现有的带有心房导联的节律装置同样被使用。对于不同意植入 ICM 的患者,记录 7 天动态心电图。如果出现心律失常症状,患者可以通过 ICM 激活或外部心电图记录器(例如智能手表)进一步触发按需心电图。
主要疗效终点是通过连续 7 天的心电图记录在 12 个月的观察中评估的。在 7 天心电图期之外,来自任何临床、可穿戴(例如,智能手表)或植入(例如,ICM)心电图设备的任何其他有症状或无症状房性心律失常文件对主要终点的贡献相同。
次要疗效终点是 ICM 专门记录的任何房性心律失常首次发作的复发。 3 个月的空白期定义也用于该终点。
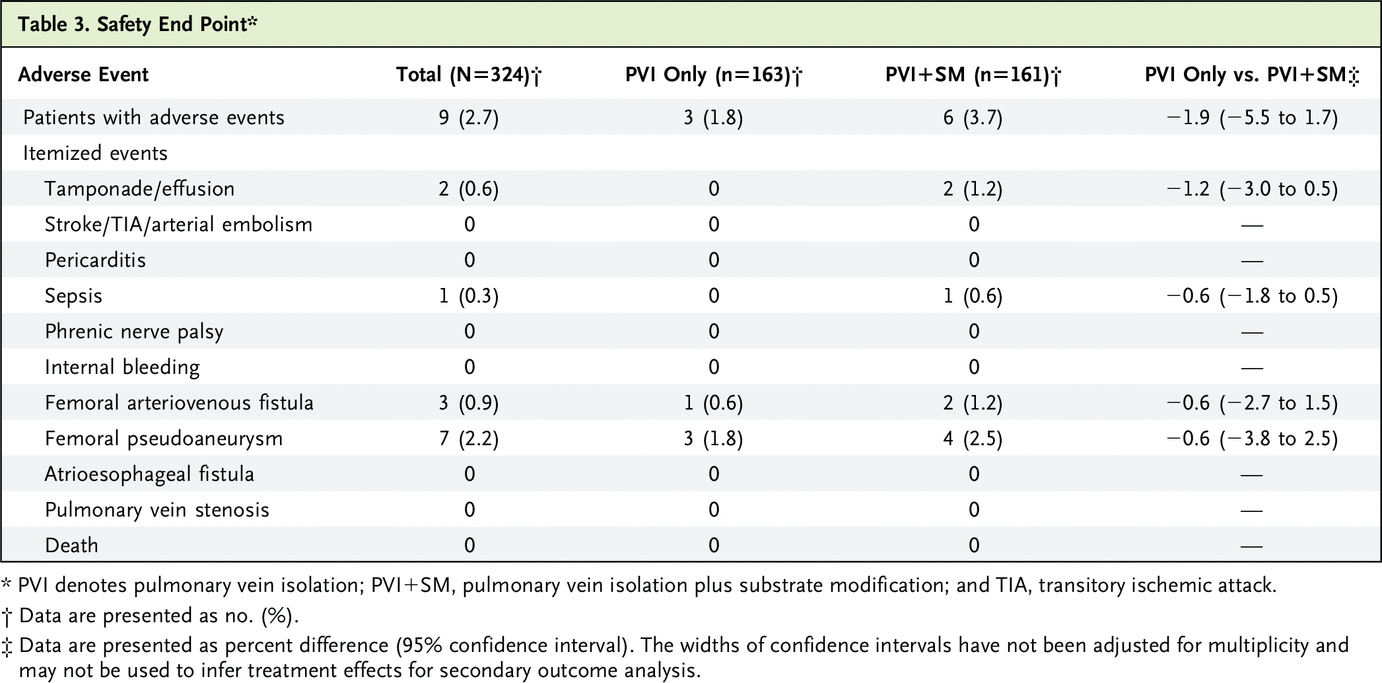
次要安全终点定义为消融后 90 天内发生以下一项或多项不良事件:心脏压塞/心包积血/积液、心包炎、中风/暂时性脑缺血发作/动脉栓塞、肺静脉狭窄、房食管瘘、败血症、内出血、膈神经麻痹、股血管通路并发症和死亡。1 安全终点由终点和不良事件委员会裁定。
2016 年 4 月至 2019 年 10 月期间共有 324 名患者入组。他们被随机分配到仅 PVI(163 名患者)或 PVI+SM(161 名患者)。 两个随机分组的基线特征平衡,包括患病率、解剖位置和心房低压心肌的大小。
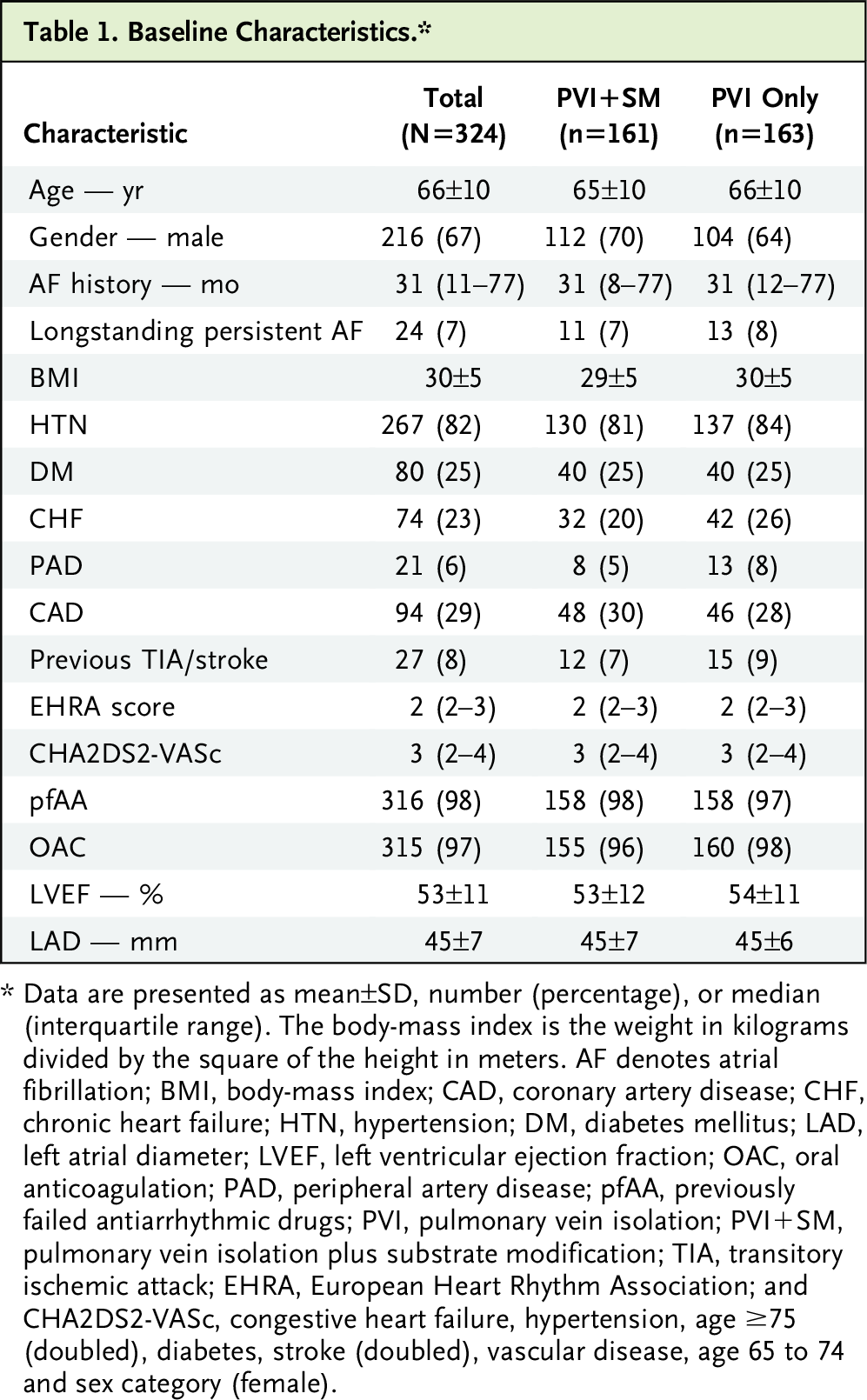
在意向治疗分析中,仅分配至 PVI 的 150 名患者中有 75 名(50%)发生了主要研究终点事件,而分配至 PVI+SM 的 153 名患者中有 54 名(35%)发生了主要研究终点事件(P=0.010)。 事件发生时间 Kaplan-Meier 累积事件率显示主要疗效终点的风险比为 0.62(95% CI = 0.43 至 0.88;对数秩 P = 0.006)(表 2 和图 2)。
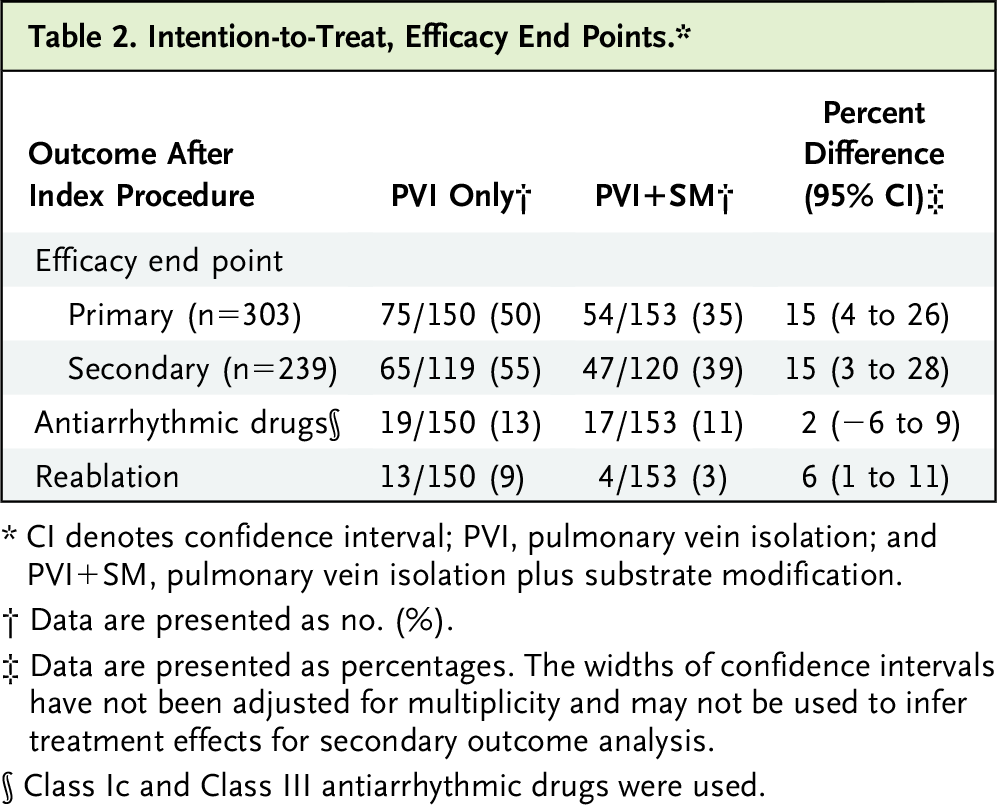
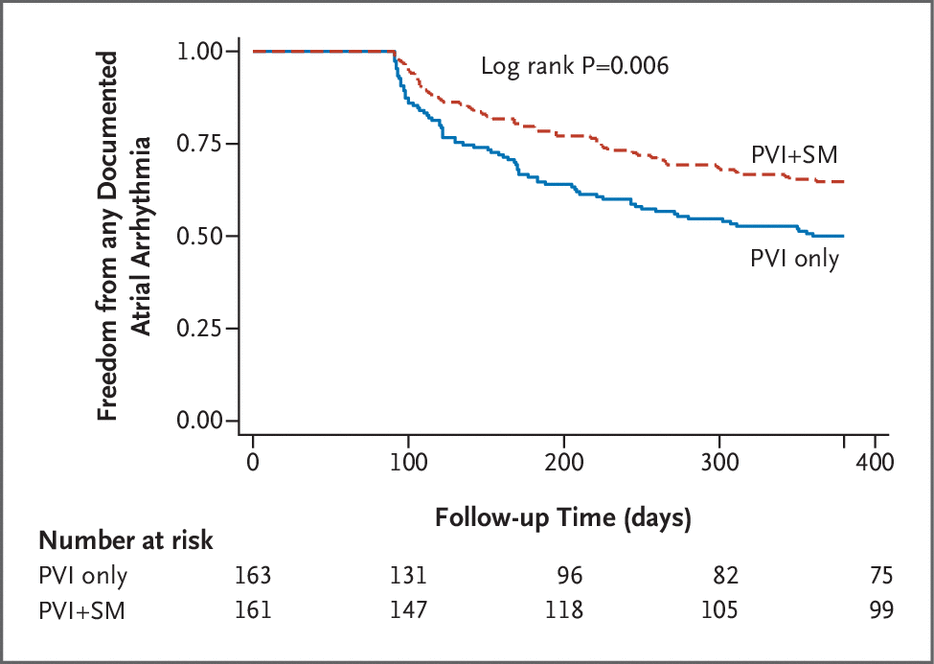
图2 主要终点
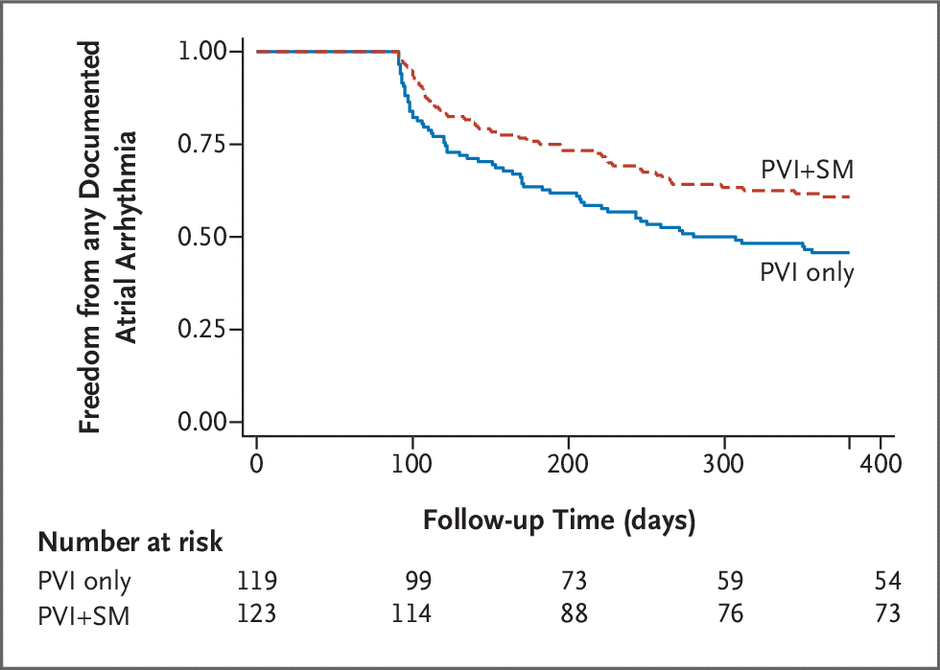
图 3、次要疗效终点。
在意向治疗分析中,仅分配至 PVI 的 119 名患者中有 65 名(55%)发生次要疗效终点事件,而分配至 PVI+SM 的 120 名患者中有 47 名(39%)发生次要疗效终点事件(差异:15 个百分点, 95% CI=3 到 28 个百分点)。 事件发生时间 Kaplan-Meier 累积事件率显示次要疗效终点的风险比为 0.63(95% CI = 0.43 至 0.92)(表 2 和图 3)。
PVI+SM 组患者的不良事件发生率呈上升趋势(163 例中的 3 例;1.8%,仅 PVI 对 161 例中的 6 例;3.7%,PVI+SM;差异:-1.9 个百分点,95% CI =−5.5 到 1.7 个百分点)。 观察到最多的不良事件是血管通路部位的动静脉瘘和假性动脉瘤(10 起事件)。 PVI+SM 组中的两名患者出现了心脏填塞。 未观察到卒中、膈神经麻痹、房食管瘘或肺静脉狭窄。 没有患者死亡(表 3)。
ERASE-AF 试验检查了两种常用消融策略在持续性 AF 患者中的疗效、安全性和程序概况。 我们纳入的患者特征与其他此类试验的参与者相似,并且代表了持续性 AF 患者。4-9、15-19、21、23-34 消融具有低双极标测的心房心肌区域 除 PVI 外,还发现电压在降低房性心律失常复发风险方面优于单独使用 PVI。 使用 ICM 的次要疗效终点以及已确定心房低电压心肌的患者亚组和长期持续性 AF 患者亚组也暗示了优势。 不良事件无差异; 与单独使用 PVI 相比,PVI+SM 的手术持续时间和消融时间增加了大约 10%。
总之,在 ERASE-AF 试验中,我们发现对于持续性 AF 患者的治疗,PVI+SM 在预防复发性房性心律失常方面优于单独使用 PVI。
原始出处:
Low-Voltage Myocardium-Guided Ablation Trial of Persistent Atrial Fibrillation. NEJM Evid 2022; 1 (11) DOI:https://doi.org/10.1056/EVIDoa2200141
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言