靶向FRα的ADC类药物mirvetuximab soravtansine三期临床试验结果公布,OS风险较化疗下降33%(MIRASOL试验)
2023-05-15 MedSci原创 MedSci原创 发表于上海
卵巢癌是女性生殖器官常见的肿瘤之一,美国每年约有20,000名女性被确诊,13,000名患者死于卵巢癌。通常大部分患者发现时已经是晚期,在手术和铂类药物化疗之后,不幸的是,大多数患者最终会发展为铂类耐
卵巢癌是女性生殖器官常见的肿瘤之一,美国每年约有20,000名女性被确诊,13,000名患者死于卵巢癌。通常大部分患者发现时已经是晚期,在手术和铂类药物化疗之后,不幸的是,大多数患者最终会发展为铂类耐药性疾病,影响后续治疗。
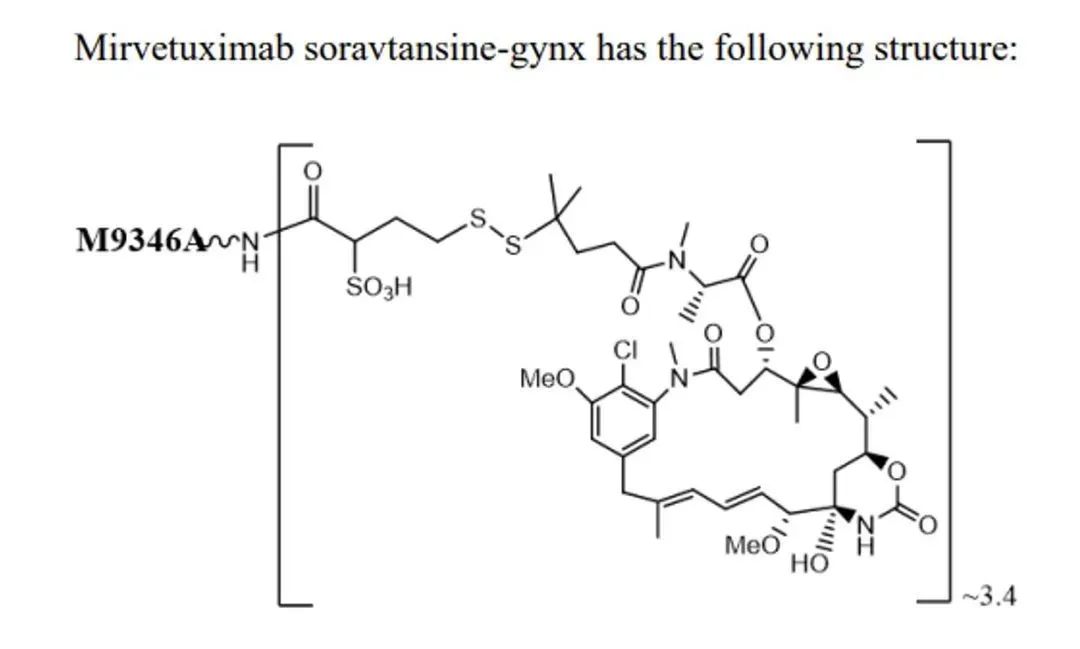
2022年11月中旬,美国食品药品监督管理局(FDA)加速批准了Elahere的上市。Elahere是由ImmunoGen公司研发一款叶酸受体(FRα)靶向的抗体偶联药物(ADC类药物),由IgG1亚型的抗FRα人源化单抗M9346A+小分子抗微管蛋白剂DM4+连接物磺基SPDB三部分组成,适用于治疗叶酸受体-α(FRα)阳性、铂类耐药的卵巢上皮癌患者,可以精准消灭靶向表达FRα的癌细胞。
2023年5月3日,ImmunoGen公司宣布靶向FRα的抗体偶联药物(ADC)Elahere通过3期临床试验数据,证明了Elahere治疗肿瘤表达高水平FRα的铂类耐药性卵巢癌患者有着积极显著的作用,同时证明了mirvetuximab soravtansine(Elahere)的有效性和安全性。数据显示,与化疗相比,卵巢癌患者的PFS、ORR和OS有统计学意义的改善,应用于临床能够显著延长FRα卵巢癌患者总生存期(0S)。
ImmunoGen公司临床研究副主任Kathleen Moore在新闻稿中提到:“对于那些检测呈FRα阳性的铂类耐药性疾病患者,我相信mirvetuximab soravtansine将会是他们的首选治疗选择。”
3期MIRASOL试验中显示出总体生存获益
MIRASOL(NCT04209855) 是一项随机3期试验,旨在评估Elahere的有效性和安全性。试验的主要终点是通过研究者评估的无进展生存期(PFS)。关键的次要终点包括客观缓解率(ORR)和总生存期(OS)。MIRASOL一共招募了453名患者,OS的中位随访时间为1.14个月。
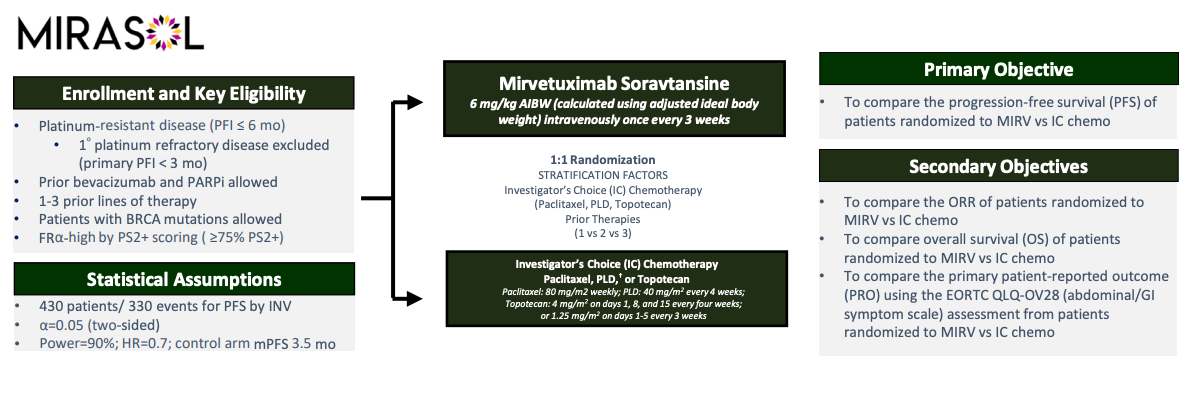
图:MIRASOL试验设计
结果显示:共有 453 名患者参加了 MIRASOL 试验,其中 14% 的患者接受过 1 线治疗,39% 的患者接受过 2 线治疗,47% 的患者接受过 3 线治疗。 共有 62% 的患者既往接受过贝伐珠单抗,55% 的患者既往接受过 PARP 抑制剂。
主要结果如下:
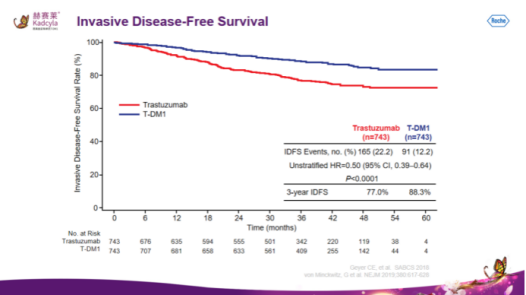
(1)Elahere组患者的中位总生存期(OS)为16.46个月,而IC化疗组的12.75个月,Elahere组的死亡风险相较对照组降低了33%;
(2)Elahere组患者的中位无进展生存期(PFS)为5.62个月,而IC化疗组PFS为3.98个月,Elahere组延缓肿瘤进展或死亡的风险相较对照组降低了35%。
(3)Elahere组患者评估客观缓解率(ORR)为42.3%,包括12例完全缓解(CR),而IC化疗组ORR为15.9%,无CR。
因此,Elahere组的PFS、ORR和OS相较对照组有统计学意义的改善。
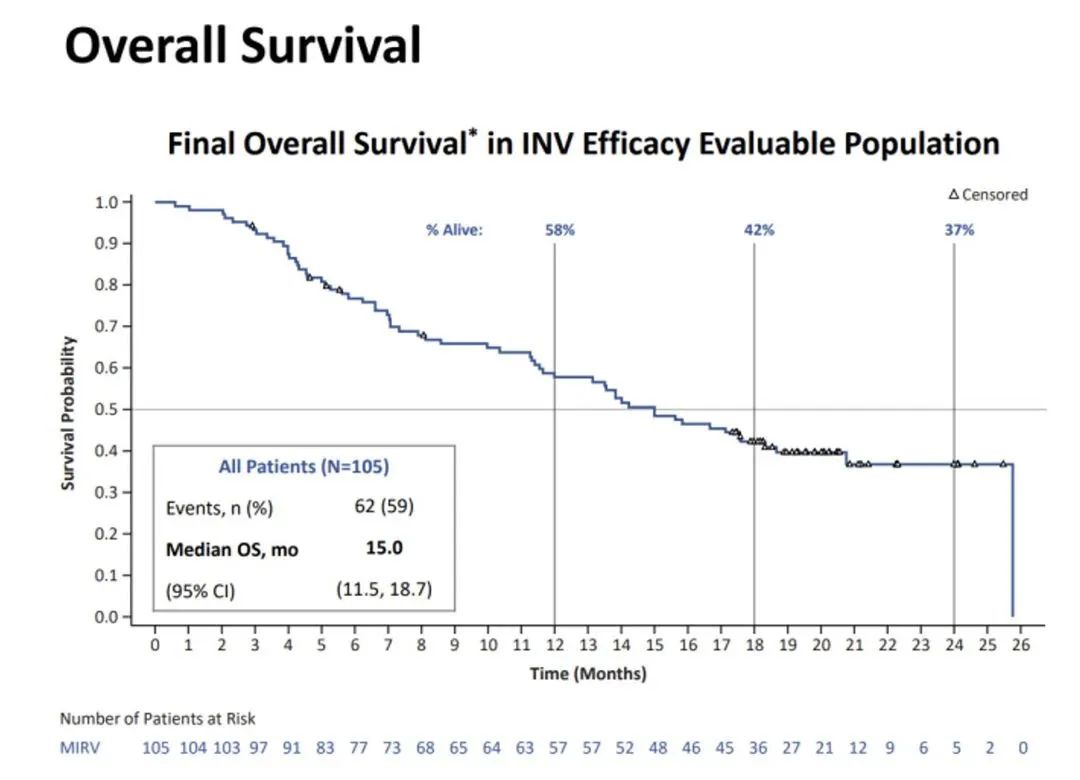
图3:Elahere能有效延长FRα卵巢癌患者总生存期(0S)
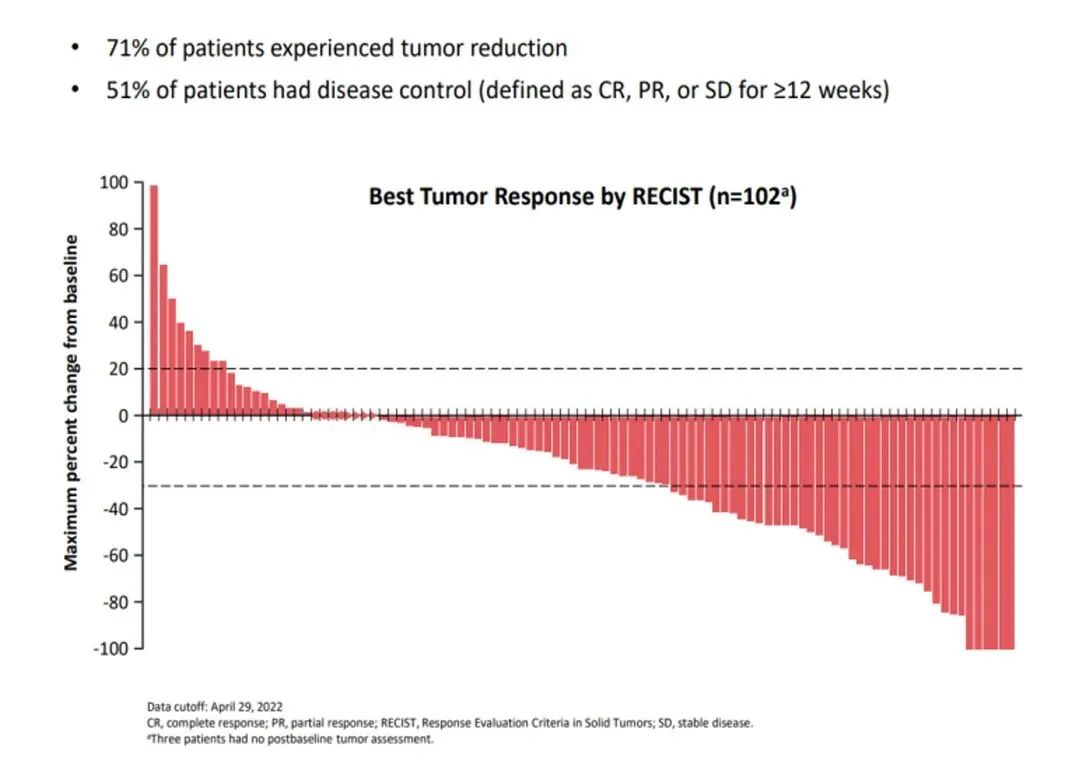
图4:Elahere有效延缓肿瘤进展,PFS、ORR显著改善
基于这些数据,Elahere可能在美国获得全面批准并扩展到欧洲,有望为FRα阳性、铂类化疗耐的药卵巢癌患者的新治疗标准 。据悉ImmunoGen公司预计于下半年在欧洲提交上市许可申请(MAA),同时向美国提交补充生物制品许可证申请(sBLA),以转换为Elahere的常规批准。
Elahere目前正在铂类敏感型复发性卵巢癌患者以及新诊断患者中进行进一步研究,也在开展作为其他妇科癌症(如子宫内膜浆液性癌症)的药物联合使用试验。
根据调查结果,盲法独立中央审查的 PFS 和 ORR 结果与研究者评估一致。 截至数据截止日期 2023 年 3 月 6 日,接受 mirvetuximab soravtansine 治疗的患者的 OS 中位随访时间为 13.1 个月,接受该药物治疗的患者中有 14% 仍在使用研究药物,而研究者的这一比例为 3% 化疗组的选择。
mirvetuximab soravtansine 的安全性也继续显示主要是低度眼部和胃肠道事件。 未发现该药剂有新的安全信号。
与研究人员选择的化疗相比,使用 mirvetuximab soravtansine 治疗导致 3 级或更严重的治疗紧急不良事件(TEAE;42% 对 54%)和严重不良事件(24% 对 33%)的发生率较低。 此外,接受 mirvetuximab soravtansine 治疗的患者的 TEAE 较少,导致停用研究药物 (9% 对 16%)。试验进程中,31%的患者发生过不良反应,以眼部和消化道症状为主。最常见的眼部不良反应是视力障碍(26%),角膜病(15%),干眼症(13%)等。最常见的严重不良反应是肠梗阻(8%),腹水(4%),感染(3%)和胸腔积液(3%)。2%的患者发生致死性不良反应,包括小肠梗阻(1%)和肺炎(1%)。
此前公布的SORAYA试验是一项针对Mirvetuximab用于治疗铂耐药卵巢癌患者的单臂3期临床试验,共有106名患者入组,这些患者的肿瘤存在FRα高表达,并且先前已接受过1到3种的治疗方案。该研究的主要终点为研究者评估确认的客观缓解率(ORR),次要终点是缓解持续时间(DOR)。临床试验结果显示,在整个队列的34名应答者中,有5人完全应答,29人部分应答。应答持续时间为6.9个月。此外,71%的患者肿瘤缩小,51%的患者疾病得到控制。患者的中位总生存期(OS )为15个月,在24个月时,有37%的患者存活。
参考资料:
SGO 2023:SORAYA研究数据公布,Mirvetuximab或成为靶向FRα阳性卵巢癌新星
首款FRα-ADC药物突出重围,获FDA加速批准治疗难治性卵巢癌
Ann Oncol: MIRV对比研究者选择的化疗在铂耐药上皮性卵巢癌(EOC)患者中的疗效和安全性: III期研究FORWARD I的初次分析结果
https://www.immunogen.com/wp-content/uploads/2022/03/SGO-2022_MIRASOL-TiP_Moore_vF.pdf
https://www.sciencedirect.com/science/article/abs/pii/S0090825822015189
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言