徐州医科大学郑骏年、曹江团队《自然·通讯》:BCMA/CD19 CAR-T有效治疗难治复发性多发性骨髓瘤!
2024-04-24 BioMed科技 BioMed科技 发表于上海
该研究构建了串联型双靶(BCMA/CD19)嵌合抗原受体T细胞(BC19 CAR-T),通过体外实验及I/II期临床研究证实了其治疗R/R MM患者的安全性和有效性。
多发性髓瘤(MM)是第二常见的血液学恶性肿瘤,其特征是骨髓中浆细胞的克隆性增殖,或在骨髓外部位产生单克隆免疫球蛋白。尽管在过去的十年中,随着蛋白酶体抑制剂(PI)、免疫调节剂(IMID)、单克隆抗体等新型药物的出现和造血干细胞移植的应用,MM患者的生存率得到显著提高,但几乎所有的MM患者最终都会出现复发,MM仍然是一种不可治愈的疾病。三重难治性MM患者的中位总生存期(OS)为9.3个月,五重难治性MM患者OS为5.6个月,复发和难治多发性(R/R)MM患者需要更有效和可耐受的治疗方案。

2024年4月20日,徐州医科大学附属医院血液科徐开林、曹江团队与徐州医科大学细胞治疗药物产业学院郑骏年、施明团队合作,在国际知名期刊Nature Communications发表了题为“Bispecific CAR T-cell therapy targeting BCMA and CD19 in relapsed/refractory multiple myeloma: a phase I/II trial”的多中心研究成果。该研究构建了串联型双靶(BCMA/CD19)嵌合抗原受体T细胞(BC19 CAR-T),通过体外实验及I/II期临床研究证实了其治疗R/R MM患者的安全性和有效性。
靶向B细胞成熟抗原(BCMA)的CAR-T细胞疗法已在R/R MM患者中显示出良好的疗效,总反应率(ORR)为48%-100%,完全缓解率为6%-76%。然而,一些患者对BCMA CAR-T细胞治疗没有反应,或者在获得缓解后很快复发。在CAR-T治疗后,4%-33%的进展期患者观察到BCMA表达的下调或丢失。解决这个问题的方法之一是可以利用双靶向CAR-T细胞,双靶CAR-T细胞也已被证实可以有效治疗多种血液肿瘤,如CD19/CD22 CAR-T细胞治疗白血病和淋巴瘤,CD19/CD20 CAR-T细胞治疗淋巴瘤,以及BCMA/CD38 CAR-T细胞治疗MM。
先前的研究表明,一小部分MM细胞表达CD19,被认为是分化程度较低的MM细胞或骨髓瘤样干细胞,与耐药和生存率差有关。最近的研究证实,在大多数患者中,CD19在一小部分骨髓瘤细胞(10.3%-80%)上以超低密度表达,CD19低表达的骨髓瘤细胞可以被CD19 CAR-T细胞所消除。此外,在大剂量美法兰和补救性自体造血干细胞移植(Auto-HSCT)后给予CD19 CAR-T细胞也显示出CD19 CAR-T对R/R MM有潜在治疗价值。
徐开林、郑骏年团队一直致力于R/R MM的CAR-T治疗研究。前期进行的一项前瞻性研究,证明联合输注人源化CD19和BCMA CAR-T细胞对R/R MM患者是可行的,绝大多数的R/R MM患者都取得了较好的缓解率(Lancet Haematol,2019;J Clin Oncol,2022)。
本研究中,研究人员首先构建了靶向BCMA或/和CD19的单特异性或双特异性CAR - T细胞(图1),体外实验证实BC19 CAR-T细胞含有的T细胞亚群,与BCMA、CD19或19BC CAR-T细胞的表型相似,几种CAR-T细胞的增殖情况也相似。通过对BCMA或CD19阳性肿瘤细胞的杀伤实验证实BC19 CAR-T比19BC CAR-T细胞具有更好的选择性杀伤能力。基于BCMA或CD19阳性肿瘤细胞的异种移植小鼠模型,研究证实BC19 CAR-T细胞具有抗原特异性抗肿瘤活性(图2)。
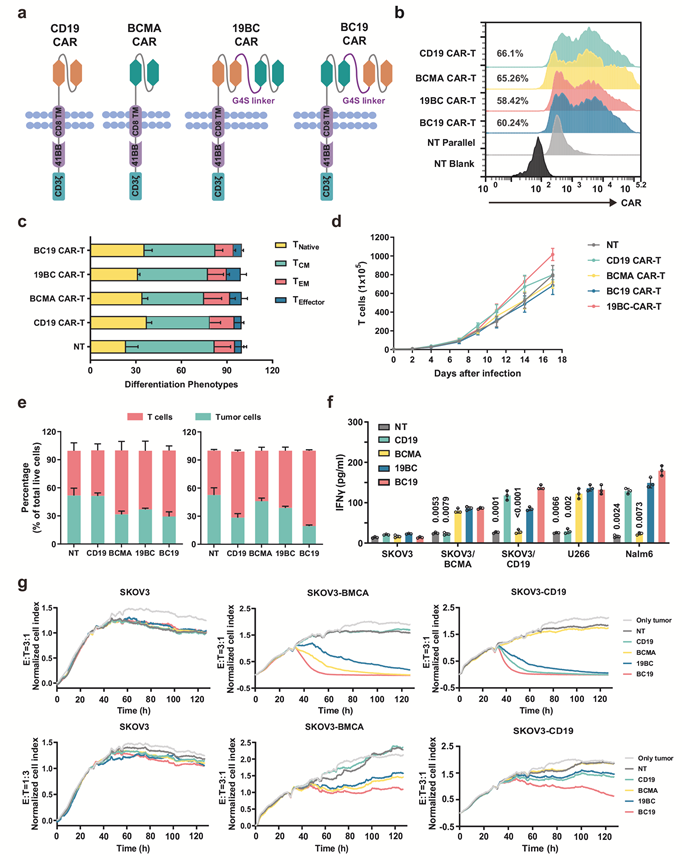
图1. 体外靶向BCMA或/和CD19的单特异性或双特异性CAR-T细胞的构建和功能验证
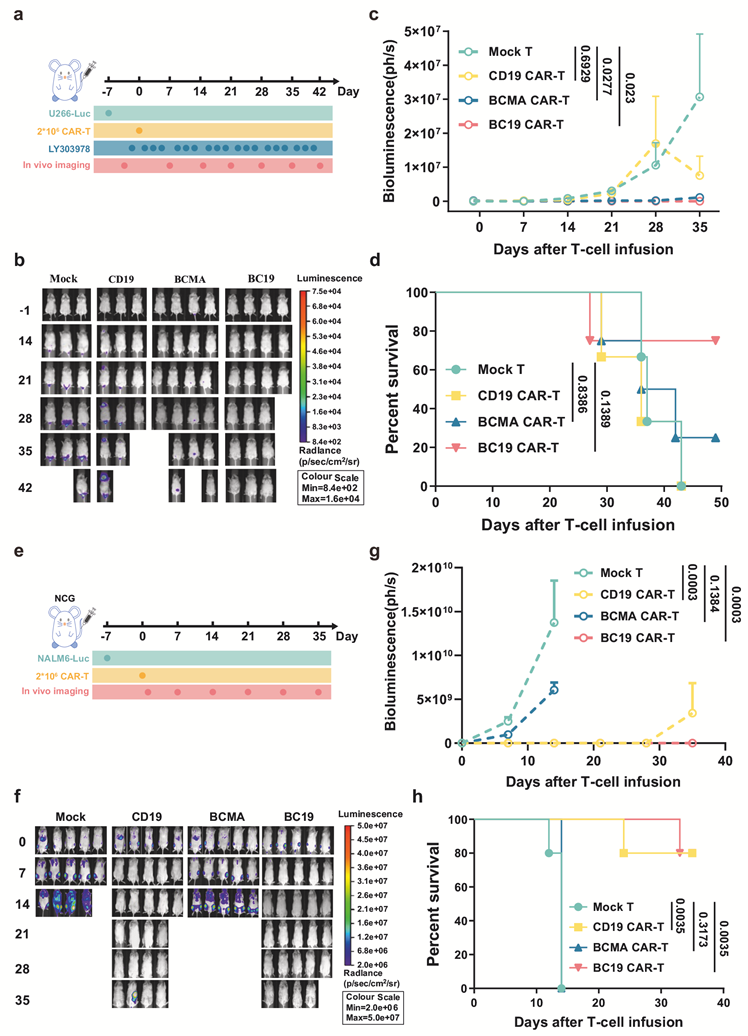
图2. 体内评价BC19 CAR-T细胞抗肿瘤治疗能力
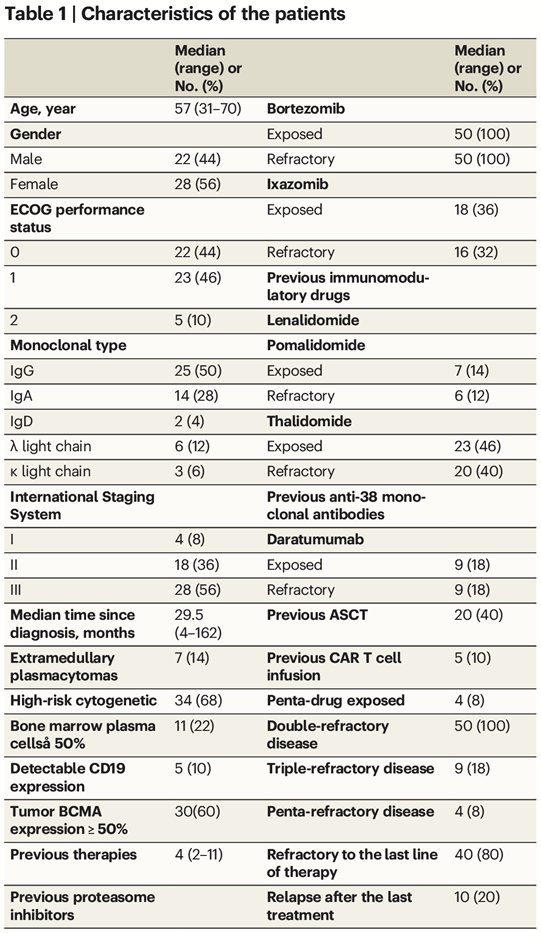
从2020年6月到2022年2月,50例R/R MM患者接受了BC19 CAR - T细胞输注,患者的基线特征列于表1。患者的中位年龄为57岁,从MM诊断到CAR - T细胞输注的中位时间为29.5个月。共有46名患者(96%)患有II期或III期疾病,7名患者(14%)患有髓外疾病,34名患者(68%)具有高危细胞遗传学特征。患者入组前接受的治疗中位数为4线。其中,20例患者(40%)曾接受过auto-HSCT, 5例患者(10%)曾接受过BCMA、CD19或GPRC5D靶向CAR-T细胞治疗。
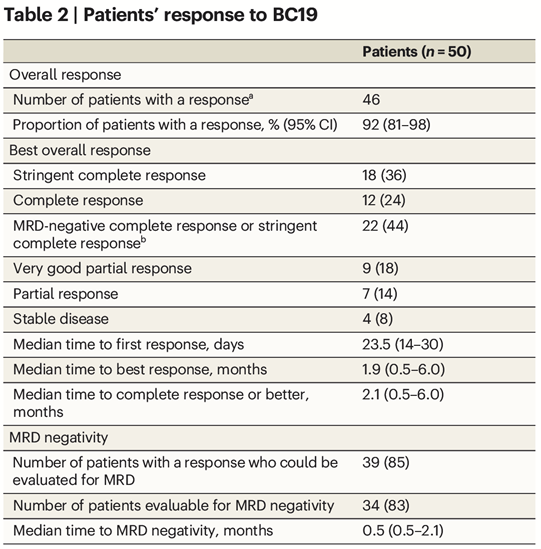
在50例可评估疗效的患者中,ORR达到了92%(46/50)(表2)。到首次PR或更好的中位时间为23.5天,到最佳反应的中位时间为1.9个月。7例患者中有6例(86%)髓外疾病患者获得了总体缓解。在先前接受CAR-T细胞治疗的5例患者中,2例达到sCR, 1例达到PR。在41名MRD阳性患者中,34名(83%)患者MRD转阴,MRD转阴的中位时间为0.5个月。
在中位随访11个月时,46例患者中有27例(59%) PR或更好的患者有持续的反应。46例患者中15例(33%)在随访期间出现复发或进展。所有50例患者的中位OS和PFS分别为19.7个月和19.7个月(图3)。46例PR或更好的患者DOR中值未达到。1年PFS、OS和DOR率分别为55%、85%和59%。CR或更好的患者12个月PFS和OS率分别为66%和90%。
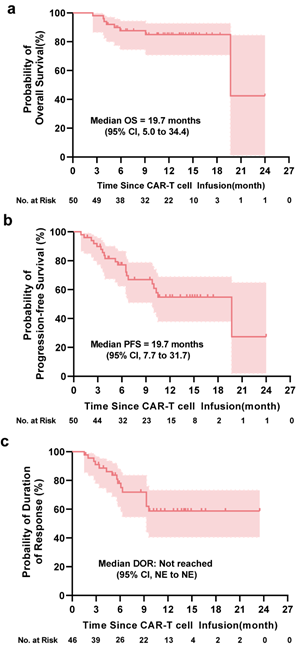
图3. 患者的OS、PFS和DOR
CAR-T细胞输注后最常见的急性不良事件是血液学毒性和CRS。50名(100%)患者均发生中性粒细胞减少和白细胞减少,47名(94%)患者发生贫血,44名(88%)患者发生血小板减少症。在本研究中,有92%(46/50)的患者发生CRS,绝大多数患者CRS等级不超过3级,只有4名(8%)患者发生重度CRS。CRS开始发生的中位时间为7天,中位持续时间为3天。有2名患者在治疗期间发生了神经系统毒性(NT)事件,均为轻度可逆性(1级)NT,在给予对症支持治疗后症状逐渐消失。晚期不良事件主要包括B细胞发育不良、低丙种球蛋白血症和感染事件,其他晚期不良事件发生较少。
【文章结论与讨论,启发与展望】
综上所述,研究人员针对MM的疾病特征,设计了靶向CD19和BCMA的双特异性CAR-T。通过体内外实验,证实了其杀伤肿瘤细胞的特异性与有效性。通过临床研究证实BCMA/CD19双特异性CAR-T细胞是一种可行、安全、有效的策略,为晚期复发难治性MM患者提供了新选择。
徐州医科大学施明教授、刘丹副教授、研究生王娇娇、南通大学附属医院黄红铭教授为论文第一作者,徐开林,郑骏年、曹江教授为论文共同通讯作者。
原文链接:
https://www.nature.com/articles/s41467-024-47801-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#多发性骨髓瘤# #CAR-T# #R/R MM#
78