引言
危重病人发生低氧血症的风险很高,氧气至关重要,但过量的氧气摄入可能导致代偿性高氧血症,高氧血症可对肺造成直接毒性作用,对循环会产生血管收缩作用,并导致活性氧 (reactive oxygen species,ROS) 生成增加而损伤细胞和器官。过去 5 年中,越来越多的大型随机对照试验 (RCT) 已经在研究最佳氧合目标,但讨论仍在进行中。本章我们将详细阐述氧气的生理和病理生理背景,并随后讨论临床证据现状。
地球大气中的氧气来源
在大约 45 亿年的时间里,地球大气中的氧浓度从 0 变为 0.21。生物进化与地质学之间的复杂相互作用导致了目前的氧浓度和地球上生命的多样性。根据到太阳的距离和在太阳系中的位置,地球处在“宜居带”。氧元素是蓝藻细菌或植物叶绿体中通过光合作用产生的一种极具活性的元素。现代植物仍然使用与蓝藻细菌共生进行光合作用。在蓝藻细菌出现之前,厌氧微生物使用硫酸盐代替氧气来满足其能量需求。大约24.5亿年前,蓝藻细菌取代了厌氧菌,在被称为大氧化事件时期产生了极具活性的元素氧。又过了10亿年,在此期间几乎没有新的发展(无意义的10亿年),氧气浓度变得足够高,足以满足动物生命的发展和进一步进化。在地球大气层的历史上,最大氧浓度曾达到约0.30,现在稳定在0.21。从高能分子状态到低能分子状态的一系列转移中(即电子传输链),氧元素的高电负性和丰度,特别适合作为最终电子受体。通过这种方式,氧气含量的增加是包括人类在内的许多新生物体发展的先决条件。然而,同样的水平对其他生物体来说是有毒的。氧元素获得电子的倾向,意味着有机体必须发展抗氧化剂防御机制,以防止无意中的分子氧化和功能障碍。正如Paracelsus所说的“剂量造就毒药”。
氧合作用的测量和评估
为了评估危重病患者的氧合状态,可以使用几种不同的方法和参数:通过脉搏血氧仪 (SpO2) 或动脉血气分析 (血氧饱和度) 得到的血氧饱和度 (SO2)、通过动脉血气分析得到的氧分压(PO2)、通过中心或混合静脉血气分析(ScvO2或SvO2)得到的氧气摄取值、乳酸浓度和氧气输送(DO2)。脉搏血氧仪利用两个近红外波长结合循环脉搏来测量SpO2。含氧 (O2-Hb) 和脱氧 (H-Hb) 血红蛋白对这两种波长的吸收不同。与一氧化碳结合的血红蛋白 (CO-Hb)无法通过双波长脉搏血氧仪与 O2-Hb 区分开来,因此会导致 SpO2 读数错误地升高。SpO2测量的主要优点是方便、连续、非侵入性;缺点是深色皮肤患者的结果相对不可靠,而且无法检测到高氧血症。使用近红外波长的方法也可以直接用于血液,最多有四个不同的波长(而不是脉冲血氧仪中使用的两个波长),从而能够确定高铁血红蛋白和CO-Hb的浓度。血样中的PO2可以用电阻随PO2变化的极谱电极来测量,组织中的PO2可以通过皮肤或器官上的小极谱电极来测量。这种应用的主要限制是测量的深度受限。动脉血氧分压(PaO2)测量的优势在于其准确性。此外,压力是 O2 扩散的驱动力,使压力成为比饱和度更相关的参数,而饱和度与 O2 扩散没有直接关系。缺点是这种方法是间断性和侵入性。对于正常范围内的氧气水平,有一些公式可以根据SO2 计算 PO2,反之亦然。然而,这些公式并未完全考虑温度、2,3-二磷酸甘油酸、pH 和 PCO2(玻尔效应)对氧合血红蛋白解离曲线横向位置(右移或左移)的影响,因此仅具有有限的临床价值。此外,在动脉血氧饱和度较高的高氧区(血氧饱和度>97%),PO2的较大变化与无法准确测量的SO2的极小变化有关。因此,在SpO2>97%的范围内,除非同时测量PO2,否则可能无法检测到高氧血症。可以通过计算动脉血和静脉血之间的氧气摄取量或通过测量乳酸产量来估计充足的氧合。氧气摄取和乳酸产生取决于低氧血症的严重程度,还取决于组织灌注的维持和葡萄糖或其他代谢底物的充足供应。计算全身的氧摄取量,可以通过同时采集动脉血和中心静脉血,或最好是混合静脉血来完成。ScvO2 采样相对容易,并且是评估休克患者循环的有充分证据的参数。SvO2测量需要肺动脉导管。乳酸是一种简单的测量方法,但它的水平会受到许多其他变量的影响。组织 DO2 可以使用 Hb、血氧饱和度和PaO2 [(1.34×Hb×SpO2 × 0.01) + (0.023 × PaO2)] 和心输出量计算,在正常情况下约为每分钟1000mlO2。DO2 与氧摄取和摄利用(VO2) 有关,但取决于许多循环和代谢变量。
低氧血症、正常氧血症和高氧血症的定义
吸入额外的氧气会导致高氧血症,通常定义为吸氧浓度>0.21。在正常生理条件下,氧浓度超过正常水平会导致高氧血症或PaO2升高。动脉血氧分压的正常范围为10-13.3kPa,因此任何PaO2>13.3kPa均可视为高氧血症,任何PaO2<10kPa值均可视为低氧血症。O2相关文献中使用了许多不同的低氧血症、正常氧血症和(轻度、中度或重度)高氧血症定义和界值,研究结果对比起来非常困难。由于氧合血红蛋白解离曲线的形状,特别是SO2最高值时PaO2和SO2之间的弱相关性,因此SO2不是区分轻度、中度和重度高氧血症的可靠方法。
人体氧生理学
氧降梯度图描述了从气体吸入(空气和/或 O2)到线粒体,氧气(表示为 PO2)的运输和流程(图 1)。氧气运输顺梯度进行,一方面通过肺通气和循环,另一方面通过气体扩散。干燥大气的 PO2 为 21.1 kPa。在气道中,空气在 37°C 时被 H2O 饱和,吸入 PO2(PIO2)从 21.1 kPa 下降到 19.9 kPa。下一个减少是由肺泡中二氧化碳 (CO2) 呼出引起的。肺泡二氧化碳压力 (PACO2) 由肺泡通气量决定,使用简化的肺泡空气方程和呼吸交换比 (RQ),可以计算出呼吸空气时肺泡 PAO2约为 13 kPa。换气不足可导致 PAO2 显著下降;相反,过度换气仅导致 PAO2 小幅增加。这也可以通过肺泡空气方程和气道中 H2O 饱和空气中的 PIO2 (19.9 kPa) 来解释,呼吸空气时最高 PAO2 为 (19.9-PACO2) kPa。
在循环系统运输氧气之前,氧气从肺泡扩散到动脉血是必要的。在正常受试者中,肺泡/动脉 PO2 梯度 (ΔPA-aO2) 限制在 2 kPa 以下,主要是由扩散阻力引起的。静脉血混合、肺内通气/血流比值降低和 PAO2 降低是 ΔPA-aO2 增加的最常见原因。因此,正常PaO2略高于 11 kPa,这是可用于扩散的压力,与溶解在血液中的少量氧气直接相关(0.0232 ml O2 / 100 ml 血液 / kPa PO2)。血液携带的大部分氧气与血红蛋白结合(在 SO2 为 100% 时,每克血红蛋白最多含 1.39 毫升氧气)。血液中的溶解氧和与血红蛋白结合的氧之间存在直接平衡,由氧合血红蛋白解离曲线及其横向位置决定。氧降梯度的下一站是毛细血管,随着在组织中的延伸,越来越多的 O2 从血液中逸出,沿压力梯度扩散到组织中,毛细血管血中 PO2 的平均值略大于 5 kPa。下一步骤是从毛细血管到组织和细胞内,最后到达线粒体。生理线粒体的氧分压估计在3-0.5kpa之间。在细胞和线粒体中,O2 被酶(氧化酶)使用,例如细胞色素 c 氧化酶系统和细胞色素 P450。在线粒体中,O2 主要通过氧化碳水化合物(葡萄糖)进行有氧代谢,该过程的第一步是在细胞中进行无氧糖酵解,并将葡萄糖转化为丙酮酸,同时每个葡萄糖分子仅产生2个ATP。在乏氧条件下,下一步是将丙酮酸转化为乳酸。代谢性酸中毒中的乳酸水平,可用于估计疾病的严重程度和低程度缺氧。在有氧环境下,丙酮酸将进入线粒体中的三羧酸 (TCA) 循环,进行氧化磷酸化,每个葡萄糖分子产生多达36 ATP。该代谢途径的其他产物是CO2、NADH、FADH2 和 H2O。
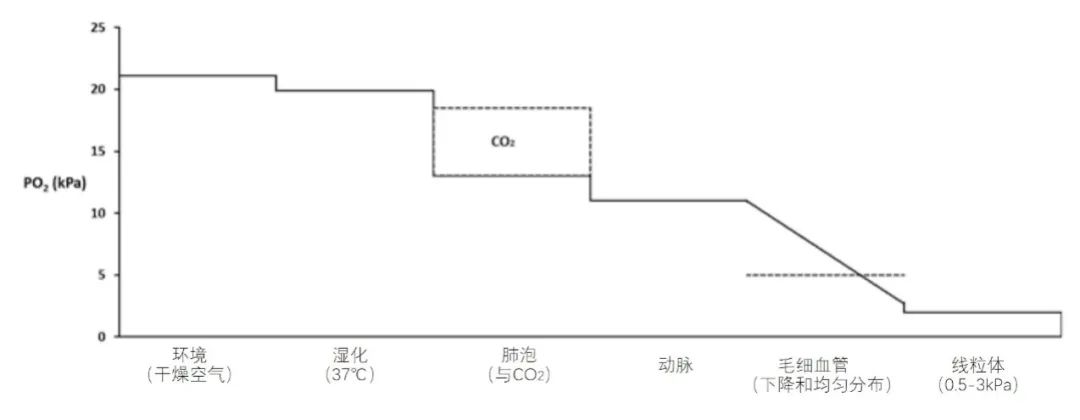
图1 氧降梯度图:从干燥的环境空气到线粒体
人体氧的病理生理学:低氧血症和缺氧的影响
当重症患者出现低氧血症时,有氧糖酵解会受到阻碍,导致能量消耗、细胞功能障碍和进行性代谢性乳酸酸中毒。持续长时间(慢性)低氧血症会激活细胞内的缺氧诱导因子,该因子可以激活基因转录,产生对抗缺氧的病理生理效应。这些作用包括:通过促红细胞生成素增加血红蛋白的产生、增加血管生长因子改善组织灌注和交感神经激活。
人体氧的病理生理学:氧过多、高氧血症和 O2 中毒
在 101 kPa 的正常大气压下,将吸氧浓度从21%变为100%,对血氧饱和度以及血液O2含量 (C-O2) 的影响可以忽略不计。然而PaO2 会随着吸氧浓度 增加而大幅升高。因此高氧会增加O2中毒的风险,而不会显著增加组织DO2。在临床医学中增加吸氧浓度用于改善通气不足、静脉血混合或伴有弥散障碍的肺部病变的氧合。在贫血患者中,限制 O2 含量的因素是血红蛋白,输入红细胞 (RBC) 远比增加吸氧浓度有效;在休克患者中,通过优化循环可以最好地改善组织 DO2。吸氧浓度增加导致高氧,对气道和肺有直接影响。氧中毒的体征和症状是气管支气管炎症、胸骨后疼痛、咳嗽、再吸收性肺不张,最后是肺泡水平的高氧性急性肺损伤 (HALI)。肺泡损伤与炎症后一氧化氮 (NO) 产生增加有关。
高氧血症导致细胞和线粒体中的 O2 水平高于正常。这种情况下,线粒体 O2 可以转化为活性氧,活性氧外层具有不成对的电子。体外实验表明,猪肺线粒体和大鼠肺毛细血管内皮细胞中氧水平增加与活性氧产生之间存在很强的、指数性相关。在肝细胞再灌注/再氧合模型中,将氧从 0% 增加到 2% 会导致活性氧产生急剧增加,进一步增加到95%会导致活性氧稳步上升。
活性氧有高度活性和有害,因为它们与细胞内破坏蛋白质和DNA的分子反应。因此活性氧与脂膜上的脂肪酸反应,对这些膜造成损害,而脂质过氧化物酶反应导致进一步的细胞损伤。全身炎症可能会增加活性氧的影响,这种炎症通常出现在危重患者中。活性氧在生理上被超氧化物歧化酶和过氧化氢酶灭活,这两种酶支持活性氧转化为H2O和正常的O2。例如,细胞中的维生素C、维生素E和谷胱甘肽也可以使活性氧失活。抗氧化剂是影响活性氧形成和变形的药物选择。高氧血症不仅会增加血清活性氧,还会增加炎性细胞因子,并与进行性炎症和器官功能障碍有关。高氧血症时的氧化应激可降低NO水平,并导致微循环中的血管收缩。根据循环病理特点(休克类型),血管收缩可能对循环有不同的影响。
氧正常、缺氧、高氧对危重病人的影响
基于上述低氧血症和高氧血症的影响,过去十年中,对危重病患者进行了大量观察性和干预性研究。2008年,一项具有里程碑意义的回顾观察性研究描述了荷兰50个ICU中36,307名患者的氧合指标,以及吸氧浓度或达到PaO2与临床结果之间的关系。PaO2与死亡率呈U型关系(经多个变量校正后),死亡率最低的PaO2范围为8.9~10.6kPa。最近报道,动脉血氧分压与ARDS患者的住院死亡率(13.2kPa)和ICU死亡率(13.5kpa)之间的关系达到了新的低点。自2008年以来,几项随机对照试验研究了重症患者吸入低vs.高氧浓度、PaO2、血氧饱和度和/或SpO2,这些试验在患者选择、低氧组和高氧组的目标氧合,以及主要和次要终点有所不同。表1 概述了这些研究的特征。
第一项研究是针对103名参与者的小型可行性研究,实验组和对照组间PaO2, SaO2和SpO2的差异有统计学意义,作者得出结论,即使保守组低氧血症(SpO2<88%)和高氧血症(SpO2>98%)明显多于自由氧疗组,保守性氧合目标仍是可行的。在这项小型研究中,两组的次要结局(新发器官功能障碍、ICU死亡率和90天死亡率)没有显著差异。
Oxygen-ICU 研究计划将 660 名患者随机纳入正常PaO2 和 SpO2 目标组和“标准实践组”,即允许PaO2 和 SpO2 升高。该研究在纳入 480 名患者后提前停止,对其中 434 名进行了分析。保守组主要结局(ICU 死亡率)显着降低(12% vs. 20%),在次要结局中,保守组新发休克、新发肝功能衰竭和血流感染的发生率较低。由于分析组样本量小于计划样本量,作者认为这只是初步结论。
HYPERS2S研究结合了氧合目标(吸入氧浓度为100%的高氧血症,而SO2值为88%-95%)研究,以及感染性休克机械通气患者输注等渗盐水与高渗盐水的2×2水平、多中心随机对照研究。两个氧疗组主要终点——28天死亡率没有显著差异。然而由于高氧组严重不良事件的数量较多,试验提前停止。吸入氧浓度为100%,肺不张的发生率明显更高,ICU获得性衰弱潜在发生,但在统计学上没有显著差异。作者得出结论,在感染性休克患者中,吸入氧浓度为100%可能会增加死亡风险,尽管在治疗停止时,高氧组的死亡率并没有显著升高。
ICU-ROX试验包括1000名至少接受1天机械通气的患者。通过将SpO2下限设定为90%来预防低氧血症。保守组SpO2上限为97%,只要SpO2>90%,吸入氧浓度降至最小值21%。在普通(常规)氧治疗组中,吸入氧浓度或SpO2没有限制。主要结局(第28天无呼吸机天数)在常规氧治疗组和实验组之间没有差别。纳入后180天死亡率也没有不同。
在LoCO2试验中,急性呼吸窘迫综合征患者暴露在保守氧合目标(PaO2 55-80 mmHg和SpO2 88-92%)或自由氧合目标(PaO2 90-105 mmHg和SpO2≥96%)中7天,两组机械通气策略相同,主要结局两组之间28天死亡率没有显著差异。然而试验提前终止,因为保守氧疗组发生了5例肠系膜缺血,而自由氧疗组没有发生,而且保守氧疗组90天死亡率更高(44%vs.30%)。
迄今为止,HOT-ICU研究是针对危重病患者低氧与高氧治疗的最大规模 RCT, 2888 名入住 ICU的低氧型呼吸衰竭患者,随机分配PaO2目标为 60 mmHg或90 mmHg。主要结局90 天死亡率无显着差异,低氧组和高氧组分别为 42.9% 和 42.2%。两组的次要结局也相似。
最近,对400名满足至少2项SIRS标准的患者进行随机对照试验,对照组和实验组均在临床实践范围内选择氧合目标。对照组(高-正常)PaO2控制在14-18kPa时,通过在临床上尽可能将吸氧浓度限制在最大0.60,来限制高氧性肺损伤风险。实验组(低-正常)动脉血氧分压目标为8-12kPa。基于先前一项研究,开发一种新的器官衰竭替代终点(SOFARANK)。SOFARANK是随机分组后前14天SOFA评分的秩次结果,不包括SOFA评分中的呼吸部分,因为它受到氧合目标的影响。两组器官衰竭秩次没有显着差异(p = 0.06),但倾向于支持高-正常氧合目标(如置信区间与高氧-正常氧合目标的临床重要损害不一致)。轻度低氧血症在低-正常氧合组中更常见,但严重低氧血症(PaO2 <5 kPa)在两个氧合组中相似。两组的其他次要结局(机械通气持续时间和死亡率)相似。
在ICU-ROX研究中对使用呼吸机的脓毒症患者进行的事后亚组分析中,保守氧疗和常规氧疗在主要结局(90天死亡率)或任何次要结局之间没有发现差异。治疗效果的点估计倾向于常规氧疗,这与我们最近的研究结论一致。
自2014年以来,发表了一些系统性综述和荟萃分析,包括上述随机对照试验和其他危重患者研究。
2014年一项荟萃分析,包括17项观察性研究和1项前瞻性前-后研究。在纳入的研究中,只有4项专门针对重症患者。由于这4项研究的异质性,数据不能合并。在心脏骤停、中风和创伤性脑损伤患者的合并研究中,高氧组的死亡率增加。
在IOTA系统回顾和荟萃分析中,纳入了27项随机对照试验,包括来自几个亚组的16,037名急症患者。整体自由氧疗组的住院、30天和最长随访死亡率显著高于整体保守氧疗组。
2021年,一项包括7项随机对照试验的荟萃分析发表,涉及5265名患者。保守组和常规组的最长随访死亡率总体上是相同的。然而,在对仅包括轻至中度低氧血症(PaO2/FiO2>100 mm Hg)的三项研究分析中,使用保守氧疗的死亡率显著较低。
同样在2021年,对机械通气危重患者中的8项随机对照试验进行了网络荟萃分析。累积秩(SUCRA)评分和生存曲线显示,与自由(>150 mm)和极保守(55-70 mm Hg)目标相比,中度(90-150 mm Hg)PaO2目标在三级和四级分类中的优势,以及保守(70-90 mm Hg)PaO2在四级分类中的优势。

未来研究
两项比较ICU患者保守和常规氧合目标的大型随机对照试验已经注册,目前正在招募中。Mega-ROX试验旨在纳入40,000名住进ICU接受有创机械通气或入院后开始有创机械通气的成人。对于对照组(自由或常规目标),唯一的条件是吸入氧浓度≥为0.30。在治疗组(保守氧疗)中,如果可能,吸入氧浓度将降至0.21,但SpO2限制在最低可接受的90%,SpO2最高目标为94%或95%。主要结局是随机分组后90天内住院死亡率。使用自适应随机化程序,更多的受试者将被分配到正在进行的招募期间死亡率最低的组,并按亚组分层。效能计算根据 IOTA 系统评价、荟萃分析和 ICU-ROX 试验数据进行,将探讨危重患者诊断亚组(缺氧缺血性脑病、急性脑损伤和脓毒症)治疗效果的异质性。
英国-ROX试验[33]旨在纳入16,500名因机械通风而进入重症监护病房或因其他原因入院后接受机械通风的成年患者。对照组(常规氧疗)按当地惯例,除常规护理外,无其他条件。干预组(保守氧疗)的目标是血氧饱和度在88%到92%之间。主要结局是第90天的死亡率和经济结果(增量成本、质量调整寿命年(QALY)和90天的净货币收益)。以前没有在这种背景下研究过经济结果。
结论
在不同的危重患者中,临床前研究和大型观察性研究中发现的高氧血症的潜在有害影响尚未在大型 RCT 中得到证实。从目前文献来看,避免过于保守和过于自由的氧合目标似乎是合理和谨慎的。目前尚不清楚危重患者中是否有特定的亚组或条件,会受益于正常氧血症范围之外的氧合目标。就氧疗而言,Paracelsus声明“剂量产生毒药”50年后,仍然不完全清楚从药物转为危险毒物的剂量是多少。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













