阿斯利康/牛津新冠疫苗三期临床将重启
2020-09-13 JACKZHAO MedSci原创
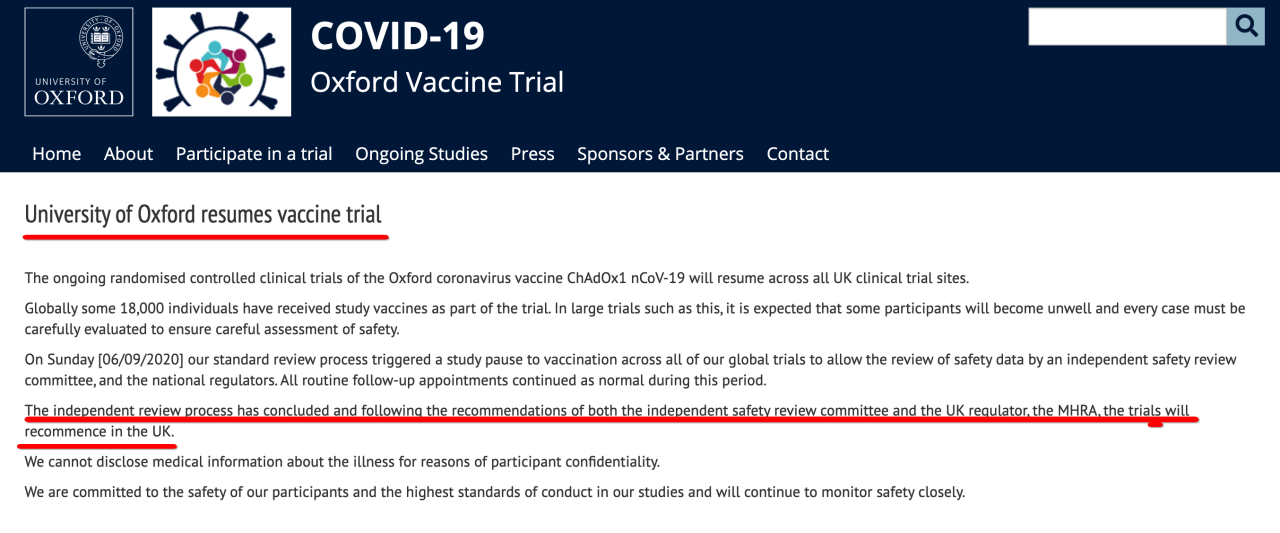
英国药品与健康产品管理局(MHRA,即英国药监局)已建议重启其合作开发的新冠疫苗AZD1222临床三期试验,但声明并未说明具体那一天恢复试验。
https://covid19vaccinetrial.co.uk/trial-resumes
9月12日,牛津大学发布的一份声明中表示,上周日(9月6日)由于需要独立评估安全数据而导致试验暂停后,英国医药产品审批与监管部门英国药品与健康产品管理局(MHRA,即英国药监局)已建议重启其合作开发的新冠疫苗AZD1222临床三期试验,但声明并未说明具体哪一天恢复试验。
该大学声明也并未透露患者病情的详细信息。此前接种该疫苗的参与者出现神经系统症状后,该研究先前于7月停止了几天。事实证明这是与疫苗无关的多发性硬化的未诊断病例。

https://www.astrazeneca.com/content/astraz/media-centre/press-releases/2020/covid-19-vaccine-azd1222-clinical-trials-resumed-in-the-uk.html
阿斯利康声明也表示,英国独立安全审查委员会已经完成调查,向MHRA建议,英国的试验可以安全地重启。虽然在疫苗试验阶段,出现暂停是十分常见的,但是受到密切关注的阿斯利康/牛津疫苗研发遇阻备受关注,即全球开发进展最快试验疫苗之一的可行性,希望能够预防新冠大流行。
但阿斯利康和牛津大学周六发表的声明并未透露包括美国在内的英国以外的临床试验状态。目前该疫苗在巴西、南非等地实施三期临床试验。上个月末,阿斯利康开始在美国招募30000名参与者,以进行最大规模的疫苗研究。它还在英国成千上万的人以及在巴西和南非的小型研究中对该疫苗进行了测试。
阿斯利康首席执行官帕斯卡尔(Pascal Soriot)在本周四表示,一个独立的安全审查委员会正在审查参与者的疾病是由疫苗引起还是与疫苗无关。 牛津大学说,作为试验的一部分,大约有18000人接受了“研究疫苗”。
声明称,由于参与者的机密性,无法不能透露有关疾病的医学信息。 公司将致力于确保参与者的安全和研究中的最高行为标准,并将继续密切监测试验疫苗安全性。
尽管阿斯利康首席执行官帕斯卡尔(Pascal Soriot)周三对一群投资者表示,她的症状与横纹肌炎相符,但尚未正式披露引发全球三期试验暂停的这名患者详情,该病例发生在英国一名妇女受试者身上。 这是一种涉及脊髓发炎的严重疾病,可能导致肌肉无力,瘫痪,疼痛和膀胱问题。
世界卫生组织首席科学家Soumya Swaminathan博士说,联合国卫生机构对牛津和阿斯利康疫苗试验的暂停并不过度担心,称这是对国际社会对不可避免的“警醒”,医学研究本身就是跌宕起伏的。

值得注意的是我国国药集团中国生物披露,经国家药监局批准,武汉生物制品研究所、北京生物制品研究所研发的新冠灭活疫苗分别于6月30日、7月23日就纳入国家新冠病毒疫苗紧急使用。据国药中国生物总法律顾问周颂介绍,目前国家批准了三支疫苗,国药集团中国生物就占了其中的两只,目前也是紧急使用接种量最大的人数最多的,打了数十万人次,无一例明显不良反应,无一人感染。
另据路透社报道称,北京科兴生物研发的新冠疫苗也已被用于紧急接种。科兴生物董事长尹卫东在服贸会期间表示,科兴自愿向大约2000至3000名员工及其家人提供疫苗。尹卫东称,自己及妻子、父母均已接种。受种者在注射疫苗前会被告知可能的副作用及该疫苗仅完成了早期和中期试验情况。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#三期临床#
114
确实不要放弃
129
阿斯利康疫苗有重大缺陷。
117
感谢分享
118
不容易啊
136
安全是第一要务,点赞!#新冠肺炎# #新冠疫苗#
215
新冠肺炎,疫情何时才能消失
60
重启#新冠肺炎##疫苗#
167