JACC-BTS 中山大学附属第八医院伍贵富教授团队揭示血流切应力调控动脉粥样硬化的新机制
2024-06-18 论道心血管 论道心血管 发表于上海
该研究有望为防治动脉粥样硬化提供新的潜在靶点。
血流切应力是血流与血管壁摩擦产生的平行于管壁表面的切线应力,主要作用于血管内皮细胞(Endothelial Cells, ECs),在正常生理条件下对维持ECs的稳态至关重要。已报道生理水平的层流切应力(Laminar Shear Stress, LSS)通过降低炎症分子的表达,抑制动脉粥样硬化的发生。相反,振荡的低切应力(Low Oscillating Shear Stress, OSS)促进内皮炎症和动脉粥样硬化的进展。环状RNAs (circRNAs)是一类新型的内源性RNA,其在心血管疾病(包括动脉粥样硬化)中发挥着关键调控作用。然而,circRNAs是否介导血流切应力对内皮炎症及动脉粥样硬化的调控作用尚不清楚。
2024年5月27日,中山大学附属第八医院伍贵富教授团队在JACC: Basic to Translational Science发表了题为“Shear-Sensitive circRNA-LONP2 Promotes Endothelial Inflammation and Atherosclerosis by Targeting NRF2/HO1 Signaling”的研究论文,首次发现生理层流切应力下调circRNA-LONP2的表达,并揭示了circRNA-LONP2通过miR200a-3p/KEAP1以及miR200a-3p/YAP1/EZH2轴抑制NRF2/HO-1信号通路,促进内皮炎症和动脉粥样硬化的分子机制。该研究有望为防治动脉粥样硬化提供新的潜在靶点。

首先,作者探讨了层流切应力刺激24小时后ECs中circRNAs表达水平的变化情况,发现层流切应力显著下调circRNA-LONP2的表达。接着,作者对circRNA-LONP2进行了一系列表征,充分论证了circRNA-LONP2具有典型环状RNA的特征。核质分析和RNA原位杂交显示,circRNA-LONP2主要定位于ECs的细胞质中,表明细胞质可能是circRNA-LONP2发挥生物效应的主要场所。
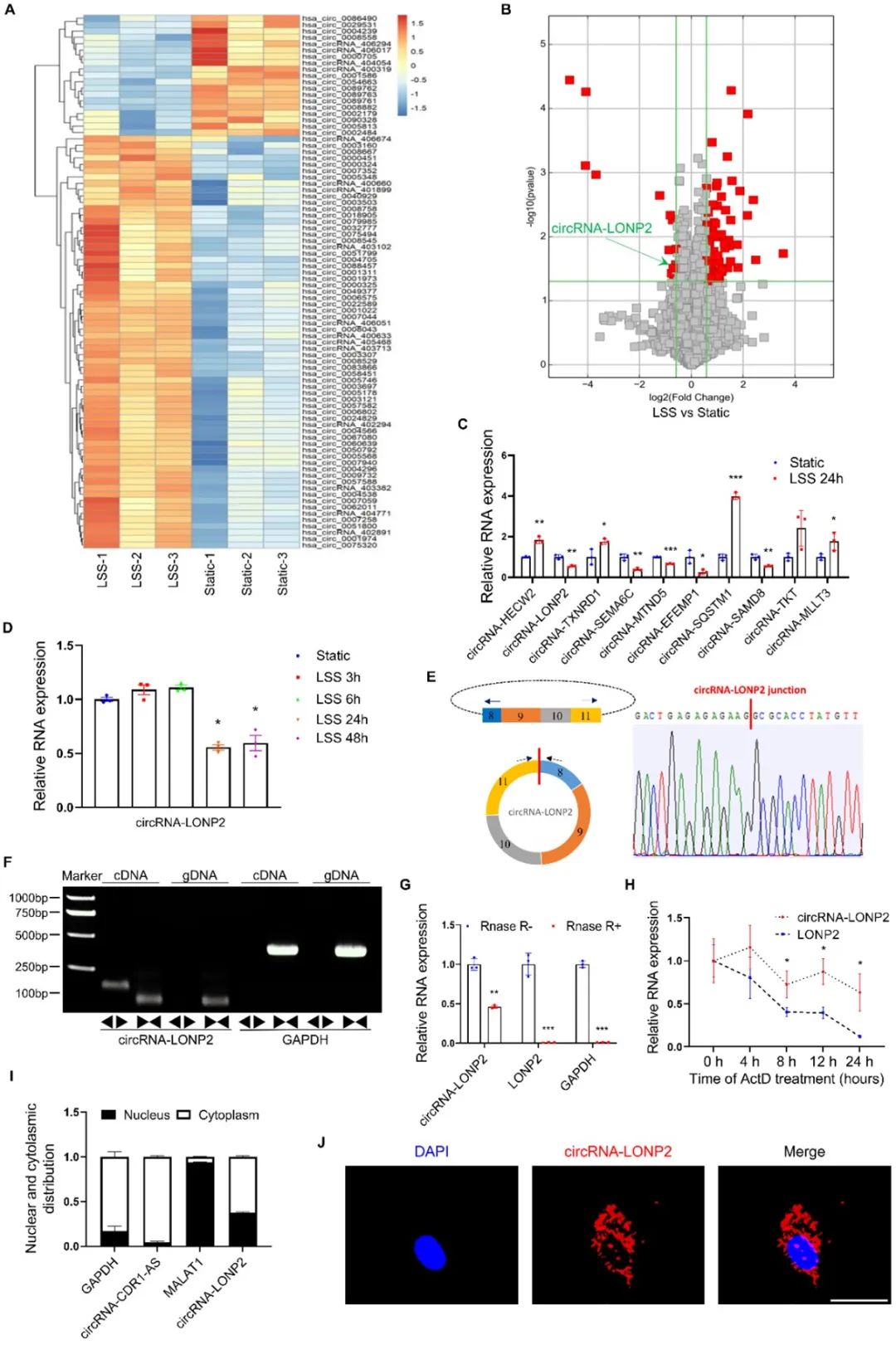
随后,为了研究circRNA-LONP2的生物学功能,作者开展了基因沉默和过表达实验。沉默circRNA-LONP2降低了KEAP1和炎症基因VCAM-1、ICAM-1的mRNA和蛋白质水平,增加了抗氧化和抗炎基因NRF2、HO-1的mRNA和蛋白质水平,并抑制单核细胞与内皮细胞的黏附。此外,沉默circRNA-LONP2部分减弱了OSS诱导的ECs中VCAM-1和ICAM-1蛋白表达。如预期,circRNA-LONP2的过表达起着与circRNA-LONP2沉默相反的作用,并且过表达circRNA-LONP2部分抵消了LSS诱导的内皮炎症。上述结果提示circRNA-LONP2介导血流切应力对ECs炎症的调控作用。
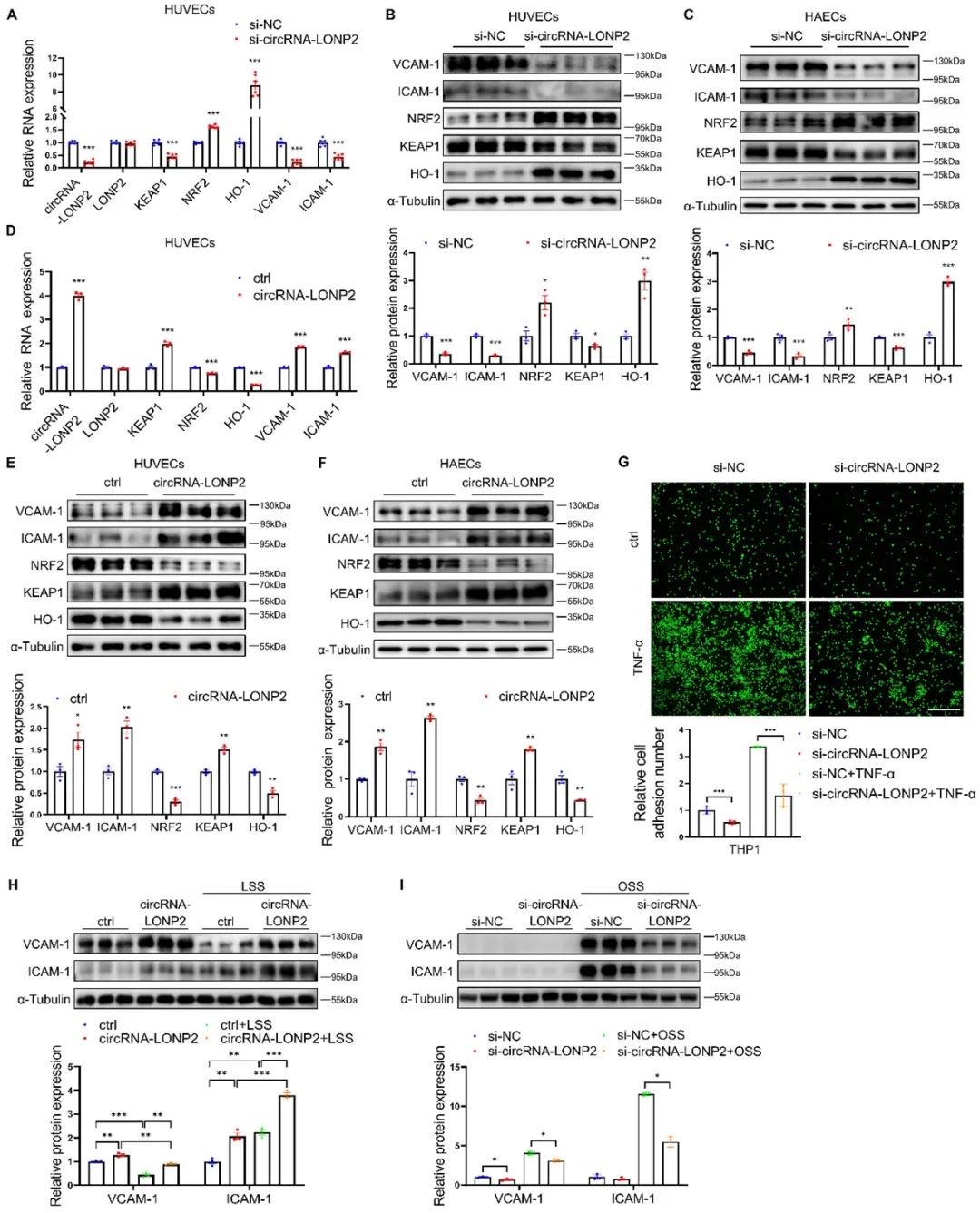
为了排除circRNA-LONP2过表达时产生的线性副产物的影响,作者构建了右端反向拼接环化序列缺失(R-缺失)质粒,使得该质粒只产生线性转录物。如预期,R-缺失组丧失了诱导ECs炎症和氧化应激的能力,表明circRNA-LONP2的线性副产物不调节ECs炎症和氧化应激。另外,circRNA-LONP2的沉默显著逆转了circRNA-LONP2过表达诱导的ECs炎症和氧化应激,但对线性副产物的表达没有影响。这些结果表明,circRNA-LONP2,而非其线性转录本,是诱导ECs炎症和氧化应激的主要原因。
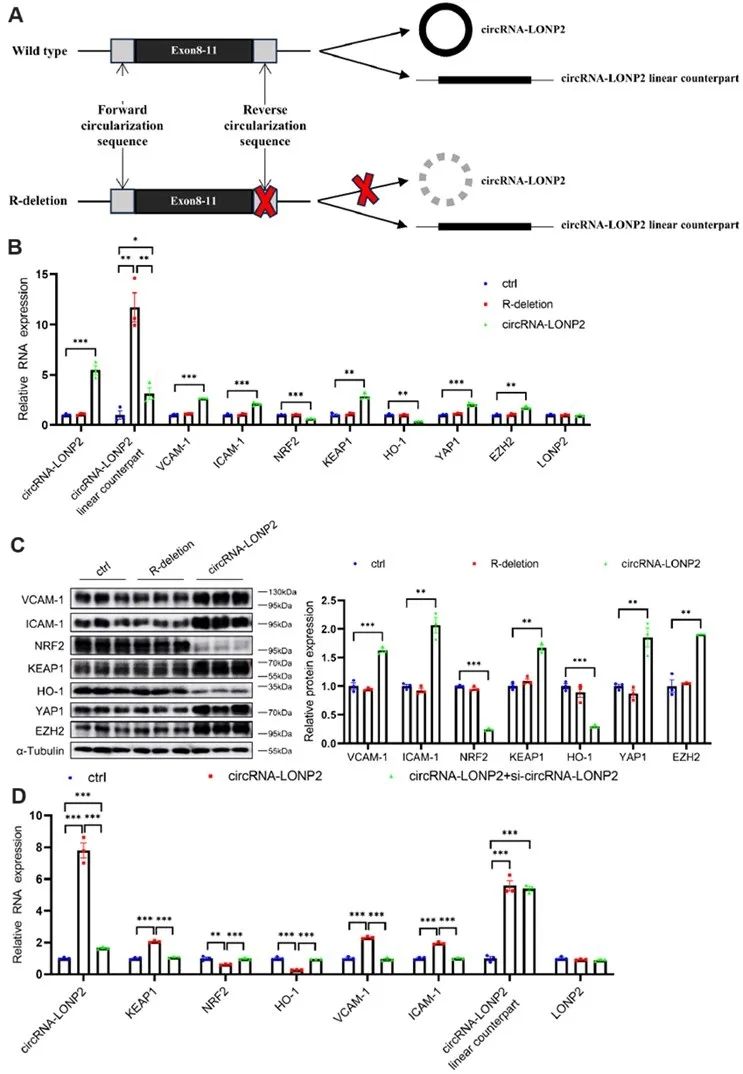
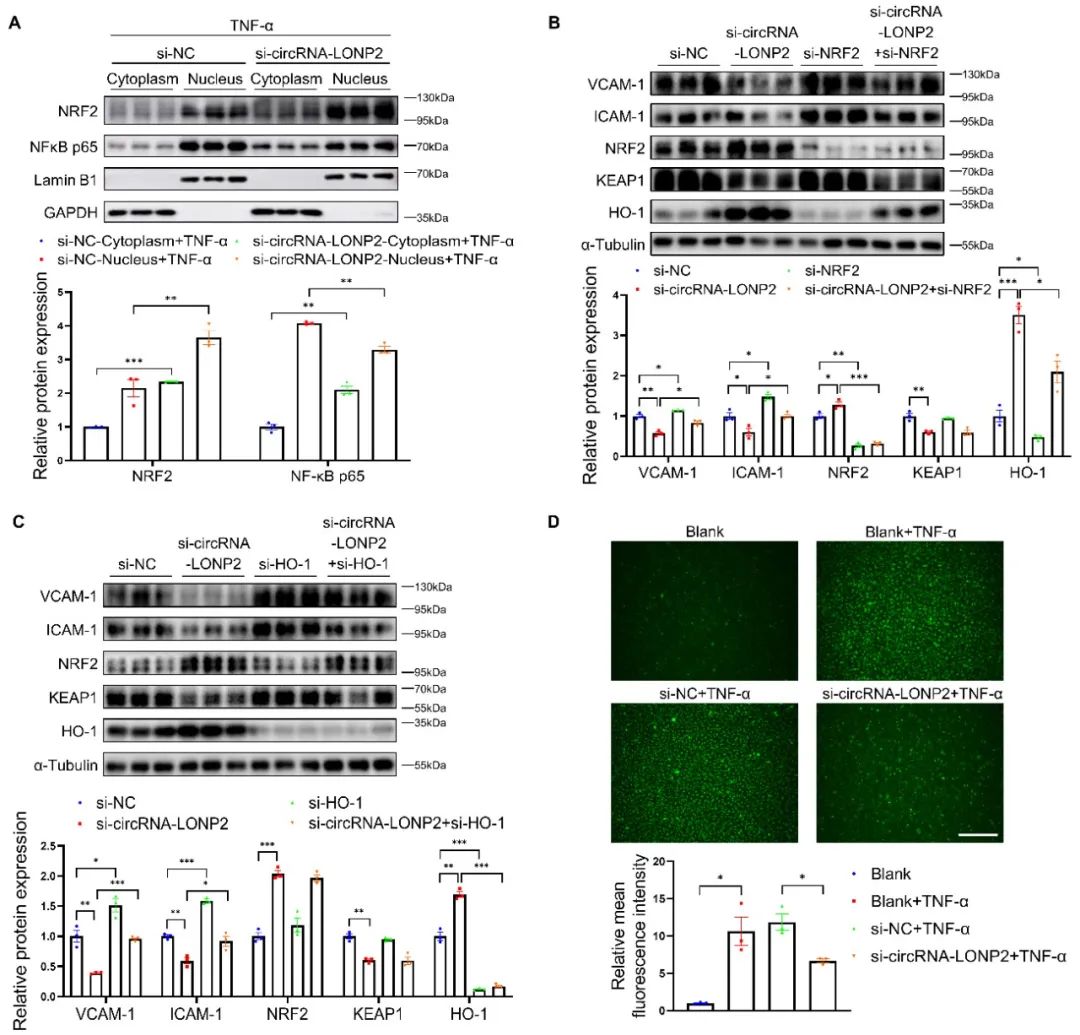
接着,为探究circRNA-LONP2诱导ECs炎症和氧化应激的可能机制,作者进行了细胞核、细胞质蛋白western blot分析。结果发现沉默circRNA-LONP2减弱了TNF-α诱导的NF-κB p65的核转位,而促进了NRF2的核转位,表明circRNA-LONP2可能通过调节NRF2和NF-κB的核转位来诱导ECs炎症和氧化应激。已知NRF2/HO-1通路具有抗炎特性,因此,作者探讨了circRNA-LONP2是否通过NRF2/HO-1轴调节ECs炎症。如预期,抑制NRF2或其下游靶点HO-1,显著消除了circRNA-LONP2 siRNA在ECs中的抗炎效应。这些数据表明,circRNA-LONP2通过NRF2/HO-1轴调节ECs炎症。
由于circRNA-LONP2主要定位于ECs的细胞质中,提示circRNA-LONP2可能主要作为miRNA海绵来调节基因表达。于是作者通过StarBase数据库预测并筛选出五个广泛保守的miRNAs (miR-10a-5p、miR-10b-5p、miR-141-3p、miR-200a-3p和miR-216b-5p),并通过MS2 RNA pull-down实验、荧光原位杂交实验、双荧光素酶报告基因实验等,最终确定miR-200a-3p与circRNA-LONP2 存在互作。
作者进一步评估miR-200a-3p的生物学功能发现,miR-200a-3p诱导的细胞表型与沉默circRNA-LONP2所诱导的细胞表型相似,提示miR-200a-3p可能介导了circRNA-LONP2对ECs功能的调控作用。此外,转染miR-200a-3p抑制剂显著逆转了circRNA-LONP2沉默对KEAP1、VCAM-1和ICAM-1蛋白表达的抑制作用,同时消除了circRNA-LONP2沉默诱导的NRF2和HO-1的蛋白表达。上述结果提示,沉默circRNA-LONP2所诱导的抗氧化和抗炎作用是通过miR-200a-3p介导的。
有趣的是,作者还发现miR-10a-5p和miR-10b-5p也可以被circRNA-LONP2富集,尽管效率不及miR-200a-3p。已有研究表明,miR-10a在培养的人主动脉内皮细胞中具有抗炎作用。因此,为了检测circRNA-LONP2是否也通过结合miR-10a-5p和miR-10b-5p来调节ECs炎症,作者构建了circRNA-LONP2-MUT1 (突变miR-200a-3p结合位点的circRNA-LONP2)载体和circRNA-LONP2-MUT2 (突变miR-10a/b-5p结合位点的circRNA-LONP2)载体。结果显示,在miR-200a-3p结合位点发生突变的情况下,circRNA-LONP2的促氧化应激和促炎作用大部分被阻断,而在miR-10a/b结合位点发生突变对circRNA-LONP2的功能没有影响,这表明circRNA-LONP2是通过结合miR-200a-3p促进氧化应激和ECs炎症。
作者进一步探讨miR-200a-3p的表达水平是否受circRNA-LONP2或LSS的调控,结果发现敲低或过表达circRNA-LONP2对miR-200a-3p的表达没有影响。此外,LSS对miR-200a-3p的表达也没有影响。这些数据表明,切应力敏感的circRNA-LONP2调节内皮炎症,但不影响miR-200a-3p的表达(详见补充数据)。
已有报道miR-200a-3p靶向作用于KEAP1,因此circRNA-LONP2可能通过miR-200a-3p/KEAP1/NRF2通路诱导ECs炎症。为了证实这一猜想,作者进行了双荧光素酶报告基因实验,结果显示与对照组相比,转染miR-200a-3p后,KEAP1 WT报告载体的荧光素活性显著降低,而MUT载体则无显著改变。此外,作者发现circRNA-LONP2的过表达或敲低进一步增加或减少了KEAP1 WT载体的荧光素酶活性。这些结果表明,circRNA-LONP2通过结合miR-200a-3p,诱导KEAP1的表达并促进ECs氧化应激和炎症。
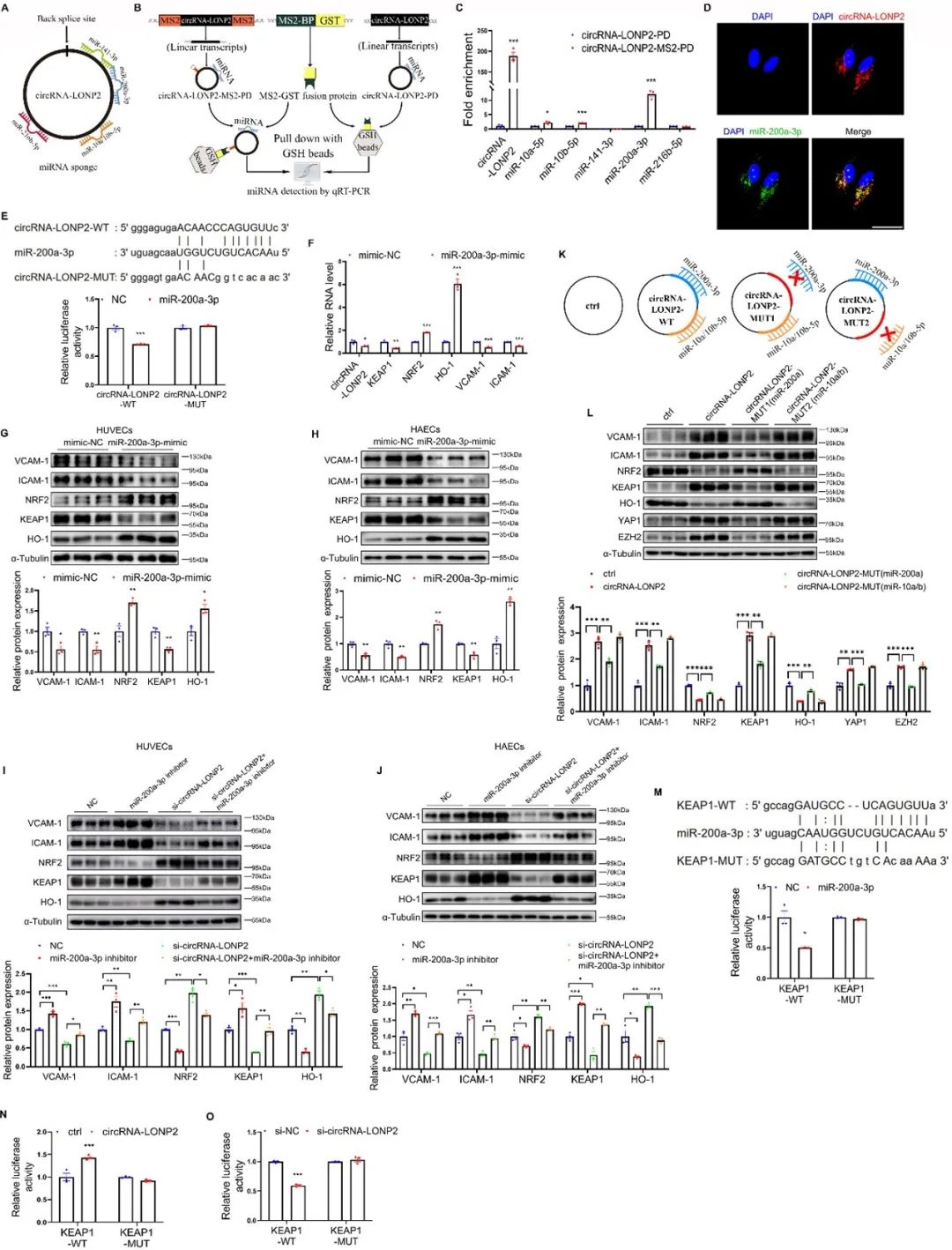
已有研究报道,使用SLRSPS多肽修饰的重组腺相关病毒载体9(AAV9SLRSPS)可以有效靶向ECs。为探讨内皮circRNA-LONP2对动脉粥样硬化的调控作用,作者使用AAV9SLRSPS-Tie2-circRNA-LONP2或AAV9SRRSPS-Tie2-NC感染左颈总动脉部分结扎的ApoE-/-小鼠。小鼠Tie2启动子被用来确保circRNA-LONP2的内皮特异性表达。与对照组相比,AAV9SLRSPS-Tie2-circRNA-LONP2组ApoE-/-小鼠的斑块面积、内膜增生和脂质沉积显著加重。此外,免疫荧光染色显示,circRNA-LONP2显著增加了促炎标志物Vcam-1、Icam-1和单核吞噬细胞标志物Mac-3的蛋白水平,同时降低了抗氧化和抗炎Nrf2、Ho-1的蛋白水平,而不影响Keap1的蛋白表达。这些数据表明,circRNA-LONP2通过诱导ECs氧化应激和炎症来加速动脉粥样硬化的进展。
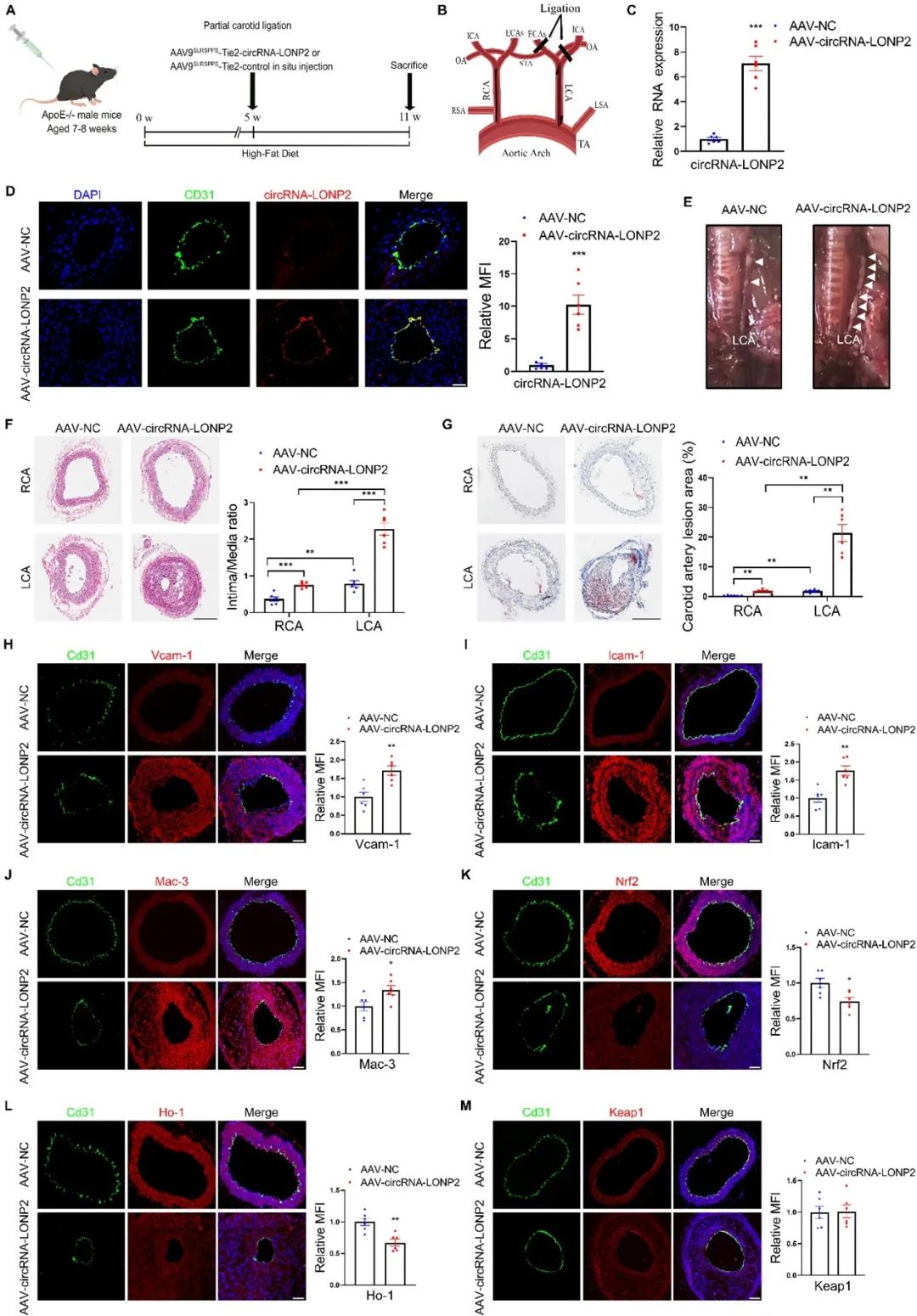
虽然miR-200a-3p在大多数脊椎动物中是保守的,但miR-200a-2p结合位点在小鼠Keap1中并不保守,提示circRNA-LONP2对小鼠动脉粥样硬化进展的调节作用可能由其他miR-200a-3p靶标介导。已有研究显示,miR-200a-3p通过靶向EZH2抑制炎症和动脉粥样硬化病变形成,且EZH2抑制NRF2表达。此外,促进动脉粥样硬化病变的YAP1是miR-200a-3p的另一个靶标,并且YAP1促进EZH2的转录。因此,作者进一步探讨了EZH2和YAP1是否参与circRNA-LONP2的促氧化和促炎作用。如预期,miR-200a-3p的过表达降低了EZH2和YAP1蛋白表达。沉默circRNA-LONP2下调YAP1和EZH2的表达,而过表达circRNA-LONP2则相反。这些数据表明,EZH2和YAP1是circRNA-LONP2的下游靶标。进一步研究发现,沉默YAP1或其下游靶标EZH2降低了VCAM-1和ICAM-1的mRNA和蛋白水平,同时增加了NRF2和HO-1的mRNA和蛋白质水平,而不影响KEAP1的mRNA和蛋白质水平。此外,YAP1或EZH2的沉默显著消除了circRNA-LONP2的促氧化和促炎作用。小鼠血管组织的免疫荧光染色结果与前述实验结果一致。总之,这些数据表明切应力敏感的circRNA-LONP2通过保守的miR-200a-3p/YAP1/EZH2轴,调节血管内皮细胞氧化应激和炎症反应。
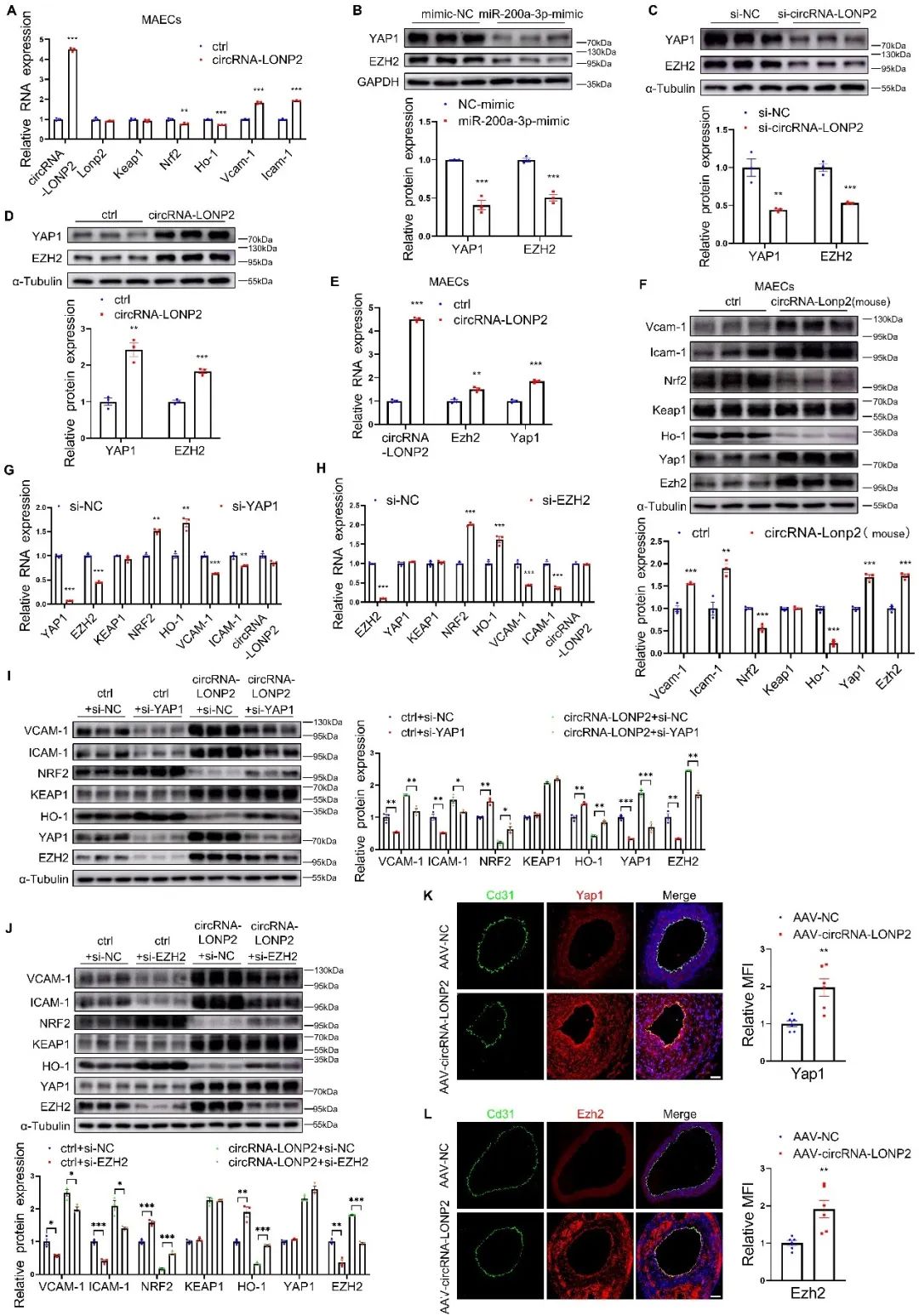
综上所述,生理切应力通过下调血管内皮细胞circRNA-LONP2的表达,增强了miR-200a-3p的活性,进而抑制KEAP1、YAP1和EZH2的表达,激活NRF2/HO-1通路,抑制内皮氧化应激和炎症。本研究揭示了circRNA-LONP2调节NRF2信号的两种机制(保守和物种特异性机制)。其一,circRNA-LONP2通过miR-200a-3p/KEAP1轴调控NRF2的核转运(人类特有);其次,circRNA-LONP2通过miR-200a-3p/YAP1/EZH2轴调控NRF2的表达(人和小鼠)。这些发现为内皮circRNA-LONP2的致动脉粥样硬化作用提供了有力的证据,并表明其可能是动脉粥样硬化的潜在干预靶点。
中山大学附属第八医院王若玉、曾悦为该论文共同第一作者,中山大学附属第一医院范文冬副研究员、中山大学附属第八医院伍贵富教授为该论文共同通讯作者。该研究得到了国家重点研发专项、国家自然科学基金、广东省自然科学基金和深圳市重点学科建设基金等的支持。
原文链接:
https://www.jacc.org/doi/10.1016/j.jacbts.2024.02.019
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#动脉粥样硬化# #内皮炎症#
83