诺华ceritinib获FDA优先审评,有望一线用于肺癌治疗
2017-02-24 MedSci MedSci原创
今日,诺华(Novartis)宣布,美国FDA接受了该公司的补充新药申请(sNDA),并批准优先审评扩大使用Zykadia(ceritinib)一线治疗转移性非小细胞肺癌(NSCLC)患者,这些病人的肿瘤通过FDA批准的测试所检测为间变性淋巴瘤激酶阳性(ALK+)。 FDA还向Zykadia授予了突破性疗法认定,用于一线治疗ALK+转移性NSCLC患者,癌细胞转移至了脑部。在全世界范围内,肺癌导致
今日,诺华(Novartis)宣布,美国FDA接受了该公司的补充新药申请(sNDA),并批准优先审评扩大使用Zykadia(ceritinib)一线治疗转移性非小细胞肺癌(NSCLC)患者,这些病人的肿瘤通过FDA批准的测试所检测为间变性淋巴瘤激酶阳性(ALK+)。 FDA还向Zykadia授予了突破性疗法认定,用于一线治疗ALK+转移性NSCLC患者,癌细胞转移至了脑部。
在全世界范围内,肺癌导致的死亡人数比结肠癌、乳腺癌和前列腺癌加起来还要多,估计每年新增180万例肺癌病例。NSCLC最常见的肺癌类型,在这些患者中3-7%是ALK阳性的。Zykadia是一种间变性选择性间变性淋巴瘤激酶(ALK)抑制剂。众多医学研究表明, ALK可以与其他细胞功能蛋白结合以形成异常的“融合蛋白(fusion protein)”,造成癌症中某些肿瘤细胞的发展和生长,包括非小细胞肺癌(NSCLC)。Zykadia目前在全球64个国家获得批准。

使用Zykadia一线NSCLC的sNDA提交是基于对ASCEND-4研究的初步分析,ASCEND-4是一项全球3期随机、开放标签的多中心临床试验,评估了Zykadia与铂类化疗方案相比的安全性和有效性,还包括了在IIIB期或IV期ALK + NSCLC成人患者中的维持性治疗。该研究在28个国家的134个临床试验地点进行,随机分布于376例患者。研究发现:
使用Zykadia一线治疗患者的中位无进展生存期(PFS)为16.6个月(95%置信区间[CI]:12.6,27.2),而标准一线培美曲塞铂化疗与培美曲塞维持治疗的患者为8.1个月(95%CI:5.8,11.1)。与化疗组相比,Zykadia组获得了45%的PFS风险降低(风险比[HR] = 0.55,[95%CI:0.42,0.73;单侧p值<0.001])。
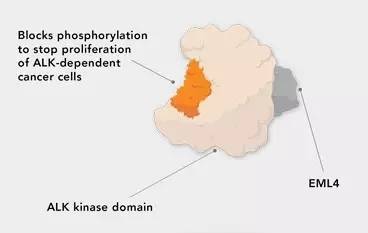
▲Ceritinib的作用机理(图片来源:Novartis官网)
“我们致力于推动对突变驱动肺癌的理解,这里仍然存在着重大的未满足需求,”Novartis全球药物开发负责人兼首席医疗官Vas Narasimhan博士说道:“今天FDA为Zykadia颁发针对新诊断ALK+转移性NSCLC患者的优先审评资格,包括对脑转移患者的突破性疗法认定,使我们更接近在正确时间为正确患者提供正确治疗的宗旨。”
参考资料:
[1] Novartis AG (NVS) Drug Zykadia Receives FDA Priority Review For First-Line Use In Patients With ALK+ Metastatic NSCLC
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#肺癌治疗#
79
#ceritinib#
72
#优先审评#
104
#诺华#
78
晚期肺癌又多个一个新药,可喜可贺!
125
新的药物,学习了
124