Circulation: 李红良团队系统介绍COVID-19的特点及其对心血管系统的影响
2020-04-25 国际循环 国际循环
2020年4月15日,心血管顶级杂志Circulation在线发表了武汉大学李红良教授与加拿大渥太华大学心脏中心的PeterP. Liu教授合作的题为“The Science underl
2020年4月15日,心血管顶级杂志Circulation在线发表了武汉大学李红良教授与加拿大渥太华大学心脏中心的PeterP. Liu教授合作的题为“The Science underlying COVID-19: Implications for the Cardiovascular System”的深度综述文章。该文章围绕COVID-19对心血管系统的影响,从临床和基础的角度对COVID-19进行了系统地梳理和阐述。
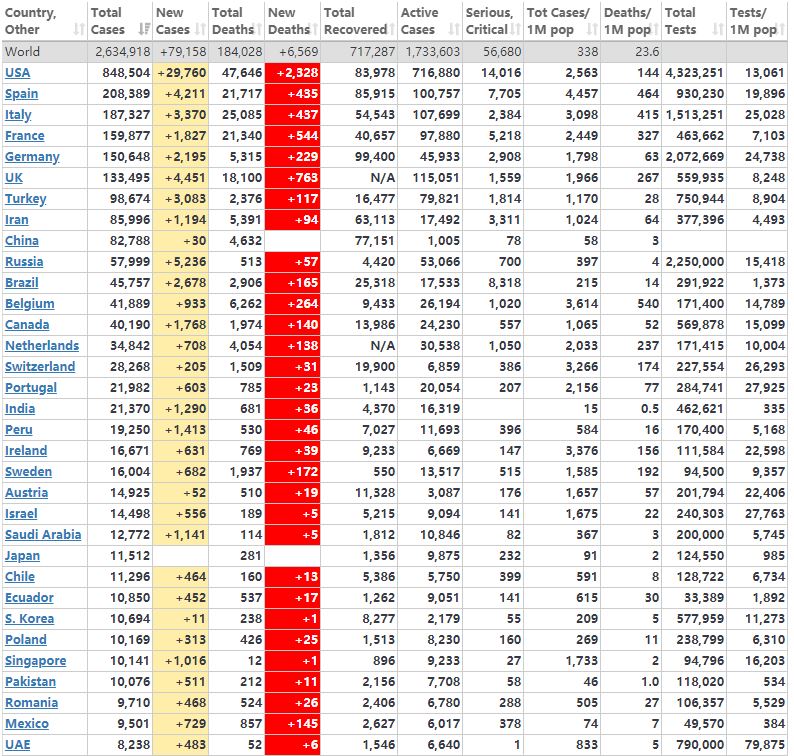
当前,随着新型冠状病毒肺炎(COVID-19)疫情在全世界范围内的持续肆虐,COVID-19在全球210个国家的累计确诊人数已突破240万大关,死亡人数超16万例,已成为国际关注的突发公共卫生事件。
虽然COVID-19的临床表现以呼吸系统症状为主,大量临床证据表明COVID-19也能够累及心血管系统。其次,合并心血管疾病的COVID-19患者,病情往往更加严重,死亡风险通常更高。因此,阐明COVID-19和心血管系统的关系,对于相关病人的救治以及该疾病的深入理解至关重要。
从流行病学看COVID-19
与心血管系统的相关性
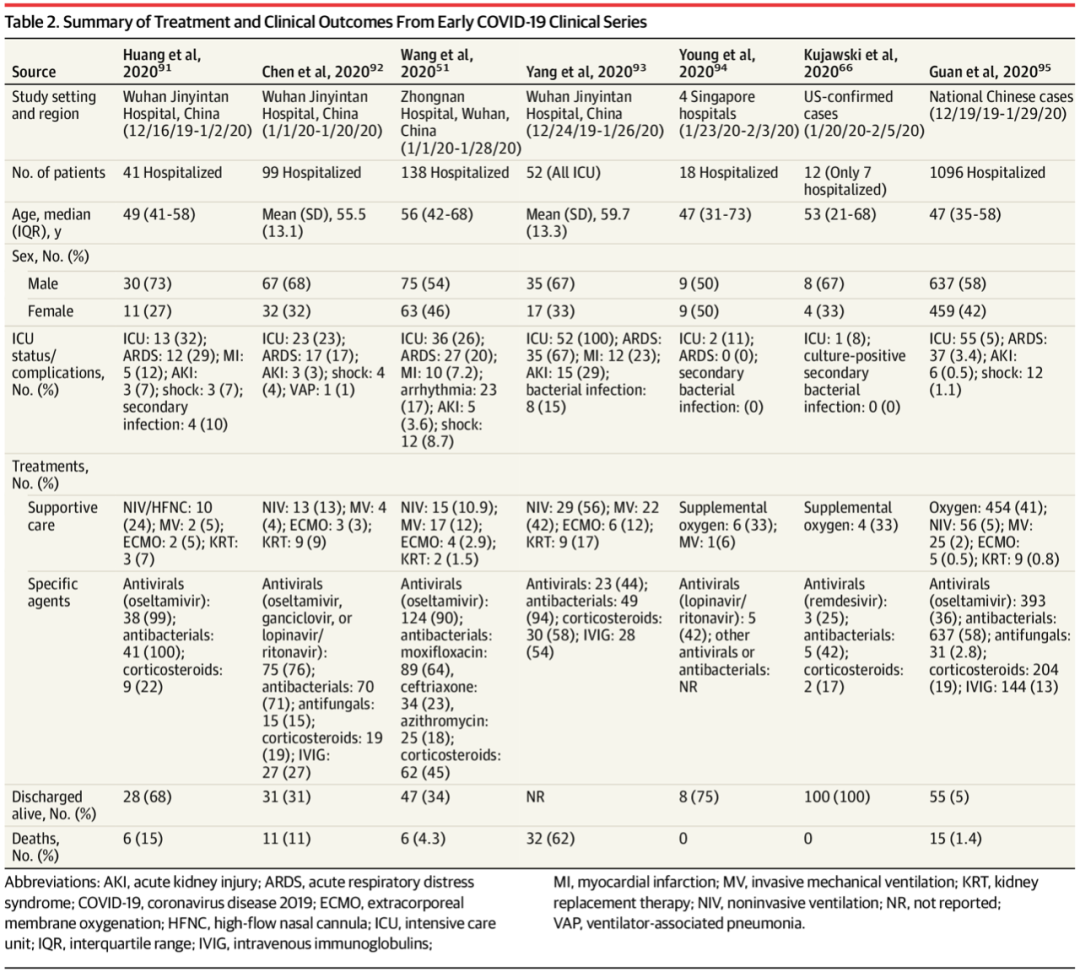
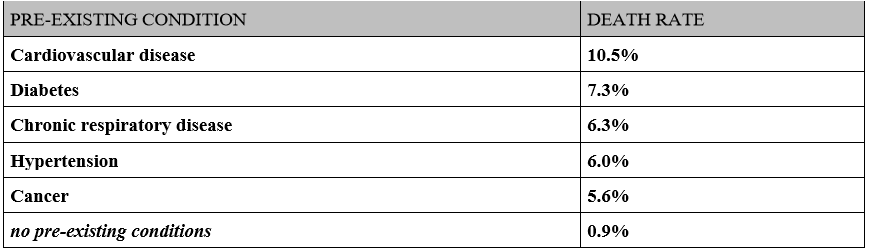
现有的流行病学资料表明,COVID-19患者中合并心血管疾病的比例较高,而该类患者的死亡率也显著上升。据报道,合并心血管疾病的COVID-19患者死亡率为10.5%,合并高血压患者的死亡率为6.0%,远远高于没有合并症的患者(0.9%)。同时COVID-19的感染也可以促进心力衰竭、心肌炎、心包炎、血管炎、心律失常等心血管并发症的发生。实验室检查发现,8-28% COVID-19患者出现肌钙蛋白的上升,提示合并心肌损伤。而伴有肌钙蛋白或脑钠肽(BNP)升高,以及存在潜在的心血管疾病或心血管危险因素的感染者,其重症率和死亡率均显著增加。
新型冠状病毒(SARS-CoV-2)
和COVID-19的特点
和SARS-CoV一样,SARS-CoV-2通过其刺突蛋白(Spike)结构与细胞表面的血管紧张素转化酶2(ACE2)结合,从而侵入细胞。而SARS-CoV-2的亲和力是SARS病毒的10到20倍。另外,研究者发现,在SARS-CoV-2 Spike蛋白的S1/S2亚基边界处具有furin蛋白酶切割位点,该位点能够增强病毒入侵宿主细胞的能力。SARS-CoV-2属于RNA病毒,具有高度变异性,能够在流行的过程中持续突变。另外,SARS-CoV-2在无症状感染者中也能够复制传播。基于以上特点,COVID-19具有高度传染性。流行病学数据提示,患有心血管疾病的人群可能更易感染SARS-CoV-2。而COVID-19患者合并的心肌损伤是由SARS-CoV-2直接感染心肌细胞所致,或是由机体炎症反应引发的二次效应,有待进一步的研究确认。
SARS-CoV-2通过
ACE2和TMPRSS2感染细胞
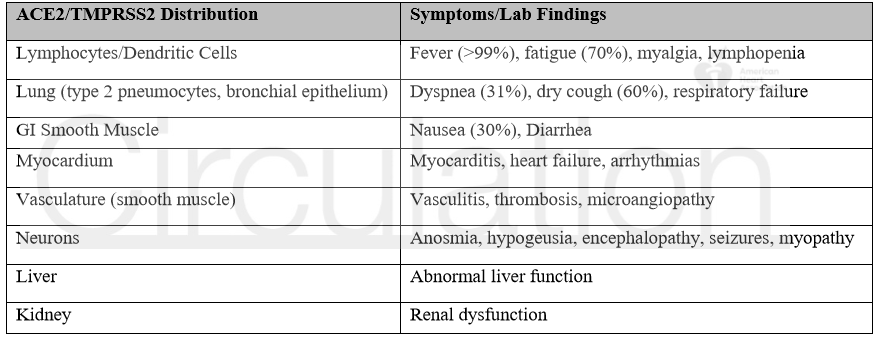
细胞表面受体ACE2和丝氨酸蛋白酶TMPRSS2是SARS-CoV-2入侵宿主细胞的关键蛋白。SARS-CoV-2通过其Spike蛋白与ACE2受体结合,TMPRSS2进一步激活Spike蛋白,促进病毒进入宿主细胞。ACE2和TMPRSS2共同表达于肺脏,心脏,胃肠道,肝脏,肾脏,神经元以及免疫细胞,理论上讲,以上均是SARS-CoV-2攻击的靶标。ACE2和TMPRSS2表达的组织分布特征有助于解释COVID-19患者的临床症状和实验室检查结果。研究表明,在糖尿病,高血压以及心衰患者中ACE2的表达量和活性显著增高。另外,ACE2的表达水平具有明显的性别差异,ACE2位于X染色体,理论上讲男性的ACE2数量是女性的一半,但实际上男性受感染的风险并未比女性低,男性患者的死亡率反而高于女性。在心衰患者中,男性外周循环的ACE2明显高于女性,但ACE2的外周水平并不能直接反映组织的表达。ACE2的组织分布,性别差异,表达水平和SARS-CoV-2感染以及COVID-19的临床表现之间的关系有待进一步的研究阐明。
病毒和受体的相互作用
以及潜在影响
SARS-CoV-2与ACE2结合并内化,以胞吞作用的方式进入细胞,通过膜融合,病毒的RNA被释放到细胞质中,从而引发感染。被侵犯和破坏的细胞释放潜在的危险信号,激活宿主的免疫反应,进一步诱发组织损伤。心肌细胞是SARS-CoV-2的潜在攻击靶标,患者的心肌损伤标志物持续升高的同时通常伴有炎症反应的增加,严重影响患者的预后,因此应尽早干预,防止心脏的进一步损伤。
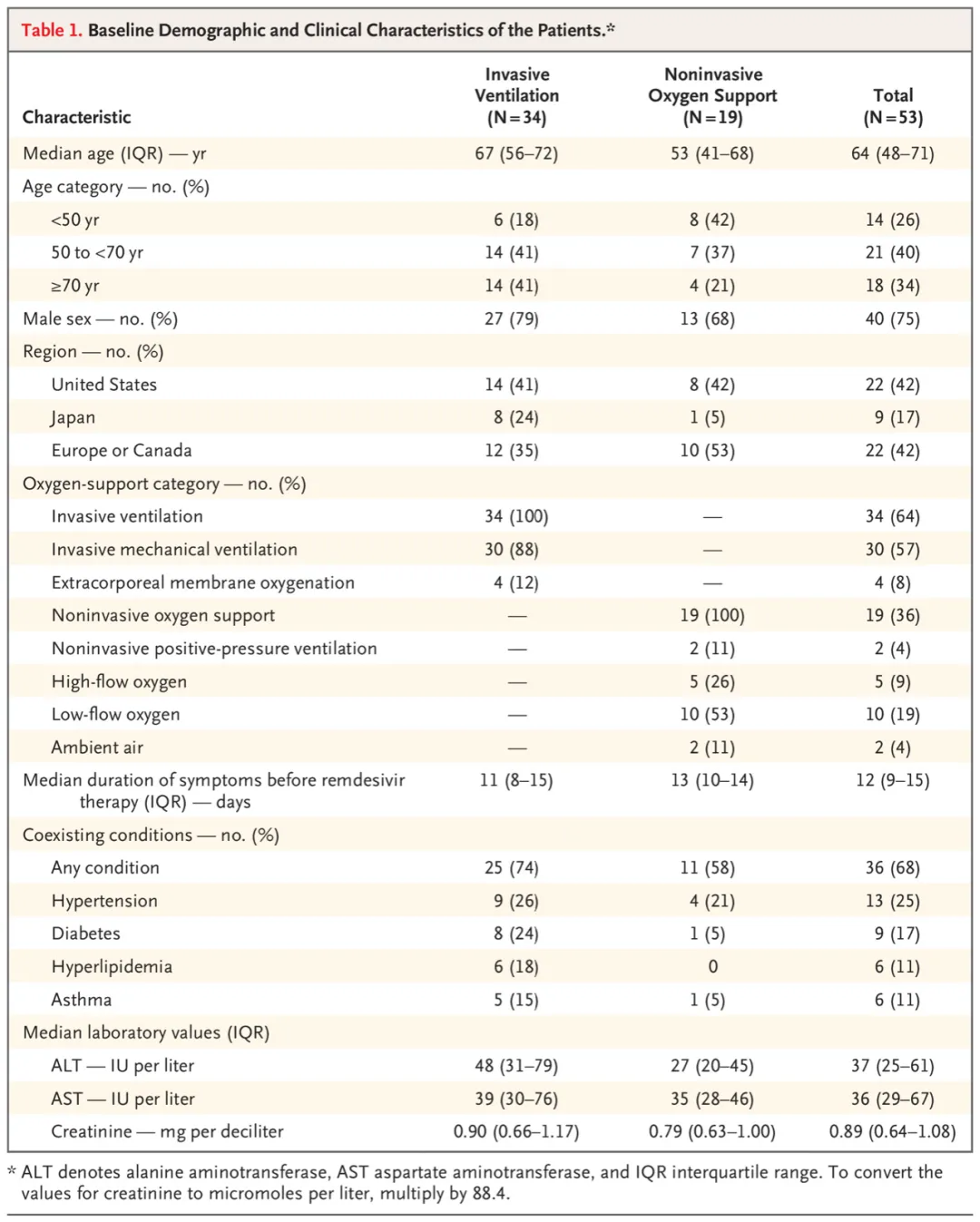
ACE2作为SARS-CoV-2感染细胞的受体,同时也是肾素-血管紧张素系统(RAS)的重要调控因子。ACE2能够将AngII水解成Ang 1-7,后者作用于Mas受体,发挥拮抗Ang II/AT1R的效应,如降低血压,舒张血管,抑制炎症和氧化应激等。SARS-CoV-2的感染引起ACE2的降低,使RAS系统的平衡向AngII/AT1R偏移,促进组织损伤。尽管目前并没有确切的证据评估,RAS系统抑制剂,如ACEIs/ARBs类药物对COVID-19患者的利弊,多数医疗组织推荐具有ACEIs/ARBs用药指征的患者继续使用该类药物。事实上,本团队的大样本临床研究证实,对于有用药指征的COVID-19患者(如高血压),ACEIs/ARBs的使用益处大于风险。

SARS-CoV-2感染和免疫系统
目前关于SARS-CoV-2感染所引起的免疫反应的分析相对比较局限。研究发现,80%的危重症患者出现淋巴细胞减少,淋巴细胞的比例可作为病情严重程度的评价指标。在对COVID-19死亡患者的分析中,最显著的发现是外周CD4+和CD8+T淋巴细胞,以及肺组织中的单核细胞和巨噬细胞均明显降低。除了低淋巴细胞血症,COVID-19患者,尤其是预后较差的患者,往往伴有IL-1β,IL-6水平的升高,引起细胞因子风暴和炎症反应的失控。面对伴有免疫调控紊乱的患者,如实验室检查提示低淋巴细胞血症,炎症标志物(CRP,IL-1β,IL-6等)升高,或其它器官损伤(c-TNT,BNP等)标志物上升,应紧密监测患者体征,纠正免疫平衡紊乱,尽早进行抗炎干预。

COVID-19对
微血管系统和凝血的影响
血管平滑肌细胞上表达ACE2和TMPRSS2,也是新冠病毒的潜在感染靶点。COVID-19患者的病理分析结果发现,在肺脏和其它受累组织中均存在微血管炎症和微血栓形成。此外,巨噬细胞的活化和内皮细胞的功能失调也对微血管炎症和微血栓形成起着推波助澜的作用。微血管炎症和微血栓形成能够加重患者的缺氧状态,促进组织损伤,严重影响患者预后。针对合并微血管炎症和微血栓形成的患者,如实验室检查发现IL-6和D-二聚体显著升高,应尽早考虑抗炎和抗凝药物的治疗,改善患者预后。
SARS-CoV-2感染和心脏
研究报道,8-28%的COVID-19患者伴有肌钙蛋白的升高,提示心肌损伤的发生。合并心肌损伤的COVID-19患者,死亡率显著上升,表明心肌损伤和患者的预后密切相关。部分患者可能伴有心脏的直接受累,包括心肌病、心肌炎或心力衰竭,影响患者的总体预后,早期识别和干预能够显著改善患者的临床结局。疑似急性心肌炎和心肌病的患者,心脏磁共振成像检查具有一定的价值。对于合并心衰的患者,应该考虑应用包括RAS抑制剂在内的相关治疗药物。心律失常是COVID-19患者的另一种常见并发症。研究表明,ICU收治的COVID-19患者中,房颤发生率高达50%,这些患者也伴有室性心律失常和心脏骤停。COVID-19患者心律失常的高发生率可部分归因于患者在病毒感染时的代谢紊乱、缺氧、神经激素及炎症应激,也可能与潜在的心肌炎和治疗药物的副作用有关。
COVID-19的潜在治疗策略
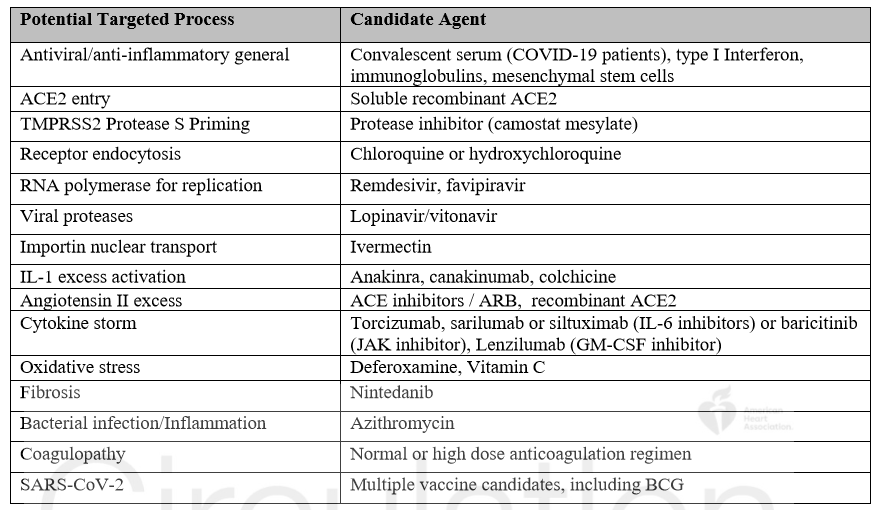
目前仍无COVID-19的针对性药物,对症支持治疗仍是主要的干预策略。已经有超过500项的临床药物研究正在进行中,包括抗病毒/炎症的药物,如COVID-19感染者的恢复期血清,I型干扰素,免疫球蛋白;针对ACE2受体的药物,如可溶性重组ACE2;靶向TMPRSS2的药物,如蛋白酶抑制剂(甲磺酸卡莫司他);针对受体内吞的药物,如氯喹,羟化氯喹;RNA聚合酶的抑制剂,如瑞德西韦;IL-1抑制剂,如阿那白滞素(Anakinra),卡那单抗(Canakinumab);RAS系统抑制药物,如ACEIs/ARBs,可溶性ACE2;针对细胞因子风暴药物,如IL-6 抑制剂(Torcizumab),GM-CSF抑制剂(Lenzilumab);抗凝药物,如肝素。接种疫苗仍然是传染病防控最有效的手段,SARS-CoV-2的Spike蛋白是疫苗研发理想的抗原靶点,目前已经有多个候选疫苗进入临床试验阶段。
COVID-19的长期的影响
和有待回答的问题
随着疫情的进展,将会有越来越多的患者从疾病中康复,同时也伴随着诸多问题亟待回答。这些康复的患者是否存在包括肺纤维化,其它器官损伤,以及糖皮质激素治疗所带来的相关后遗症?暴露的病人能否获得长期的免疫,机体产生的IgG是否具有中和病毒的能力?从流行病学的角度来看,随着大规模抗体检测的开展,多少人群能够获得对SARS-CoV-2的免疫力?疫苗的研发能否成功?病毒是否会持续变异?病毒是否存在天然宿主,大量的无症状携带者是否会引起新一波的流行?这些问题均有待进一步的回答。
在本次全球新冠肺炎疫情中,全世界的专家和学者们都纷纷通过开放平台展开合作,共享信息,以加快应对新冠肺炎疫情的速度。目前,我们对COVID-19的认识仍有很大的局限性和不确定性,数据驱动,科学决策对COVID-19的临床诊治和药物研发至关重要。关于COVID-19的疫情防控,我们仍有很长的路要走。
原始出处:
Hongliang Li,et al. The Science Underlying COVID-19: Implications for the Cardiovascular System. Circulation. Originally published15 Apr 2020
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言