近日,HER2双特异性抗体注射液(KN026)联合注射用多西他赛(白蛋白结合型)用于一线治疗HER2阳性复发转移性乳腺癌的注册临床试验申请,在中国获批。KN026是康宁杰瑞采用具有自主知识产权Fc异二聚体平台技术(CRIB)开发的HER2双特异性抗体,可同时结合HER2的两个非重叠表位,2022年SABCS公布了KN026联合多西他赛一线治疗HER2阳性复发/转移性乳腺癌的Ⅱ期临床研究数据,客观缓解率(ORR)为76.4%,中位缓解持续时间(mDoR)为24.0个月,疾病控制率(DCR)为100%,让我们看到双抗的实力。
双特异性抗体(Bispecific Antibody,BsAb)简称双抗,是一种特殊形式的人工抗体,具有两条抗原结合臂的抗体变形结构,能够同时识别两种不同的抗原。与单克隆抗体相比,双抗增加了一个特异性抗原结合位点,因而特异性更强、可较准确靶向肿瘤细胞并降低脱靶毒性。因其特异性和双功能性,现已成为抗体工程领域的研究热点。除了KN026,还有哪些双抗具有良好的临床疗效呢?
AK104
2022年6月29日,康方生物全球首创的PD-1/CTLA-4双特异性抗体卡度尼利单抗(AK104)正式获得国家药品监督管理局批准上市治疗晚期宫颈癌后,AK104是中国第一个PD-1/CTLA-4双特异性抗体。
卡度尼利单抗此次获批是基于一项卡度尼利单药用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌的Ⅱ期关键性临床研究。截至2021年8月5日,来自全国36家中心共111例晚期宫颈癌患者入组,接受卡度尼利6mg/kg 静脉输注,每2周1次给药。结果显示,经IRRC确认的ORR为33.0%,其中完全缓解(CR)率为12.0%,6个月和12个月持续反应时间(DoR)率分别为77.6%和52.9%。中位PFS为3.75个月,中位OS为17.51个月。亚组分析中,在PD-L1阳性(CPS≥1)患者中,ORR为43.8%,中位PFS为6.34 个月,中位OS未达到。安全性方面上,≥3级TRAE发生率为27.0%。
AK112
AK112康方生物研发的PD-1/VEGF双抗,是该公司继双抗PD-1/CTLA-4(AK104)之后第二款全球首创并进入临床开发阶段的双特异性抗体药物,2020年8月份,AK112获CDE官网获批,可在中国进一步开展针对晚期实体瘤的Ⅰb期临床试验。
2020年中国肿瘤免疫治疗会议上公布了AK112治疗11例 PD-1 单抗不敏感或接受过 PD-1单抗的实体瘤患者, ORR达到 36%, DCR为 64%。
KN046
KN046是康宁杰瑞自主研发的PD-L1/CTLA-4双特异性抗体。
2020年9月3日,获美国FDA授予孤儿药资格,用于治疗胸腺上皮肿瘤。
2020年8月,KN046在中国获得一项临床试验默示许可,拟开发适应症为:联合甲苯磺酸多纳非尼片用于晚期消化道实体瘤的治疗。同时,其联合含铂化疗针对Ⅳ期鳞状非小细胞肺癌的临床研究已正式进入Ⅲ期试验阶段,该研究将用于KN046在中国的新药上市申报。
2020年12月23日康宁杰瑞宣布,公司自主研发的抗HER2双特异性抗体KN026与PD-L1/CTLA-4双特异性单域抗体KN046联合疗法获美国FDA授予孤儿药资格,用于治疗HER2阳性或HER2低表达胃癌及胃食管连接部癌(GC/GEJ)。
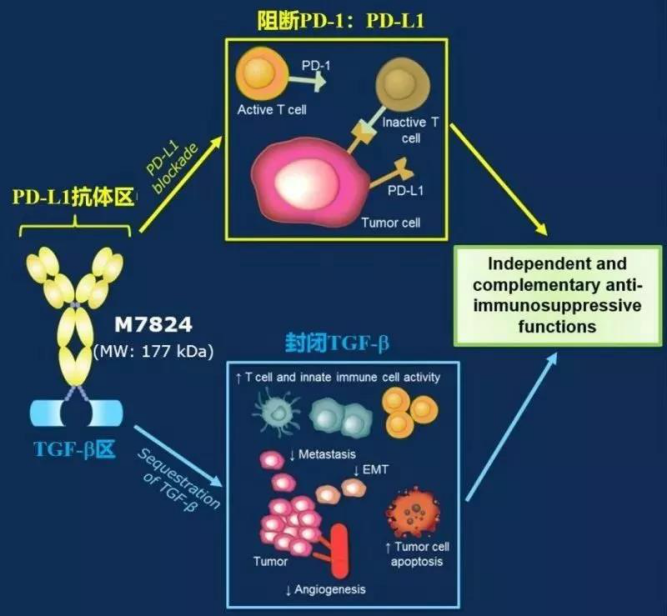
M7824
bintrafusp alfa(M7824)由Merck自主开发,是一种双功能的融合蛋白,为PDL1/TGF-β双抗,由两个部分构成的。一端是能够识别结合PD-L1的抗体结构(Y),类似于T药、B药、I药等已经上市的PD-L1抗体;另一端是可以结合TGF-β的TGF-β受体II型融合蛋白(Trap),可以捕获TGF-β,从而减少肿瘤组织及其周围促癌的TGF-β。
在2018年ASCO,M7824二线治疗晚期NSCLC的结果公布,PD-L1阳性患者群体(PD-L1>1%)的总体缓解率ORR达到了40.7%(n=11/27)。在PD-L1高表达 (PD-L1>80%)患者的ORR更是高达71.4%(n=5/7)!
M7824在2线疗法治疗NSCLC的ORR达到86%,创下史上免疫单药疗效新高!
基于初期研究结果,对M7824的期待很高,但是2021年1月20日,美通社(PR Newswire)发布:M7824一线治疗PD-L1高表达IV期非小细胞肺癌(NSCLC)Ⅲ期研究提前终止,分析显示无法击败默沙东的PD-1抗体K药,该研究不太可能达到 PFS 共同主要终点。
2018年12月,FDA授予M7824治疗胆管癌的孤儿药资格认定,获批基于同年10月ESMO大会上公布的M7824治疗胆管癌的最初数据:在接受铂类一线治疗后病情依然发展的亚洲患者中的临床活性。通过IRC评估,全部30名患者的ORR为20%,并且在PD-L1水平上观察到对治疗的响应,响应持续时间为8.3个月至13.9个月以上。2019年更新的数据显示30名患者的ORR为23%,中位PFS为2.6个月,中位OS为12.7个月。但是M7824单药治疗一线化疗失败或不耐受的晚期或转移性BTC患者的II期试验,结果显示,在超过9个月的随访后,独立审查委员会(IRC)根据RECIST v1.1标准判定客观缓解率为10.1% (95%CI, 5.9%-15.8%)。尽管有明显的获益,但该试验没有达到预先设定的阈值。虽然如此,但考虑到PD-L1单药免疫治疗BTC的ORR为5.8%左右,M7824作为二线治疗的单药临床活性仍然让人鼓舞。
IBI318
IBI318是由信达生物和礼来制药集团共同研发的PD-1/PD-L1双抗,在2020的ASCO年会上,信达生物制药公布了IBI318在治疗晚期恶性肿瘤的Ⅰa期临床试验中的表现。结果显示,IBI318有很好的耐受性,0.3mg到300mg的治疗组在没有发现剂量限制性毒性(DLT)。其中11个患者出现发热和输液相关的反应(20.0%, G1/2),在300mg治疗组有一个患者出现免疫相关性不良事件(G2关节炎)。在9个接受≥10mg用药量患者中,有3个患者具有部分响应。
Amivantamab
2021年5月,FDA加速批准强生公司研发生产的EGFR/c-Met双抗Rybrevant (amivantamab-vmjw,JNJ-6732) 上市,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。这是FDA批准的首个针对该类突变的药物。
Amivantamab(JNJ-61186372)是靶向EGFR和cMet的双特异抗体,属于EGFR和MET双靶的单抗静脉输注型药物,与既往的EGFR口服TKI决然不同。该双抗采用1+1的非对称形式(IgG1),抗体的一个Fab结合cMet靶点,另外一个Fab结合EGFR靶点。带有两个单点突变的抗体先分别在两个细胞株中进行生产,并进行纯化。纯化后的两个单克隆抗体在体外按照一定比例混合,经过还原和氧化处理形成异源二聚体双特异抗体,且具有ADCC效应。

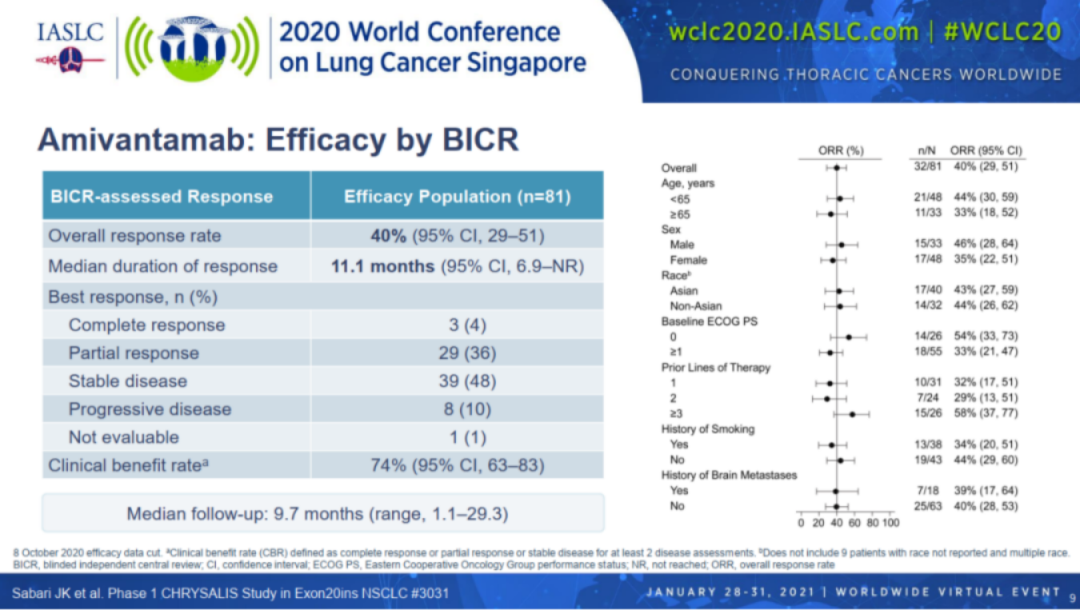
该批准是基于2020年WCLC会议上更新的Ⅰ期CHRYSALIS研究中amivantamab单药疗法队列的阳性结果,该研究共纳入81例既往接受过一线铂类化疗的EGFR 20ins的肺癌患者,疾病进展后均接受Amivantamab治疗。体重<80kg的患者接受1050 mg剂量,体重≥80 kg患者的剂量为1400 mg。
中位随访9.7个月后, ORR为40%,其中完全缓解率CR为4%,部分缓解率PR为36%,中位缓解时间DoR为11.1个月。临床获益率(定义为在至少两次疾病评估中完全或部分缓解或疾病稳定)为74%。而20ins使用目前上市的1-3代TKI来说,疗效非常有限,10%以下。目前,Amivantamab联合化疗(培美曲塞+卡铂)一线治疗EGFR 20ins的NSCLC的Ⅲ期研究PAPILLON(NCT04538664)正在进行,这是Amivantamab一线挑战EGFR 20ins标准化疗的大型开放标签、随机对照的Ⅲ期研究。
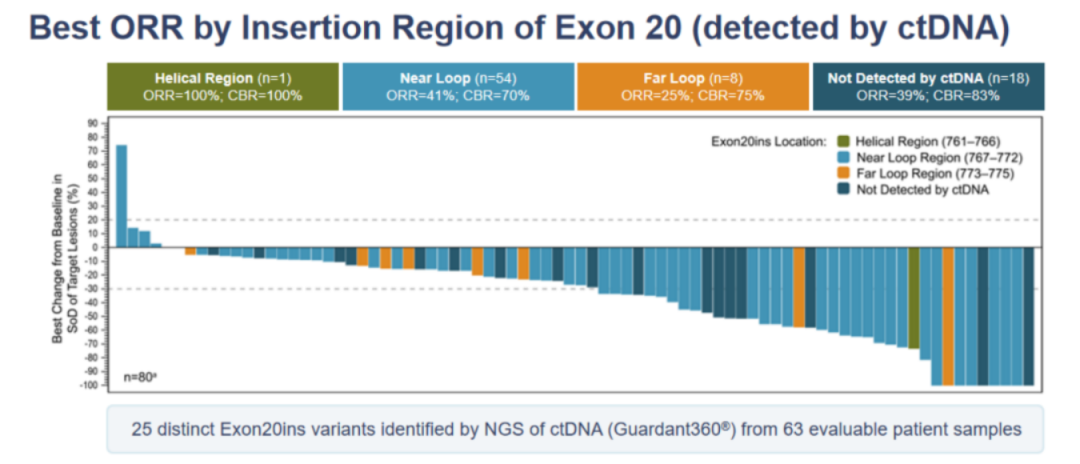
进一步分析显示,ctDNA或具有一定的疗效预测作用,Amivantamab对不同插入区域EGFR 20ins均被证实有效。其中Helical Region(n=1)ORR高达100%;Near Loop (n=54) ORR为41%;Far Loop(n=8) ORR为25%。
Blinatumomab
Blinatumomab是一种靶向CD19 / CD3的双特异性抗体,FDA批准用于B细胞急性淋巴细胞白血病,即使面对淋巴减少或免疫缺陷也能有效。多种类似或类似的结构正在研究各种实体肿瘤。当BiTEs激活T细胞时,其他基于mab的结构结合并激活其他效应细胞,如NK细胞(所谓的BiKEs),也可以通过工程结合细胞因子(所谓的TriKEs)。
Tebentafusp
tebentafusp是一种新型双特异性蛋白,由可溶性TCR与抗CD3免疫效应器结构域融合而成。tebentafusp被设计成专门靶向gp100,这是一种在黑色素细胞和黑色素瘤中表达的谱系抗原。tebentafusp是使用Immucore公司ImmTAC技术平台开发的第一个分子,旨在重新定向和激活T细胞以识别和杀死肿瘤细胞。tebentafusp已被美国FDA授予治疗转移性葡萄膜黑色素瘤(mUM)的突破性药物资格(BTD)、快速通道资格(FTD)和孤儿药资格(ODD),并在英国早期获药计划(EAMS)下被授予突破性创新药资格(PIM)。2022年又被批准用于治疗HLA-A*02:01阳性不可切除性或转移性葡萄膜黑色素瘤(mUM)成人患者。
Mosunetuzumab
Mosunetuzumab是一款双特异性抗体,可以靶向B细胞表面CD20与T细胞表面CD3。这种双靶向特性可以激活和重新定向患者T细胞,接触并向B细胞释放细胞毒性蛋白。

该药物于2022年6月在欧盟获批上市,用于治疗至少接受过2种系统治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。
10
glofitama
今年1月,罗氏的CD3/CD20双抗glofitamab在华申报上市并被纳入拟优先审评名单,拟用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤(DLBCL)和原发性纵隔大B细胞淋巴瘤成人患者。同日,罗氏宣布glofitamab用于治疗DLBCL的生物制品许可申请 (BLA)获FDA优先审评,PDUFA日期定为2023年7月1日。
Teclistamab
2022年,美国FDA加速批准了强生的BCMA/CD3双抗Teclistamab上市,用于治疗先前接受过4线或多线治疗(包括蛋白酶体抑制剂、免疫调节剂、抗CD38单抗)的复发或难治性(R/R)多发性骨髓瘤(MM)成人患者。值得一提的是,Teclistamab是首个获批用于治疗MM的双特异性抗体疗法。
Teclistamab此次批准基于关键Ⅰ/Ⅱ期MajesTEC-1研究的结果。这项开放标签、多中心的临床试验共纳入既往接受过多种方案治疗的R/R MM患者165例,中位5线经治,76%为三重耐药(蛋白酶体抑制剂、免疫调节剂、抗CD38单抗)。结果显示,Teclistamab治疗的ORR为63.0%。中位DoR为18.4个月,中位PFS为11.3个月。

据统计,截至2022年12月,全球临床Ⅲ期的试验项目共约有436项,包括的靶点有:CD3、VEGF、VNGPT2、F10、激活型凝血因子IX、VEGFR、CD19、PGF、GR、TNF-α、COX-2、IL-6、CRBN、Bcr-Abl、VEGF、c-Met/HGFR、DHFR、BCMA、DLL4等。虽然目前上市的双抗并不多,但双抗有望成为肿瘤治疗的下一个风口,我们也期待更多双抗药物为肿瘤患者带来更好的治疗!
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言