卫计委临检中心李金明Science权威解读!我国NGS诊断检测的监管之路
2017-01-19 佚名 生物探索
近日,卫计委临床检验中心李金明副主任和张瑞博士在Science增刊中撰文解读了中国NGS诊断检测的政策。中国政府已经启动了NGS临床检测的监管工作,也在尽最大地努力使NGS诊断检测标准化。在确保安全和有效性的同时寻求合适的方法,保证该领域的创新性,支持精准医疗的发展和进步。本文综述了我国NGS诊断检测的监管历程、体系以及挑战。 过去十年中,NGS技术的快速发展促使DNA测序变
近日,卫计委临床检验中心李金明副主任和张瑞博士在Science增刊中撰文解读了中国NGS诊断检测的政策。中国政府已经启动了NGS临床检测的监管工作,也在尽最大地努力使NGS诊断检测标准化。在确保安全和有效性的同时寻求合适的方法,保证该领域的创新性,支持精准医疗的发展和进步。本文综述了我国NGS诊断检测的监管历程、体系以及挑战。

过去十年中,NGS技术的快速发展促使DNA测序变得越来越快捷,价格越来越低廉。NGS技术如今已经迅速被广泛用于常规临床实践中,包括实体瘤、恶性血液病、遗传病和传染病的分析以及无创产前诊断(NIPT)、胚胎植入前遗传学诊断(PGD)和植入前遗传学筛查(PGS)。
考虑到NGS技术在临床中越来越广泛的应用,中国国家食品药品监督管理总局(CFDA)和国家卫生和计划生育委员会(NHFPC)于2014年停止了临床NGS试验[1],并发布了一系列针对NGS的监管要求。
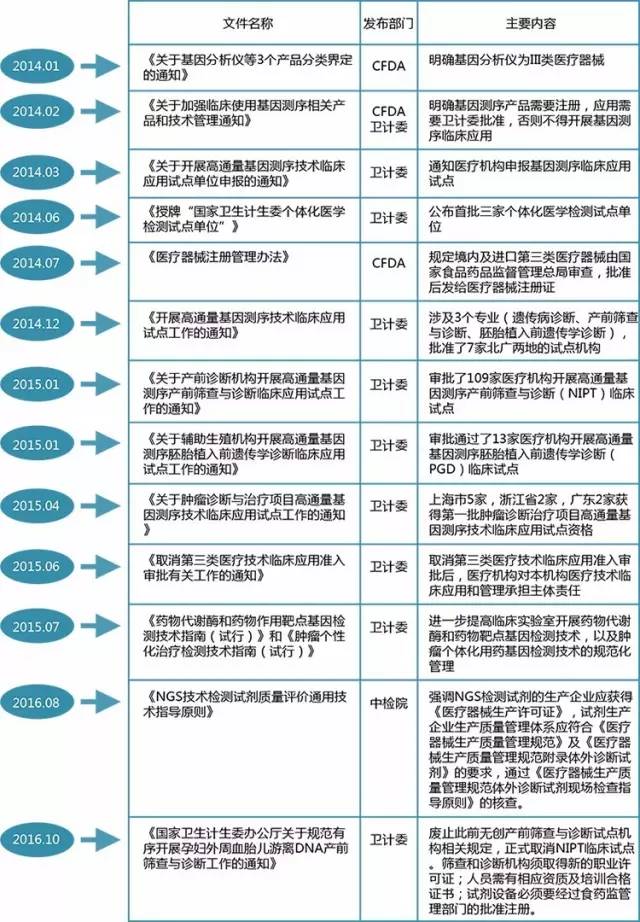
1我国NGS诊断检测的监管历程
2014年以前,我国基因测序行业处于无监管状态,2014年2月,国家食品药品监督管理局(CFDA)和国家卫生和计划生育委员会(NHFPC)叫停了所有的NGS业务,对行业进行集中整顿,推出了一系列的NGS监管政策。
2我国NGS诊断检测的监管体系
目前,整个基因测序行业涉及细分产业众多,包括商业公司、临检中心、医院、仪器试剂、不同的技术平台等,所以涉及的监管部门也比较多,主要包括中央和各地区发改委(简称“发改委”)、卫生和计划生育委员会(简称“卫计委”)和国家食品药品监督管理总局(简称“CFDA”)。
发改委的宏观规划
发改委从宏观上制定测序产业的发展规划。2015年6月,发改委发布了《国家发展改革委关于实施新兴产业重大工程包的通知》,提到要重点发展基因检测等新型医疗技术,并将在3年时间内建设30个基因检测技术应用示范中心,快速推进基因检测临床应用以及基因检测仪器试剂的国产化;此外,地方发改委还参与NIPT等项目的定价。
CFDA的监督管理
CFDA主要是对测序链上的仪器、试剂、分析软件进行监管。CFDA要求NGS商业诊断系统中的所有仪器、试剂、打包卖给实验室的软件在进入临床应用前必须获得批准。2014年1月,CFDA发布了《食品药品监管总局办公厅关于基因分析仪等三个产品分类界定的通知》,规定将基因分析仪作为三类医疗器械进行管理;2014年2月,CFDA和卫计委联合发布通知明确指出,基因测序产品需经CFDA审批注册。
卫计委的审查和规范
卫计委主要是对开展基因测序机构的资质进行审查和规范,具体由三个部分监管,分别是医政医改局、妇幼司和临检中心。
卫计委医政医改局和妇幼司相继批准了全国各省市(除西藏)159家临床试点进行无创产前基因测序、胚胎植入前遗传学诊断、遗传病诊断和肿瘤诊断与治疗等4个专业的高通量测序服务,颁布了《药物代谢酶和药物作用靶点基因检测技术指南(试行)》,《肿瘤个体化治疗检测技术指南(试行)》等规范。临检中心的职责是承担临床检验质量管理与控制工作,运行全国临床检验室间质量评价计划,建立、应用临床检验参考系统,对开展基因检测服务的医学实验室进行评估和验收。
试点实验室必须依据卫计委临检中心管理文件《医疗机构临床基因扩增检验实验室管理办法》获得政府批准,基于NGS技术的所有临床检测必须遵循文件中的相关规定。实验室应该建立标准操作程序(SOP)、遵守所有的质控(QC)标准、记录每个检测的性能。按照SOP和QC标准,NGS流程应该在每个实验室中达到预期运行特性。内部质控和外部质控评估(EQA)对于实验室评估NGS结果也是必不可少的。
3我国NGS诊断监管面临的挑战
随着NGS技术的广泛应用,临床实验室可利用疾病靶基因panel、外显子测序以及全基因组测序进行分析。与传统的分子检测不同,NGS检测的监管面临着若干挑战,临检中心李金明副主任在Science增刊中总结了以下几点。
对于CFDA而言,NGS检测需要创新的方法来确保分析和临床的有效性。
首先,与传统的方法利用单个或一定量因素来诊断单个或一些疾病不同,NGS检测能够识别人类基因组中的大量变体,因此有效分析每一个变体几乎是不切实际的。虽然评价具有代表性的突变类型或许是一种有效的方法来证明NGS平台的性能,但需要时间来建立不同临床领域NGS检测的评价新指标。
第二,NGS检测不仅识别出有临床意义的变体,也能识别大量意义不明确的变体。因此不同的变体的临床验证应有不同的要求。
第三,NGS检测的预期用途是针对特定病人群体、药物或疾病。根据美国国家癌症研究所MATCH项目,治疗试剂的选择应该基于NGS靶向分析所得的具体分子结果,而不是癌症类型。随着临床研究的快速发展,CFDA必须重新考虑审批流程以扩大获批试剂的预期应用。
NGS技术的出现同样给卫计委也带来了挑战。虽然试点实验室需要依据《医疗机构临床基因扩增检验实验室管理办法》来开展NGS检测,由于NGS临床检测比传统分子检测复杂得多,因而迫切需要制定新的监管标准。
近年来,美国疾病控制与预防中心、美国医学遗传学学会和美国病理学家学会针对NGS方法的有效验证、分析过程监控和变异报告制定了指南。然而,将这些要求转化为常规对实验室而言仍是一个挑战。
4我国NGS诊断检测的应用现状
经历了“无监管——叫停——监管”,当前我国NGS诊断检测的应用现状如何?哪些NGS产品获得了国家批准?检测实验室水平如何?李金明副主任在Science增刊中解析了这些问题。
2014年6月30日,CFDA批准了首个NGS诊断产品——BGISEQ1000和BGISEQ100,主要用于检测胎儿染色体非整倍体(21、18、13三体)。在中国,NIPT已经成NGS应用最为成熟的领域,且多个临床验证结果也证实了它的高灵敏度、特异性和阴性预测值。
到目前为止,有5款NGS测序仪获得了CFDA的批准,分别为华大基因的BGISEQ-100、 BGISEQ-1000、贝瑞和康的NextSeq CN500,达安基因的DA8600以及博奥生物的BioelectronSeq 4000,同时CFDA批准了与这些仪器配套的NIPT检测。然而,目前在其他临床领域如肿瘤相关的遗传突变检测、遗传评估和PGD/PGS,还没有获批的商业化NGS产品。
2014年4月,卫计委推出了试点项目,并向NGS实验室授予许可资质。目前,已经有9家实验室获批开展NIPT检测,6家获批开展PGD/PGS检测,26家获批开展肿瘤检测,18家获批开展遗传病检测。
为了评估NGS检测的实验室水平,2014年,卫计委临检中心推出了基于大规模并行测序的21、18、13三体检测的试验室间质评项目。评估结果表明,大多数参与的实验室都采用获得CFDA批准的试剂,并且为NIPT提供了可靠的诊断能力。
2015年,卫计委临检中心在全国范围内开展了试验室间质评工作,评估了NGS技术检测体细胞突变的有效性。参加评估的实验室包括获得国家批准开展肿瘤NGS检测的26家实验室以及以及正在申请NGS检测许可的实验室。这些实验室提供的所有检测均为实验室开发的检测。64家实验室中33家的检测性能达到了标准,但只有17家实验室能正确识别临检中心panel中DNA样本的所有突变。这些结果意味着实验室急需加强肿瘤体细胞突变的NGS检测能力,这与检测过程的复杂性有关。
5小结
近年来,国家对NGS诊断检测的监管不断完善。去年中检院发布了《第二代测序技术检测试剂质量评价通用技术指导原则》,提高了NGS的准入门槛,指导基因检测及NGS的规范、合理应用。同时,我国首部《二代测序(NGS)技术应用于临床肿瘤精准医学诊断的共识》也于去年发布,为二代测序技术应用于临床肿瘤驱动基因分析提供相关指导性建议,并规范临床实践。
参考文献:
1. China Food and Drug Administration, “The Notice of the China Food and Drug Administration and the National Health and Family Planning Commission on the Inspection of Sequencing Diagnostic Tests”; available at www.sda.gov.cn/WS01/CL1105/96853.html (in Chinese).
2. China Food and Drug Administration, “Approval of NextGeneration Sequencing Diagnostic Tests”; available at www.sda.gov.cn/WS01/CL1103/102239.html (in Chinese).
3. R. Zhang et al., J. Mol. Diagn.18, 244–252 (2016).
4. R. Zhang et al., Oncotarget 36, 58500–58515 (2016).
5. J. Abrams et al. Am. Soc. Clin. Oncol. Educ. Book 34, 71–76 (2014).
6. A. S. Gargis et al., Nat. Biotechnol. 30, 1033–1036 (2012).
7. H. L. Rehm et al., Genet. Med. 15, 733–747 (2013).
8. N. Aziz et al., Arch. Pathol. Lab. Med. 139, 481–493 (2015).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#诊断检测#
72
学习了,了解
88
临床发展的新机遇
78
#卫计委#
0
#NGS#
64
#监管#
54
#SCIE#
49
厉害啊!学习了!
82