NUS刘斌最新AM: 具有增强肿瘤渗透能力的智能纳米组装体通过激活近红外荧光和ROS生成实现成像引导的光动力学治疗
2024-05-04 BioMed科技 BioMed科技 发表于上海
新加坡国立大学刘斌教授等人报道了一种新型纳米平台LipoHPM,旨在应对上述挑战。
荧光成像引导的光动力疗法(FIG-PDT)有望改善癌症治疗,但成像质量差、光毒性和抗肿瘤效果不足等挑战依然阻碍着这类技术的进一步发展。在此,新加坡国立大学刘斌教授等人报道了一种新型纳米平台LipoHPM,旨在应对上述挑战。利用聚集引起的猝灭(ACQ)效应,LipoHPM在血液循环过程中可对荧光和活性氧(ROS)的产生保持沉默,并在分解后恢复这两种特性。在荷瘤小鼠中静脉注射后,LipoHPM可主动靶向过表达生物素受体的肿瘤细胞,从而增强其肿瘤积聚能力。在细胞内化后,LipoHPM可在溶酶体内分解,释放肿瘤渗透促进剂肼嗪(HDZ)以增强肿瘤渗透并抑制肿瘤转移。同时,这一胶束也激活了可进行肿瘤成像的荧光,并促进用于肿瘤根除的I型和II型ROS的产生。因此,智能LipoHPM协同集成了近红外发射、可激活的肿瘤成像、强大的ROS生成、高效的抗肿瘤和抗转移活性,成功克服了传统光敏剂的局限性,并有望成为实现有效FIG-PDT的纳米平台。相关工作以“Smart Nanoassembly Enabling Activatable NIR Fluorescence and ROS Generation with Enhanced Tumor Penetration for Imaging-Guided Photodynamic Therapy”为题发表在Advanced Materials。

【文章要点】
如图1所示,作者使用酸敏感的胺接头将生物素修饰的亲水性聚合物(BiotinPEG)与疏水性光敏剂(MBA)连接,通过聚集引起的猝灭(ACQ)效应形成OFF状态的BiotinPEG-MBA(PM)胶束。另一方面,美国食品药品监督管理局批准的用于治疗高血压的药物肼嗪(HDZ)具有扩充血管、减少肿瘤基质的能力,可强化纳米颗粒进入肿瘤内部的渗透行为。因此,作者进一步将这些胶束与HDZ共同负载到pH敏感脂质体(由DOPE/DSPC/OA/Chol/BiotinDSPE-PEG组成)形成LipoHPM。
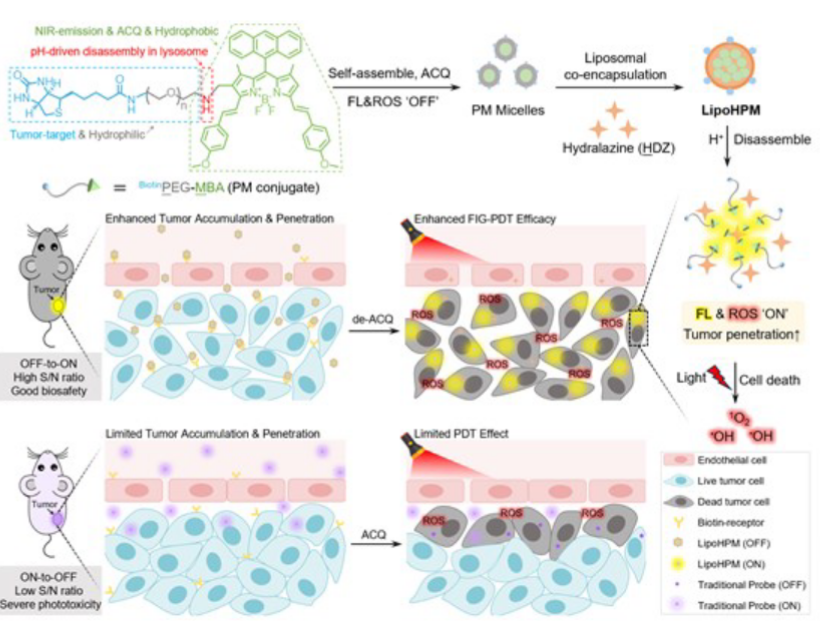
图1 LipoHPM的制备及其体内递送治疗示意图
在荷瘤小鼠中静脉给药后,预猝灭的PM胶束被脂质体外壳很好地保护,在血液循环过程中保持在低背景信号和最小光毒性的OFF状态。随后,LipoHPM通过表达生物素受体,主动靶向并积聚在肿瘤细胞中,有助于增强肿瘤积聚和内化。被肿瘤细胞摄取后,pH敏感的脂质体则可在溶酶体中分解,然后释放包埋的HDZ和PM胶束以发挥其功能。释放后,HDZ放松肿瘤细胞,缓解实体屏障,并提高LipoHPM的肿瘤穿透力。同时,PM胶束经历分解并从溶酶体中逃逸,从而能够以良好的信噪比进行高度特异性的肿瘤成像,并最大限度地提高PDT的疗效(图1)。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202404296
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#LipoHPM# #FIG-PDT# #猝灭#
68