最全综述:HER2变异非小细胞肺癌的分子检测,治疗现状及前景展望
2023-10-30 苏州绘真医学 苏州绘真医学 发表于上海
本综述总结了HER2生物学和HER2过表达、扩增和突变检测,以及从化疗到靶向药物(包括TKI、ADC和研究药物)里程碑式和正在进行的临床试验情况。
HER2突变占非小细胞肺癌(NSCLC)的2-4%,可通过下一代测序(NGS)识别。过去,HER2突变转移性NSCLC的治疗结果令人沮丧,铂类化疗联合或不联合免疫治疗的临床获益有限。与HER2变异乳腺癌和胃癌相比,HER2突变NSCLC不能从曲妥珠单抗或TDM1等HER2靶向药物中获益。HER2突变在本质上不同于HER2过表达和扩增。德曲妥珠单抗是一种靶向HER2的抗体药物偶联物(ADC),是首个也是目前唯一一个获批用于标准治疗失败的HER2突变转移性NSCLC患者的治疗选择。本综述总结了HER2生物学和HER2过表达、扩增和突变检测,以及从化疗到靶向药物(包括TKI、ADC和研究药物)里程碑式和正在进行的临床试验情况。
研究背景
非小细胞肺癌(NSCLC)是一种异质性疾病,由表皮生长因子受体基因(EGFR)、Kirsten大鼠肉瘤病毒基因(KRAS)突变以及间变性淋巴瘤激酶(ALK)和ROS1基因重排等因素驱动。针对这些变异的分子靶向治疗使NSCLC的治疗格局发生了重大变化。
人表皮生长因子受体2,也称为HER2或erbB-2/neu,该癌基因在乳腺癌中得到了大量研究,最近在NSCLC中被识别为治疗靶点。已经描述了几种HER2激活机制,包括基因突变、扩增和过表达。
2004年首次在NSCLC中发现HER2突变,但直到最近,开发有效的抗HER2疗法一直是一个挑战(图1)。2022年8月,基于DESTINY-Lung02的数据,美国FDA加速批准抗体药物偶联物德曲妥珠单抗,是首个获批用于HER2突变NSCLC的靶向药物。
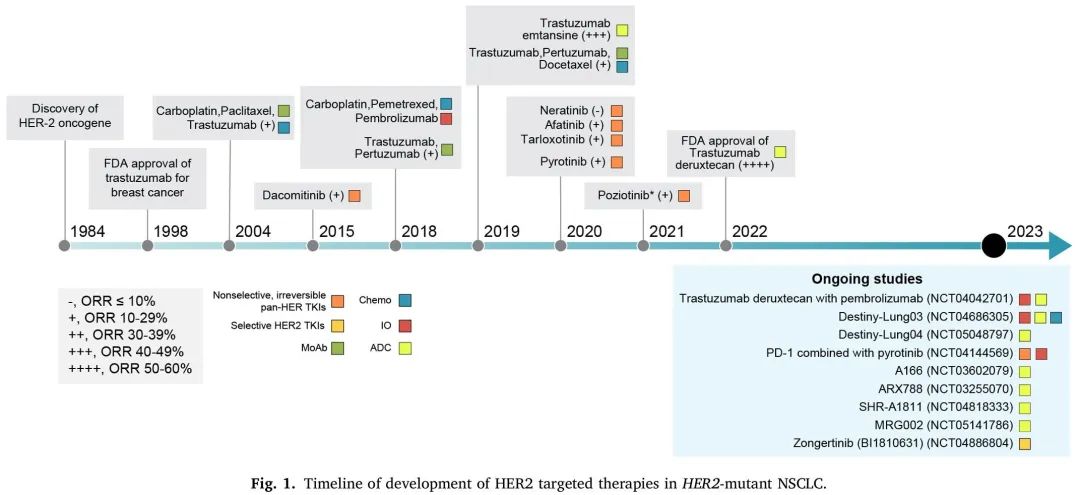
图1. HER2突变NSCLC HER2靶向治疗发展时间线
本综述总结了HER2生物学,包括各种HER2变异及其检测方法,以及HER2突变NSCLC的治疗(图2)。
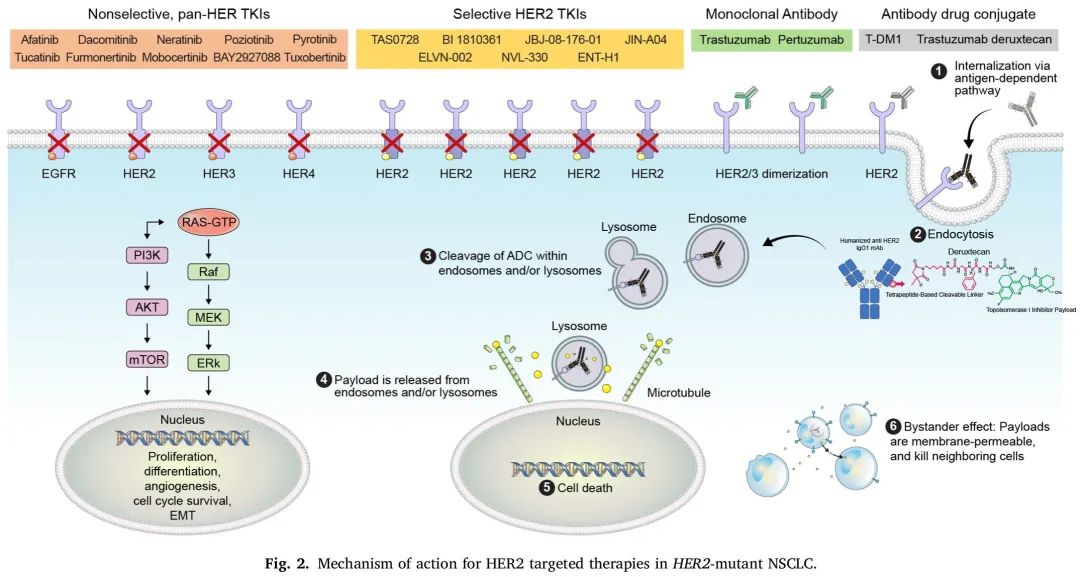
图2. HER2突变NSCLC HER2靶向治疗作用机制
HER2生物学与检测
生物学
1980年代中期发现HER2原癌基因(图1),位于人类17号染色体长臂(17q11.2-q12)。HER2转录本编码185 kDa(kD)的跨膜糖蛋白,属于1型跨膜生长因子受体ErbB家族,其由HER1(ErbB1,EGFR),HER2(ErbB2,HER2/neu),HER3(ErbB3)和HER4(ErbB4)组成。每个受体包括三个主要成分:细胞外配体结合结构域,α-螺旋跨膜片段和细胞内酪氨酸激酶结构域。在生理条件下,配体与其细胞外结构域结合后,可诱导受体形成同源或者异源二聚体,遵循独特的层级顺序,优先异源二聚体而不是同源二聚体。随后细胞内酪氨酸残基转磷酸化启动多种信号通路,包括MAPK,PI3K/AKT,PKC和STAT,导致细胞增殖,分化和迁移。HER2与其家族的所有其他成员表现出显著的结构同源性,但与其他成员不同的是,尚未发现HER2的直接配体。相比之下,HER2保持其活性构象,能够持续二聚化,因此是异二聚化的青睐伙伴。HER2还表现出内化和降解减少,导致细胞膜活化延长。HER3缺乏固有的酪氨酸激酶活性,因此仅限于与其他HER受体形成异二聚体,HER2与HER3结合时,HER2/HER3异二聚体在相互作用强度、配体诱导的酪氨酸磷酸化和下游信号传导方面最强效。
HER2变异
与HER2扩增导致的乳腺癌不同,NSCLC可由HER2基因突变、扩增和过表达激活,这些HER2变异导致下游MAPK、PI3K/Akt、磷脂酶C、蛋白激酶C和Janus激酶(Jak-STAT)信号通路激活。以下将讨论不同的变异及其检测方法。
HER2过表达
发生率从2.4%-38%不等,在分化良好的腺癌中更常见。由于应用方法、研究的患者群体和HER2阳性定义的不同,识别和区分仍存在争议。
潜在的分子发病机制尚不清楚,但细胞表面HER2存在的增加会增加含HER2的异二聚体的形成,从而改变细胞极性和粘附性,并激活上述几种致癌信号通路。过表达的机制归因于染色体重复和多体(HER2基因拷贝数高于5或6,但HER2/CEP17 <2)导致的拷贝数增加。Bunnet等人发现IHC评估的HER2蛋白表达与荧光原位杂交(FISH)评估的HER2基因拷贝数之间存在很强的相关性。在分析的细胞系中,32%为HER2 IHC阳性。有趣的是,FISH经常检测到多体,而不是真正的扩增。因此,在HER2中度或强过表达的情况下,建议进行额外的FISH分析以区分这些可能性。HER2过表达与生存率较低有关,这可能是由于放化疗耐药所致,但结果相互矛盾。
关于肺癌HER2蛋白过表达的评分和分类尚未形成共识,迫切需要通用的定义和检测。在没有特定检测方法的情况下,使用两种IHC评分系统,包括使用0-3+评分和H评分。定量HER2过表达的另一种方法是定量聚合酶链反应(qPCR)或实时定量逆转录聚合酶链反应(qRT-PCR)。
HER2扩增
与乳腺癌相比,NSCLC中HER2扩增的频率较低,但由于缺乏明确的定义和存在两种不同的机制 [作为未接受靶向治疗患者的主要驱动因素(3%)和EGFR-TKI获得性耐药机制(13%)],报道的频率有所不同。
HER2扩增增加了体外NSCLC细胞的侵袭性,独立于配体激活HER2和EGFR。HER2扩增与胸膜侵犯、从不吸烟和女性密切相关,但其预后意义尚不清楚。
HER2扩增的定义来源于乳腺癌诊断,通常定义为HER2基因拷贝数与着丝粒的平均比值(HER2/CEP比值)≥2和/或基因拷贝数>6。必须注意的是,其他阈值也有使用,导致不同研究之间存在差异。此外,由研究提出,调整目前使用的乳腺癌分类,因为可能不适合NSCLC。如前所述,观察到多体,虽然认为其不会驱动肿瘤发生,但其预测或预后价值尚不清楚。
FISH是检测的金标准,建议临床研究或EGFR TKI耐药患者评估HER2扩增。在临床实践中评估HER2扩增的另一种方法是NGS,同样,不同的NGS平台缺乏通用的定义扩增的标准,但NGS可能具有优势,因为可以同时检测数百个基因变异。
HER2突变
HER2突变具有异质性,包括细胞外(ECD)、跨膜(TMD)和酪氨酸激酶结构域(TKD)突变。HER2突变见于2-4%的NSCLC,遗传多样性低,与女性、从不吸烟者、腺癌组织学和脑转移有关。由于缺乏有效的选择性靶向药物,HER2突变NSCLC患者的预后比EGFR突变或ALK重排患者差。
HER2突变主要发生在细胞内酪氨酸激酶结构域(TKD),诱导ATP结合口袋构象变化,从而增加激酶活性以及下游PI3K/AKt和MEK致癌通路诱导。频率最高的突变是外显子20框内插入。密码子775处12个碱基对重复插入——A775_G776insYVMA最常见,其影响激酶结构域αC-B4环,其次是G776delinsVC和G778_P780insGSP。外显子20 YVMA突变与高脑转移发生率和化疗结局较差有关。HER2外显子20插入与EGFR外显子20插入具有结构同源性,影响相同的结构区域:残基770-774处的αC-螺旋和包含残基775-783的环区。与EGFR类似,HER2活性受αC螺旋调节,αC螺旋在非活跃的向外构象和活跃的向内构象之间切换。与野生型HER2信号传导相比,HER2外显子20插入表现出更强的信号转导、EGFR磷酸化、细胞增殖和侵袭性激活。不同的插入具有独特的行为,耐药特征取决于其构象构型(图3和4)。
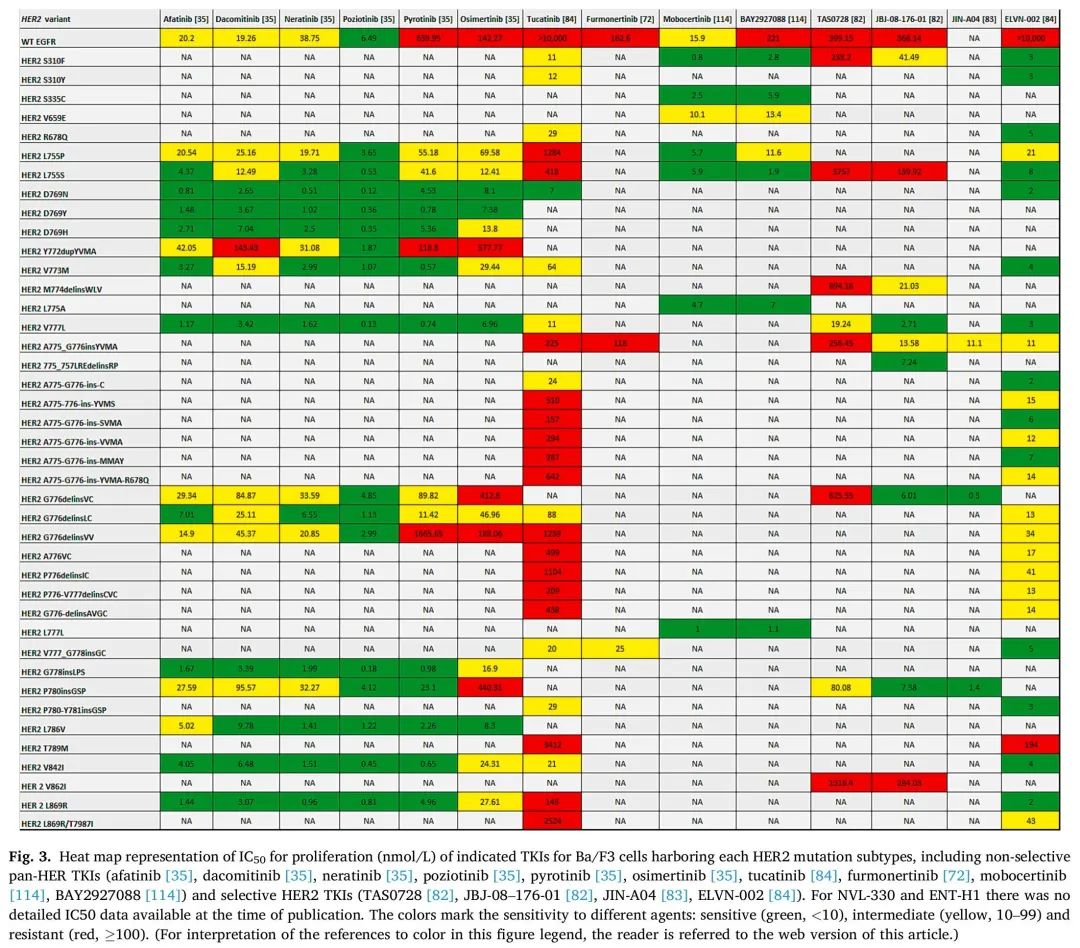
图3. 携带不同HER2突变亚型的Ba/F3细胞TKIs IC50(nmol/L)热图,包括非选择性泛HER TKI(阿法替尼、达可替尼、奈拉替尼、波齐替尼、吡咯替尼、奥希替尼、图卡替尼、伏美替尼、莫博赛替尼、BAY2927088)和选择性HER2 TKI(TAS0728、JBJ-08-176-01、JIN-A04、ELVN-002)。对于NVL-330和ENT-H1,在发表时没有详细的IC50数据。颜色标记了对不同药物的敏感性:敏感(绿色,<10)、中等(黄色,10–99)和耐药(红色,≥100)。
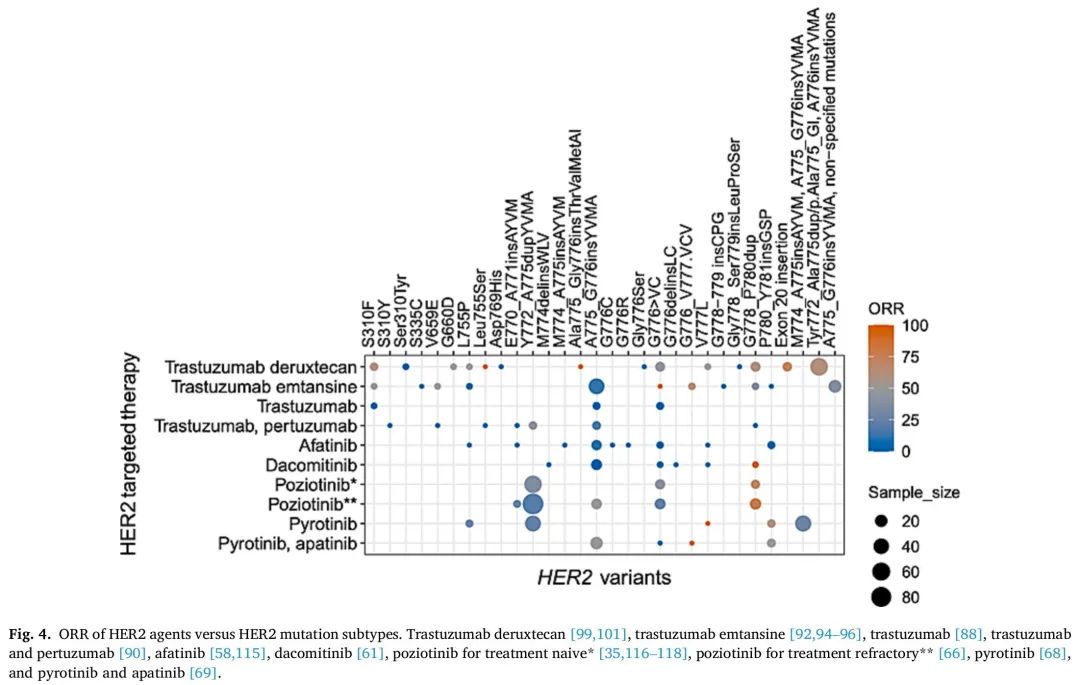
图4. HER2抑制剂对HER2突变亚型的ORR。德曲妥珠单抗、恩美曲妥珠单抗、曲妥珠单抗、曲妥珠单抗和帕妥珠单抗、阿法替尼、达可替尼、波齐替尼用于初治*、波齐替尼用于难治性**、吡咯替尼以及吡咯替尼和阿帕替尼。
更多涉及TKD的点突变发生率较低,最近报道了一些不太常见的跨膜和并列膜结构域(G660D、R678Q、E693K和Q709L)突变,这些突变可靶向。
尽管既往研究提出HER2突变与其他致癌驱动突变相互排斥,但NGS的广泛使用揭示了EGFR突变、ALK易位和ROS易位的共存。虽然大多数研究没有详细说明既往靶向治疗的使用,但一小部分HER2突变被描述为EGFR TKI原发性或获得性耐药的可能机制。
如前所述,通过FISH或IHC染色检测的HER2过表达不是HER2突变的可靠替代标志物。尽管RT-PCR等靶向检测具有高度特异性,但其能力有限,仅检测已知且研究较多的基因变异,可能遗漏不太常见的变异。因此,测序方法仍然是检测HER2突变的金标准。
HER2突变NSCLC的基因图谱和肿瘤微环境
HER2外显子20插入NSCLC全外显子组测序显示,肿瘤突变负荷(TMB)低,共突变少,结果与EGFR突变NSCLC相似。其他非外显子20插入HER2突变表现出与EGFR野生型NSCLC相似的特征,具有相对较高的TMB、共突变和吸烟突变特征。识别了TP53和PIK3CA等突变与HER2突变共存。
HER2突变NSCLC具有非炎性TME,与较低的PD-L1高表达率和较低的中位肿瘤突变负荷(TMB)相关。HER2外显子20突变NSCLC表达低水平的成熟NK细胞,上调TNFSF4(OX-40)和CXCR4。临床前研究表明,HER2变异NSCLC抑制调节先天免疫机制的cCAS-STING通路,阻止TBK1-STING信号传导。综上所述,这些特征导致HER2突变NSCLC的免疫冷环境。
治 疗
化疗
一线接受基于培美曲塞的化疗的HER2突变NSCLC患者,客观缓解率(ORR)为36%,PFS为5.1个月,与KRAS突变组和EGFR突变组相似(PFS分别为5.0个月和6.5个月),但明显短于ALK/ROS1重排组(PFS为9.2个月)(p = 0.004)。在各HER2突变亚型中,与其他突变相比,A775_G776insYVMA组的PFS有较差的趋势(4.2 vs 7.2个月,p=0.085)。
几项II期研究报告了化疗联合HER2靶向药物的疗效(表1)。治疗耐受性良好,结果与单独化疗一致。类似地,一项随机2期研究评估了在HER2阳性NSCLC患者中,在顺铂和吉西他滨的基础上加用曲妥珠单抗,无明显的临床获益。在HER2过表达(3+)的NSCLC亚群中,ORR为25%,但鉴于样本量小,应谨慎看待这些结果。
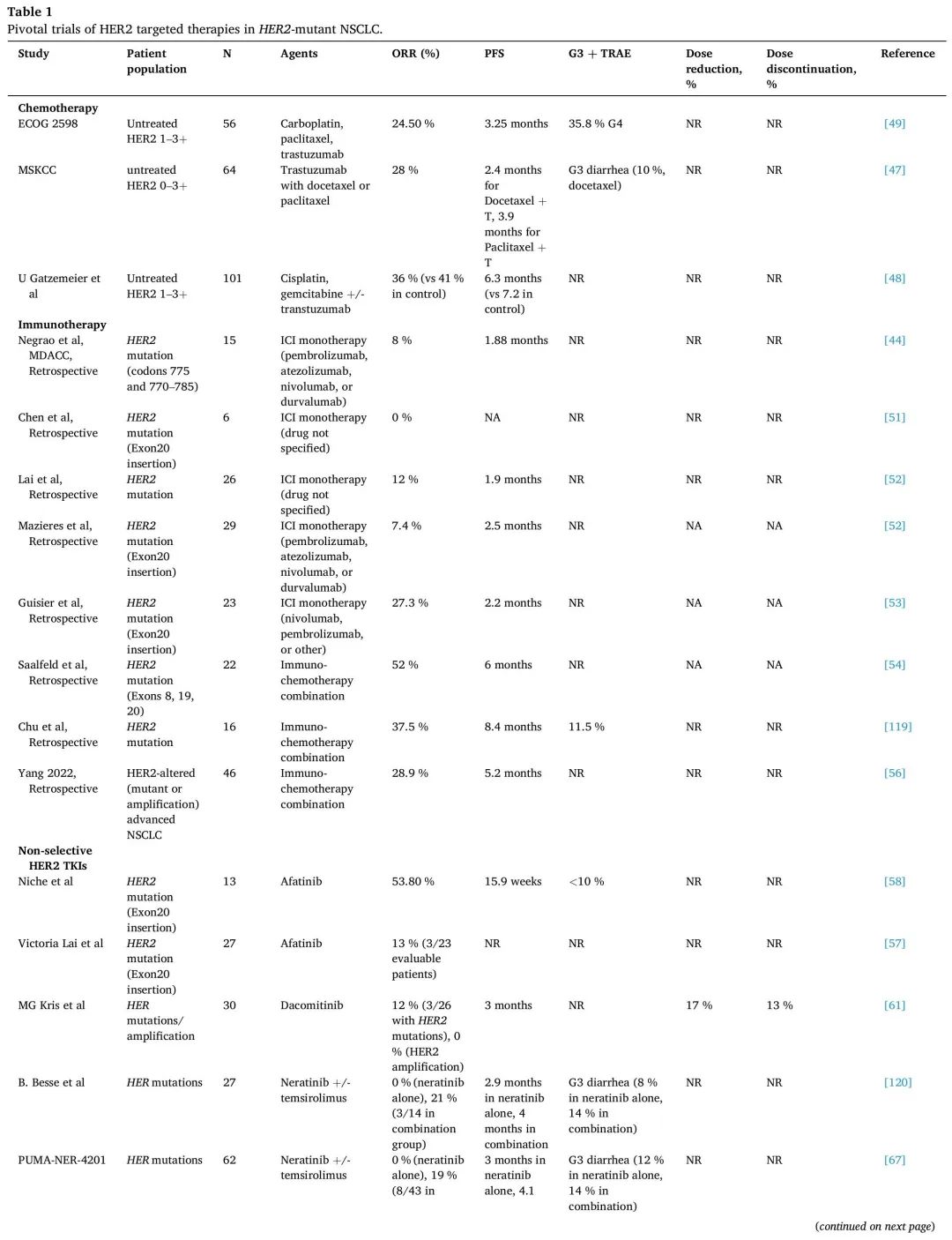
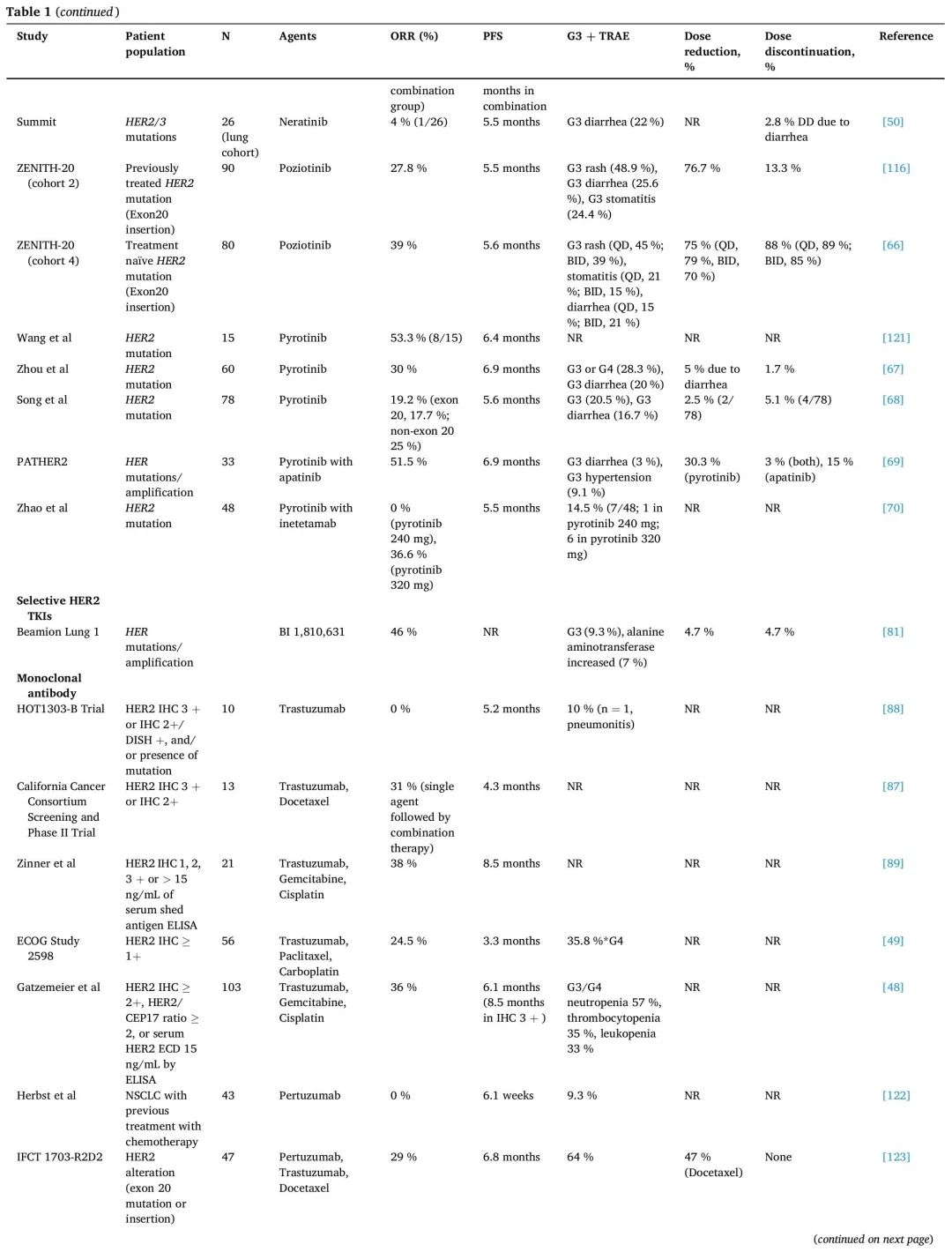
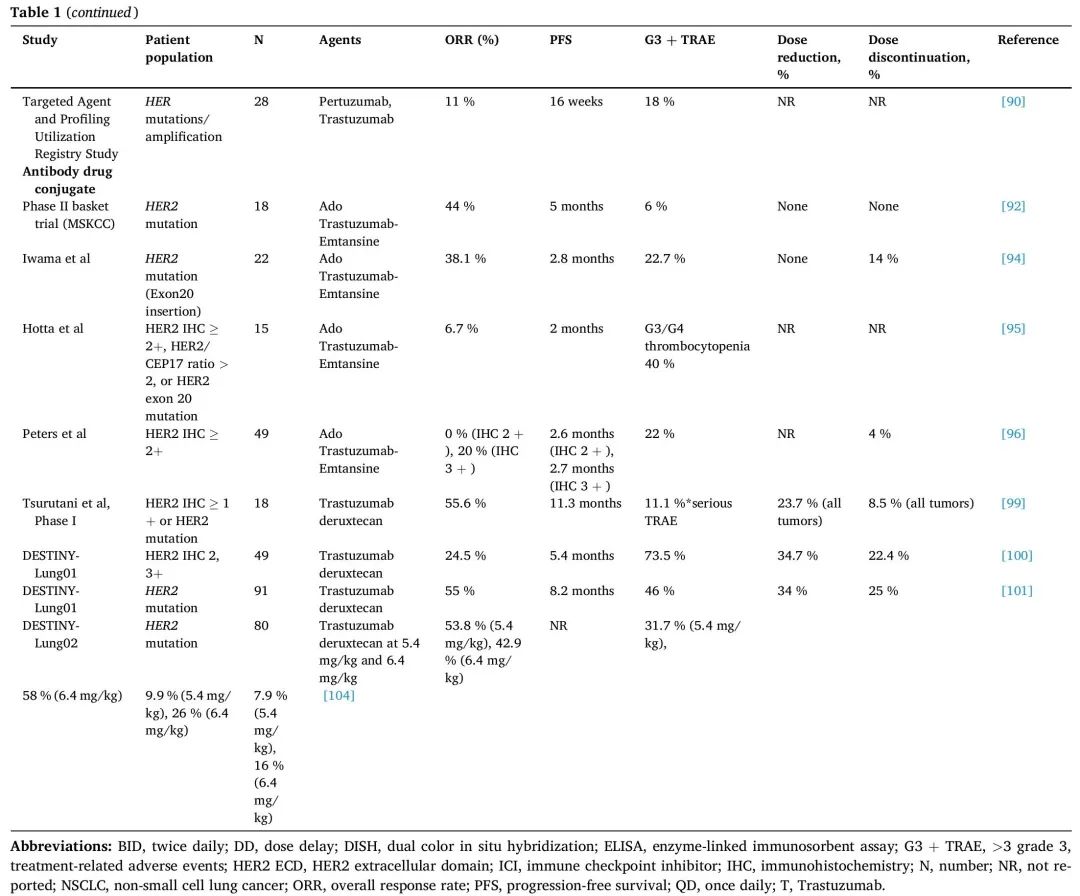
表1. HER2突变NSCLC HER2靶向治疗关键试验
免疫治疗
ICI治疗已成为非癌基因驱动NSCLC治疗的关键组成部分,而其在癌基因驱动NSCLC(如HER2突变NSCLC)中的作用尚不确定。ICI单药治疗的最好疗效似乎中等,ORR为0-27.3%,PFS为1.88-2.5个月。IMMUNOTARGET数据库报告的ORR为7.4%,PFS为2.5个月,法国肺癌组织报告的ORR为27.3%,中位PFS为2.2个月。
一项一线ICI联合化疗的回顾性研究显示,ORR为52%,中位PFS为6个月,结果与KEYNOTE-189中未经选择的NSCLC队列相似。另一项回顾性研究报告ORR为28.9%,中位PFS为5.2个月。虽然与单独化疗相比,ORR较高,但中位PFS改善无统计学意义(5.2 vs 4.03个月,p=0.20)。
总体而言,目前的证据不支持ICI作为单药用于治疗HER2变异NSCLC。免疫联合化疗尽管支持证据有限,仍然是可行的一线治疗选择。
靶向HER2的TKI
非选择性HER2抑制剂
非选择性HER2抑制剂包括泛HER酪氨酸激酶抑制剂(TKI):阿法替尼、达可替尼、奈拉替尼、波齐替尼(poziotinib)、吡咯替尼、图卡替尼(tucatinib)、伏美替尼、莫博赛替尼、BAY2927088、tarloxotinib和tuxobertinib(图2,3)。
阿法替尼
阿法替尼是一种不可逆的泛HER TKI,临床活性中等,部分缓解(PR)率为13%-19%。阿法替尼用于经治HER2外显子20突变患者的单臂2期研究(ETOP NICHE)显示,ORR为0%,该研究因未达到预定疗效阈值而停止。
对阿法替尼的反应可能因HER2突变亚型而异(图4)。最常见的亚型是p.A775_G776insYVMA,占HER2突变的高达42%,该亚型对阿法替尼耐药。阿法替尼在p.G776delinsVC、p.Y772_A775dup和p.G778_P780dup等非YVMA亚型中的活性可能高于其他HER2突变亚型,ORR更高(50% vs 0%,p = 0.077),PFS更长(9.53 vs 1.8个月,p = 0.057)。TP53共突变和PI3K/AKT/mTOR通路激活也可能增加对阿法替尼的耐药性。
达可替尼
达可替尼是一种不可逆的泛HER TKI,一项达可替尼2期试验显示,HER2突变的患者PR率为12%,HER2扩增患者的PR率为0%。在常见的YVMA亚型中未见缓解。达可替尼的IC50在携带YVMA插入的Ba/F3细胞中较高,在携带GSP插入、WLV插入和CPG插入的HER2亚型中较低(图3)。
奈拉替尼
奈拉替尼是一种不可逆的泛HER TKI,II期篮子试验SUMMIT评估了其用于具有HER2或HER3突变的多种癌症类型。在26例NSCLC患者中,仅有1例激酶结构域错义突变(L755S)患者达到PR。
一项随机II期研究探索了奈拉替尼联合或不联合替西罗莫司用于HER2突变晚期NSCLC患者,联合治疗组的ORR为19%,单用奈拉替尼的患者无缓解。
非选择性HER2-TKI的疗效令人失望,尽管在某些HER2突变亚型中报告了一些反应,这可能可以通过药物结合亲和力的差异来解释。例如,YVMA插入的3D建模显示存在两条庞大的侧链,导致空间位阻,从而影响阿法替尼与结合口袋的结合。对达可替尼敏感的HER2突变亚型C螺旋末端以外的两个残基位置含有甘氨酸,而不是野生型EGFR中的Asp770。甘氨酸的存在可减少野生型Asp 770和获得性HER2外显子20插入患者中可能发生的空间位阻,促进C-螺旋构象改变,允许药物结合。鉴于这些挑战,已经开发了其他新型泛HER2 TKI。
波齐替尼
波齐替尼是一种不可逆的泛HER TKI。II期ZENITH-20研究报道,在既往接受过治疗的HER2外显子20插入突变NSCLC患者中,ORR为27.8%,中位PFS为5.5个月。3级或以上治疗相关不良事件(TRAEs)包括皮疹(48.9%),腹泻(25.6%)和口腔炎(24.4%),77%患者的剂量减少。由于波齐替尼的益处未超过其毒性,未获FDA批准,波齐替尼开发的优先级随后降低。
最近有研究报道了波齐替尼16mg QD和8mg BID对初治HER2突变患者的活性。研究了BID剂量,因为可以降低Cmax并维持Ctrough和总体药物暴露,可能降低毒性。ORR为39%(QD 45% vs BID 30%),DCR为73%(QD 75% vs BID 70%),中位PFS为5.6个月(QD 5.6 vs BID 5.6)。G778_P780dupGSP亚型对波齐替尼特别敏感,ORR为71%。最常见的3级TRAE是皮疹(43%),QD组为45%,BID组为39%。其他3级TRAE包括口腔炎(总体:19%;QD:21 %;BID:15%),腹泻(总体:18%;QD:15 %;BID:21%)和5级肺炎(QD组1例),导致5%(4/80)的患者停止治疗。
吡咯替尼
吡咯替尼是一种不可逆的泛HER TKI。一项吡咯替尼用于经治HER2突变NSCLC患者的II期研究显示,ORR为30%(95% CI,18.8-43.2%)。A775_G776insYVMA和M774_A775insAYVM合计的ORR为27%(图4)。总体人群的mPFS为6.9个月(95% CI,5.5-8.3),mOS为14.4个月(95% CI,12.3-21.3)。最常见的TRAE是3级腹泻(20%)。初治患者的ORR和PFS分别为19.2%和5.6个月。A755_G776insYVMA和G776_V777.VCV的ORR分别为50%和100%。III期试验Pyramid-1 正在评估吡咯替尼vs多西他赛在铂类化疗失败的HER2外显子20突变NSCLC患者中的疗效(NCT04447118)。
有研究探索了吡咯替尼与阿帕替尼和伊尼妥单抗联合使用。吡咯替尼联合血管内皮生长因子受体2(VEGFR2)TKI阿帕替尼的2期研究PATHER2报道了ORR为51.5%(95% CI,33.5-69.2%),mPFS为6.9个月,mOS为14.8个月。一项IB期研究评估了重组人源化抗HER2单克隆抗体伊尼妥单抗治疗HER2突变NSCLC。没有DLT,不良事件主要是1-2级腹泻,皮疹和呕吐。初步疗效报告了ORR,中位PFS为5.5个月。
图卡替尼
图卡替尼是一种可逆的泛HER TKI,最近获得FDA批准,与曲妥珠单抗联合用于治疗HER2阳性转移性结直肠癌。II期篮子试验正在评估该联合疗法在NSCLC中的疗效(NCT04579380)。
伏美替尼
伏美替尼(AST5902)是一种不可逆、高度脑渗透性的泛EGFR抑制剂,对HER2外显子20插入突变具有活性。目前,I期临床试验(NCT05364073)正在评估伏美替尼的有效性和安全性。
莫博赛替尼
莫博赛替尼(TAK-788)是一种不可逆TKI,靶向EGFR和HER2外显子20插入突变,于2021年获得FDA批准,用于EGFR外显子20插入突变NSCLC的二线治疗。在体外和小鼠模型中,用于HER2突变NSCLC的临床前数据显示出有希望的结果,对特定突变的活性不同。目前,尚无关于莫博赛替尼治疗HER2外显子20插入突变NSCLC的已发表的临床研究。
BAY2927088
BAY2927088是一种可逆的、高效的TKI,靶向EGFR和HER2驱动突变。临床前,用于NSCLC EGFR ex20ins和C797S突变,表现出显著的剂量依赖性体内肿瘤生长抑制。纳入了HER2突变肺癌患者的1期试验正在进行中(NCT05099172)。
Tarloxotinib
Tarloxotinib是泛HER激酶抑制剂的低氧激活前药。II期RAIN-701研究的首次分析显示,HER2激活突变组的ORR为22%。然而,其开发在2022年年中终止,不再进行临床研究。
Tuxobertinib
Tuxobertinib(BDTX-189)是一种不可逆选择性抑制剂,靶向变构EGFR和HER2致癌突变,包括EGFR/HER2外显子20插入突变。MasterKey-01研究显示,在经过多线治疗的患者,包括既往接受过EGFR/HER2 TKI治疗的患者中具有有希望的抗癌活性,具有新型新一代TKI的额外优势,抑制HER突变,同时保留野生型HER,降低脱靶毒性。
选择性HER2抑制剂
目前正在开发的具有EGFR保留活性的高度HER2选择性新型HER2 TKI包括TAS0728,BI 1810631,JBJ-08-176-01,JIN-A04,ELVN-002,NVL-330和ENT-H1(图2,3)。
TAS0728
TAS0728是一种HER2选择性抑制剂,特异性靶向HER2。在癌细胞中,表现出对HER2过表达/扩增和HER2突变的有效抑制活性。正在等待TAS0728临床试验的结果(NCT03410927)。
BI 1810361
BI 1810361(zongertinib)是一种口服活性、强效、共价、高选择性HER2抑制剂。在正在进行的I期Beamion Lung 1(NCT04886804)中,其用于HER2突变的不同类型肿瘤表现出令人鼓舞的抗肿瘤活性。在铂类化疗难治的HER2突变NSCLC中,ORR为46%。BI 1810631的优化剂量为240mg和120mg。腹泻是最常见的不良事件(32.6%),为1级或2级。
JBJ-08-176-01
JBJ-08–176-01是一种HER2选择性共价TKI,靶向多种HER2激活突变,包括外显子20插入和扩增。与其他EGFR/HER2 TKI相比,JBJ-08-178-01对HER2突变表现出很强的选择性,同时保留野生型EGFR。JBJ-08–178–01与HER2激酶结构域共价结合,提示对HER2的选择性源于JBJ-08–178–01三唑并吡啶环和Ser783之间的氢键。在各种HER2突变细胞系(包括患者来源的细胞)和体内观察到JBJ-08–178-01的疗效。
JIN-A04
JIN-A04是一种选择性靶向HER2外显子20插入突变(包括HER2 VVMA和HER2 P780_780_Y781insGSP突变)的TKI。JIN-A04显著抑制携带这些突变的Ba/F3细胞系,HER2 YVMA和GSP的IC50分别为11.1和1.4 nM。
ELVN-002
ELVN-002是一种CNS渗透性、不可逆强效HER2抑制剂,靶向关键HER2突变,包括NSCLC中外显子20插入突变,同时保留EGFR。一项评估ELVN-002治疗HER2突变实体癌患者的I期研究正在进行中(NCT05650879)。
NVL-330
NVL-330是一种高选择性、CNS渗透性、共价HER2抑制剂,靶向关键HER2突变,特别是在NSCLC中外显子20插入突变表现出有希望的体内活性。正在等待临床评估。
ENT-H1
ENT-H1是一种不可逆的HER2抑制剂,靶向野生型和突变HER2,包括外显子20插入突变。体外分析显示在各细胞系,包括A775G776insYVMA和G776VC中表现出活性。
靶向HER2的单克隆抗体
早期尝试用于HER2扩增NSCLC并不成功,疗效中等(表1)。在~30%的NSCLC病例中发现的HER2过表达(IHC 2+或3+)与预后较差有关。曲妥珠单抗是一种直接靶向HER2的人源化单克隆抗体,在HOT1303-B试验中用作单药治疗。ORR为0%,中位PFS为5.2个月。随后,多项II期研究纳入了HER2过表达NSCLC患者,评估联合化疗方案,如吉西他滨和顺铂,紫杉醇和卡铂,或多西他赛,以克服曲妥珠单抗单药治疗的局限性。虽然加用化疗后ORR更优(24.5-38%),但PFS获益中等,中位PFS为3.3-8.5个月。
帕妥珠单抗是一种HER2人源化单克隆抗体,联合曲妥珠单抗治疗HER2突变和扩增,在经过多线治疗的患者中ORR为11%。HER2外显子20 Y772_A775dup和A775_G776insYVMA突变以及HER2扩增报告了缓解。
一项II期研究(IFCT-1703)纳入了≥1铂类治疗后HER2突变晚期NSCLC患者接受帕妥珠单抗、曲妥珠单抗和多西他赛治疗,ORR和PFS分别为29%和6.8个月。
靶向HER2的ADC
一类令人兴奋的新兴治疗药物是抗体-药物偶联物(ADC)。ADC由单克隆抗体、有效载荷和化学连接子组成,可以选择性靶向癌细胞。通过裂解、内化和向HER2阳性癌细胞释放有效载荷以诱导癌细胞死亡,提高疗效,ADC能够最大限度地提高临床疗效并最大限度地减少不必要的毒性,从而克服传统化疗药物的缺点。
T-DM1
T-DM1(恩美曲妥珠单抗)是一种靶向HER2的ADC,由曲妥珠单抗与抗微管药物emtasine偶联而成,药物抗体比(DAR)为3-4。一项II期篮子试验探索了T-DM1用于接受过多线治疗的HER2突变癌症患者,NSCLC患者的ORR和PFS分别为44%和5个月。TRAEs主要是1级或2级输注反应,血小板减少症和AST和ALT升高。生物标志物分析显示,缓解者具有HER2突变,不同突变亚型的ORR存在差异:HER2外显子20插入突变为55%,其他亚型为29%,外显子19突变无反应。在11%的HER2突变NSCLC中同时观察到HER2扩增,未发现HER2 IHC与临床反应的相关性。这项具有里程碑意义的研究强调了HER2突变分子选择的重要性和NGS的临床效用。
随后一项T-DM1 II期试验纳入了HER2外显子20插入突变的NSCLC患者,其中A775_G776insYVMA最常见(86.4%)。ORR和PFS分别为38.1%和2.8个月。与HER2过表达乳腺癌或胃癌相比,TDM1用于HER2过表达转移性NSCLC的研究显示疗效中等,ORR为7-20%(表1)。
德曲妥珠单抗
ADC德曲妥珠单抗(T-DXd;DS-8201a)由人源化抗HER2抗体、基于肽的可裂解连接子和拓扑异构酶I抑制剂有效载荷组成,DAR约为8。膜渗透性细胞毒性有效载荷能够有效地将有效载荷递送到表达HER2的肿瘤细胞,并对附近的肿瘤细胞产生细胞毒性旁观者效应。
一项德曲妥珠单抗治疗HER2变异晚期NSCLC的剂量扩展1期研究显示,ORR和中位PFS分别为55.8%和11.3个月。HER2突变亚组的ORR为72.7%,中位PFS为11.3个月。4例患者出现间质性肺疾病(ILD)和肺炎,3例被判定与德曲妥珠单抗有关。
II期研究DESTINY-Lung01探索了德曲妥珠单抗用于HER2过表达或HER2激活突变的转移性NSCLC患者,IHC 2+和3+队列的ORR分别为24.5%和20.0%。HER2突变NSCLC患者的ORR为55%。HER2突变亚型A776insYVMA和Tyr772_Ala775dup/p.Ala775_Gl的ORR为61%(图4)。中位PFS和中位OS分别为8.2个月和17.8个月。临床前研究表明,HER2激活突变增强受体内化和德曲妥珠单抗细胞内摄取,DESTINY-Lung01研究证实了这一发现,德曲妥珠单抗在HER2突变NSCLC中比HER2过表达NSCLC中活性更高。55.1%的患者报告了与德曲妥珠单抗相关的3级或以上TEAE,包括中性粒细胞减少(20.4%)和判定ILD(6.6%)。分别有53.1%、34.7%和22.4%的患者报告剂量中断、减少和治疗中断。提高对德曲妥珠单抗相关ILD/肺炎的意识对于更好的患者结局至关重要。
随后,非比较随机II期试验DESTINY-Lung02评估了德曲妥珠单抗5.4或6.4mg/kg,每3周一次用于HER2突变NSCLC的获益-风险情况。中期分析报告,5.4和6.4mg/kg的ORR分别为53.8%和42.9%。在5.4mg/kg队列中,安全性更高,判定ILD率为5.9%,而6.4mg/kg队列为14%。德曲妥珠单抗是首个获得FDA批准用于治疗难治性HER2突变NSCLC的HER2 ADC。伴随诊断包括基于血浆的Guardant360 CDx和基于组织的Oncomine Dx Target Test。
耐药机制
与其他分子靶向治疗类似,对HER2靶向治疗的获得性耐药是不可避免的。有研究分析了胃食管腺癌和乳腺癌HER2靶向治疗耐药机制,目前描述肺癌HER2靶向治疗获得性耐药性的数据较少。从理论上讲,获得性耐药可能涉及HER2依赖性和HER2非依赖性途径。更具体地说,可能发生HER2继发突变或者旁路激活(如RAS/MAPK或PI3K/AKT信号通路)。关于HER2突变NSCLC患者ADC获得性耐药的证据很少,需要进一步研究。
未来展望与结论
对于HER2变异的NSCLC患者,最佳序贯策略和最佳联合方案仍有待阐明。目前,只有HER2突变的NSCLC患者适合HER2靶向治疗,HER2过表达和扩增没有相同的获益。
识别HER2突变对于NSCLC患者从这些靶向治疗中获益至关重要。铂类化疗目前仍然是HER2突变肺癌患者的首选一线治疗。基于DESTINY-Lung01和Lung02研究,德曲妥珠单抗仍然是经治HER2突变晚期NSCLC患者的一线治疗选择。正在进行的DESTINY-Lung 04研究将评估德曲妥珠单抗用于HER2外显子19或20突变晚期NSCLC的一线治疗(NCT05048797)。HER2 ADC的颅内疗效也尚未完全确定。DESTINY-Lung04正在探索CNS PFS作为次要结局指标之一。
靶向HER2的抗体-药物偶联物与ICI联用是一种有前途的方法,目前几项I期试验正在进行中,评估此类疗法在经治HER2突变晚期NSCLC患者中的安全性和有效性。DESTINY-Lung03是一项正在进行的Ib期研究,评估德曲妥珠单抗和度伐利尤单抗联合化疗作为HER2过表达NSCLC患者的一线治疗(NCT04686305)。评估德曲妥珠单抗加度伐利尤单抗作为二线治疗的II期篮子试验HUDSON,以及评估德曲妥珠单抗联合帕博利珠单抗治疗HER2表达和HER2突变肺癌的研究(NCT04042701)正在等待结果。
一项II期试验探索了吡咯替尼联合PD-1抑制剂用于一线化疗失败的HER2突变NSCLC(NCT04144569)。潜在的重叠毒性,如ILD,是联合策略的重要关注点。
探索了其他新型靶向药物,如双特异性抗体,来实现不同表位或抗原的双重靶向。Zenocutuzumab(MCLA-128)是一种人源化IgG1bsAb,靶向HER2和HER3细胞外结构域。具有增强的抗体依赖性细胞毒性(ADCC)活性。
正在开发的较新概念包括双有效载荷ADC,这类ADC使用两种独立的有效载荷,具有不同的作用机制,目的是协同有效载荷递送以获得更有效的细胞毒性反应。I/II期临床试验(NCT03602079,NCT03255070,NCT04818333,NCT05141786)正在评估其他几种HER2 ADC,如A166、ARX788、SHRA1811和MRG002用于HER2变异的NSCLC。
自FDA批准首个HER2 ADC以来,HER2突变NSCLC领域出现了许多令人兴奋的机会。正在进行的临床试验可能会进一步优化这些新型药物的序贯治疗、可行的联合方案和对耐药机制的了解。
参考文献:
Nützinger J, Bum Lee J, Li Low J, Ling Chia P, Talisa Wijaya S, Chul Cho B, Min Lim S, Soo RA. Management of HER2 alterations in non-small cell lung cancer - The past, present, and future. Lung Cancer. 2023 Sep 28;186:107385. doi: 10.1016/j.lungcan.2023.107385. Epub ahead of print. PMID: 37813015.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#HER2#变异#非小细胞肺癌#的#分子检测#
110