血清胰岛素异常升高,这种罕见病因你知道吗?
2023-04-24 张伟,张刘兵 “检验医学”公众号 发表于陕西省
本案例就工作中遇到的异常血清胰岛素结果进行复核、排查、原因分析,并通过查阅文献和患者病情记录,积极与临床沟通,及时有效的为临床提供检验结果,为临床进一步明确诊断提供了帮助。
前 言
胰岛素是由A、B两条肽链通过二硫键连接而成的一种51个氨基酸组成的蛋白质,主要由胰岛β细胞分泌。胰岛素能促进肝脏、肌肉和脂肪等组织摄取和利用葡萄糖,抑制肝糖原分解及糖异生作用,促进蛋白质和脂肪合成,抑制蛋白质、脂肪分解及酮体生成。
案例经过
患者,男,37岁,易饥、多食1年余,突发出现饥饿感、头晕、全身乏力,并逐渐出现意识障碍,同行者呼叫120送至我院急诊,查血糖2.1mmol/L,立即予静脉推注、滴注葡萄糖注射液,血糖上升至3.7mmo1/L,意识恢复,未诉其他不适,为进一步诊治,拟“低血糖症、Graves病”收入院。
病史:患者1年余前无明显诱因出现易饥、多食,伴心悸、手抖,伴怕热、多汗、体重下降就医本院,检查后诊断为“原发性甲状腺功能亢进”,予“甲巯咪唑”治疗4月后自行停药。
5月前再次出现上述症状,于我院内分泌科就诊诊断为“高代谢症及Graves病”后予“甲巯咪唑、普萘洛尔”治疗,未遵嘱规律服药。20余天前我院内分泌科门诊复查后规律服用上述药物至今。
查体:T 36.5 °C,R 20次/分钟,BP 151/95mmHg。神志清楚,双肺呼吸音清,未闻及干混性啰音。心率80次/分,律齐,各瓣膜听诊区未闻及明显病理性杂音。腹软,无压痛、反跳痛、肌紧张,肝脾肋下未触及,双下肢无水肿。甲状腺II度肿大,无压痛,双侧肢体肌力正常,双手细颤。
影像学检查:颅脑、胸腹部CT:甲状腺密度减低,余CT平扫未见异常。甲状腺及颈部淋巴结超声检查:甲状腺实质弥漫性改变;颈前部甲状腺周围肿大淋巴结声像。泌尿系及腹部超声检查:双肾、双侧输尿管未见明显异常;胆囊餐后显示不清,肝、胰、脾声像未见明显异常。
实验室检查:甲状腺三项:FT3↑,FT4↑,TSH↓;甲状腺抗体三项:TGAb正常,TPOAb↑,TRAb↑,提示甲状腺毒症,见图1。
糖化血红蛋白5.1% (参考范围4.8-6.0%),生长激素0.19ng/mL (参考范围0.003-0.971ng/mL),血常规:白细胞计数:8.89x109/L,中性粒细胞5.52x109/L,淋巴细胞2.37x109/L,单核细胞0.68x109/L,嗜酸性粒细胞0.31x109/L,红细胞5.33x1012/L,血红蛋白156g/L,血小板270x109/L。
空腹血糖9.39mmol/L,空腹胰岛素>1000.0μU/mL,超敏C反应蛋白0.4ng/L,抗中性粒细胞抗体阴性,肝、肾、心生化结果未见明显异常。入科随机血糖6.4mmo1/L,β-羟丁酸0.06mmol/L(参考范围0.02-0.28mmol/L),尿糖1+。
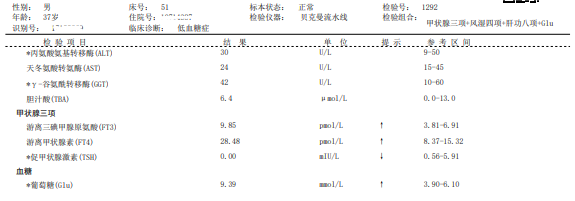
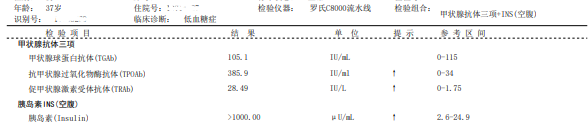
图1 甲状腺三项、甲状腺抗体三项、空腹血糖及胰岛素结果
案例分析
在审核报告时发现该患者空腹胰岛素出现异常高值结果>1000μU/mL(图1),立即查看仪器状态及室内质控,未见异常;核查标本状态:无黄疸、溶血、脂血等。将该样本再次离心,重测及稀释10倍后测试结果仍然是>1000μU/mL(图2),排除样本错误。
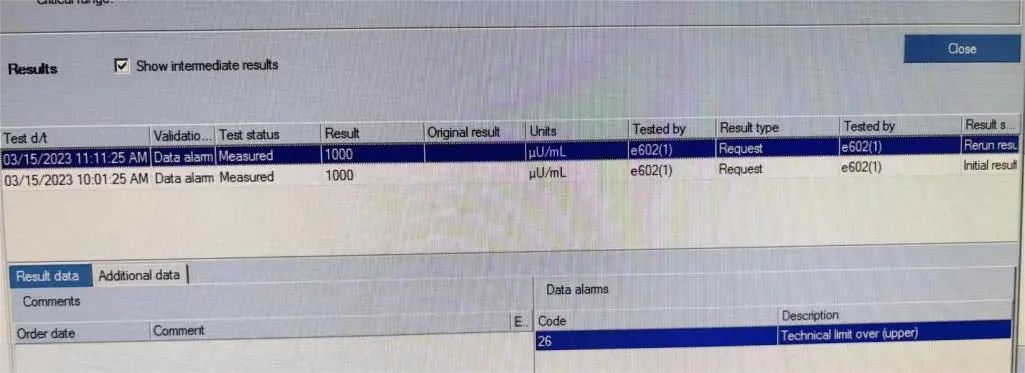
图2 重测胰岛素
分析导致这种结果原因:1、检测系统的原因?2、患者为高胰岛素血症,胰岛β细胞瘤?3、使用外源性胰岛素?4、标本内存在干扰胰岛素检测的物质?
我们将该标本外送其他机构做比对检测,同时补充检测该标本的C肽值,外送结果:胰岛素>1000μU/mL,因此排除检测错误;C肽升高,值为22.31ng/mL(图3)。但C肽升高幅度与胰岛素不平行!这不符合胰岛β细胞瘤等导致胰岛素和C肽同步高水平分泌的特征。

图3 胰岛素比对检测及C肽检测结果
查看患者病历并与临床沟通:该患者诊断为Graves病,应用甲巯咪唑常规抗甲亢治疗,无应用外源性胰岛素史。临床医生表示,类似病例用该药后罕见高胰岛素血症,也未见甲巯咪唑直接干扰胰岛素检测的文献报道。患者此次以Graves病和低血糖症入院,临床症状明显,高胰岛素血症原因待明确!
继续查看检验结果,空腹及餐后血糖、胰岛素及C肽结果如表所示,
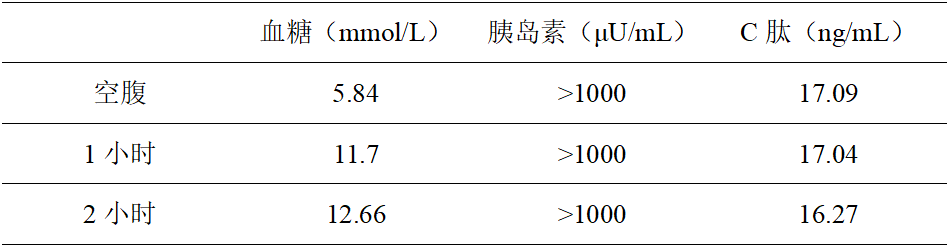
结果显示空腹与餐后的C肽水平变化不明显,说明胰岛素的释放不受血糖水平变化的自主调控;胰岛素浓度远高于C肽,两者并非呈平行关系,高浓度的胰岛素可能并非胰岛β细胞受高糖刺激后所即时分泌;餐后血糖长时间保持在高水平,可能因体内存在大量非生物活性的胰岛素所致。
假设血中存在大量非生物活性的胰岛素,是什么原因所致?又是如何引发患者自发性低血糖症状?
查阅文献资料发现,应用含巯基药物(包括他巴唑、甲巯咪唑等)治疗Graves病等自身免疫性疾病可能诱发一种罕见的胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)。
IAS是由血中高浓度胰岛素自身抗体(insulin autoantibodies,IAA)引起的以高胰岛素血症及自发性低血糖发作为特征的一种罕见类型自身免疫性疾病[1]。该病多伴发其它自身免疾病如Graves病、系统性红斑狼疮、系统性硬皮病、多发性骨髓瘤等,其中Graves病最为常见[2]。
目前研究认为,药物的巯基可与胰岛素双硫键发生相互作用,使内源性胰岛素发生变构导致部分抗原暴露,触发免疫反应而产生胰岛素自身免疫抗体(IAA)。而IAA具有高结合力和低亲和力的特征,可与胰岛素大量结合形成不稳定的无生物活性抗原抗体复合物,降低血清游离胰岛素浓度,扩大胰岛素存储容量,进一步刺激胰岛β细胞继续分泌胰岛素。当胰岛素与抗体解离时,大量游离胰岛素释放入血引起高胰岛素血症,进而引起血糖急剧下降,导致低血糖[3]。
因此,根据该患者的临床表现和检查结果,不排除是由甲巯咪唑诱发的IAS!
于是再次沟通临床并建议检测胰岛素自身抗体。临床医生亦表示高度怀疑IAS。随后的抗体结果证实患者体内存在高滴度的IAA(图4),符合IAS的血清学特征。

图4 胰岛素自身抗体检测结果
根据IAS发病机制,患者血清中存在高水平无生物活性的结合胰岛素,活性胰岛素(游离胰岛素)水平如何呢?
我们多次检测患者血清胰岛素水平,发现稀释10倍后,检测结果依然是>1000μU/mL,说明总胰岛素水平非常高。用聚乙二醇沉淀法处理血清,检测低血糖症未发作及发作时血清中的游离胰岛素,结果分别为1176μU/mL、1595μU/mL,如图5,此结果显示游离胰岛素占总胰岛素的比例不高,说明患者体内存在大量结合型胰岛素,且低血糖症发作时,结合型胰岛素与抗体解离,游离胰岛素增高,与IAS的发病机理相符。
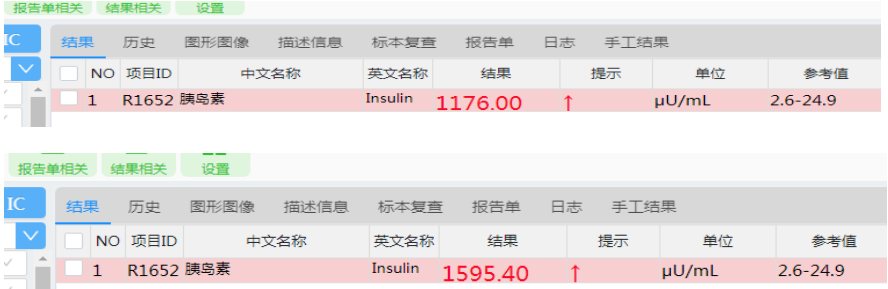
图5 游离胰岛素值
最终结合临床表现及各项检查,临床诊断该患者为:Graves病合并甲巯咪唑诱导的胰岛素自身免疫综合征。调整抗甲亢药物治疗方案、对症治疗IAS后,患者体征趋于平稳。
回头来看,患者以低血糖2.1mmol/L昏迷送急诊补糖抢救后入内分泌科,入科随机血糖6.4mmo1/L,隔天上午空腹血糖9.39mmol/L,且尿糖1+,下午再次出现严重低血糖病症。由此可见血糖水平呈现高低交替,且无规律性。
推测其原因是餐后或补糖后,由于体内IAA结合大量游离胰岛素,生物活性胰岛素不足,糖利用障碍,导致高血糖,超过肾糖阈而出现尿糖阳性;当胰岛素抗原抗体解离后,游离胰岛素急剧上升,进而引发低血糖。
IAS的诊断与鉴别诊断
IAS作为一种罕见的疾病,临床上常符合以下条件即可以诊断:(1)未使用外源胰岛素和降糖药而反复出现自发性低血糖(Whipple三联征[4]:1、头晕、乏力、意识障碍;2、意识障碍时血糖低;3、静脉补充葡萄糖血糖升高后症状消失);(2)血液中免疫活性胰岛素或(和)C肽水平升高;(3)IAA滴度明显升高;(4)未发现胰腺占位性病变。
IAS需与以下疾病鉴别诊断:
1)胰岛β细胞瘤。有典型的Whipple三联征,且口服或静注葡萄糖后症状消失;胰岛β细胞瘤患者血清胰岛素升高水平与C肽同步,影像学上常可见胰腺占位表现;患者胰岛素水平多<1000μU/mL。
2)B型胰岛素抵抗综合征。存在胰岛素自身受体抗体,临床表现为高雄激素血症和严重胰岛素抵抗,常合并系统性红斑狼疮等自身免疫性疾病[5];常伴难以控制的高血糖;该病胰岛素升高幅度小于IAS,胰岛素受体抗体阳性而IAA呈阴性。
3)糖耐量受损及早期糖尿病。OGTT结果符合糖尿病或糖耐量受损诊断,胰岛素水平正常或轻度升高且存在分泌高峰延迟,IAA阴性。
因此,IAA阳性是IAS的诊断与鉴别诊断的关键。
案例总结
疾病复杂多变,作为检验工作者,当发现异常结果时,不仅要求我们具备良好的检验业务能力开展甄别、求证,也要求我们不断注重临床思维能力的培养和提升,积极主动与临床沟通,抽丝剥茧,寻根溯源,为疾病的及时诊治提供直接的实验室证据。
专家点评
深圳市龙华区人民医院检验科主任:姜孝新 主任技师
血清胰岛素异常升高常见于胰岛β细胞瘤,胰岛素自身免疫综合征在我国的发病率很低,误诊或漏诊可能增加患者不良后果的风险。本案例就工作中遇到的异常血清胰岛素结果进行复核、排查、原因分析,并通过查阅文献和患者病情记录,积极与临床沟通,及时有效的为临床提供检验结果,为临床进一步明确诊断提供了帮助。注重临床思维能力和沟通能力的培养有利于提高临床对检验结果的信任度,也是提高检验人员业务能力的基本途径。
参考文献
[1]Hirata Y, Ishizu H, Ouchi N. Insulin autoimmunity in a case of spontaneous hypoglycemia[J]. J Japan Diabetes Soc, 1970, 13:312-320.
[2] Tinmanee R, Buranagan R, Ploybutr S, et al. Rare cause of recurrent hypoglycemia: insulin autoimmune syndrome[J]. Case Rep Endocrinol, 2017, 2017:6423852.
[3]王梦雷;余舒乐;宋昌龙;陈红斗;抗甲状腺功能亢进症药物致胰岛素自身免疫综合征流行病学分析[J];医药导报;2019,38(7):958-960
[4] Group I H S . Glucose Concentrations of Less Than 3.0 mmol/L (54 mg/dL) Should Be Reported in Clinical Trials: A Joint Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes[J]. Diabetes Care, 2017, 40(1):155-157.
[5] Willard DL, Stevenson M, Steenkamp D. Type B insulin resistance syndrome[J]. Curr Opin Endocrinol Diabetes Obes, 2016, 23(4):318-323.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













受益非浅!
73
谢谢分享
82
谢谢分享
75