Cell Death Differ:帕金森病模型中TfR2的缺失具有神经保护作用
2020-12-28 xiaozeng MedSci原创
帕金森病(PD)是一种神经退行性疾病,该疾病主要影响的是基底神经节的黑质纹状体回路中的多巴胺能(DA)神经元。该疾病是特发性的,仅有10%不到的病例可归因于单基因原因。
帕金森病(PD)是一种神经退行性疾病,该疾病主要影响的是基底神经节的黑质纹状体回路中的多巴胺能(DA)神经元。该疾病是特发性的,仅有10%不到的病例可归因于单基因原因。
PD的病因复杂,涉及复杂的基因-环境相互作用,其主要危险因素是衰老。线粒体功能障碍、α-突触核蛋白的聚集以及随之而来的蛋白毒性应激反应和有害的氧化应激反应已被确认为该疾病的主要致病机制。由于目前PD仍难以治疗,因此,鉴定可靶向的改变疾病发生发展的特定通路显得尤为重要。
在特发性和遗传性PD中均会发生铁代谢的紊乱,并伴随着黑质致密部(SNpc)及其DA神经元中铁的沉积。这些改变或具有深远的神经病理学意义。铁的动态平衡也在衰老这一PD主要危险因素中发生变化。
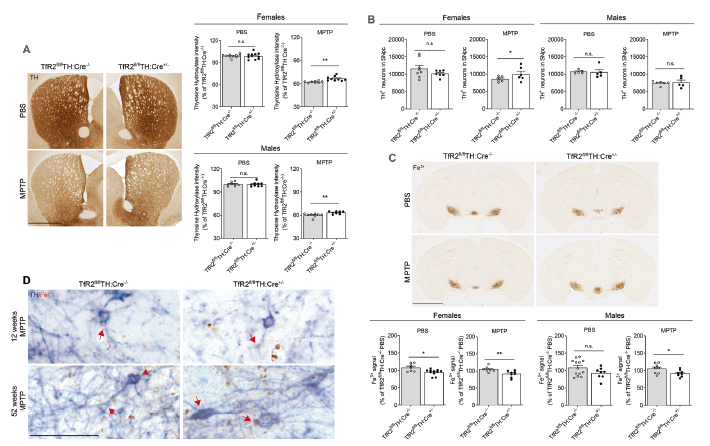
TfR2缺失对于52周龄mptp处理的小鼠具有保护作用
因此,通过螯合的方式减轻铁负荷已被认为是一种可行的疾病改善治疗策略。然而,由于普遍的不良副作用以及特异性的不足,铁螯合策略目前仍不完善。因此,更有效的方法是寻找与PD相关的大脑区域尤其是黑质相关的大脑区域中与铁超负荷相关的特异性信号通路。
先前的研究已证实,TfR2(转铁蛋白/转铁蛋白受体2)的铁转运机制在黑色素多巴胺能神经元中起着至关重要的作用,而在PD模型和患者中该机制受到了干扰,因此其可能是阻止铁沉积的潜在治疗靶标。
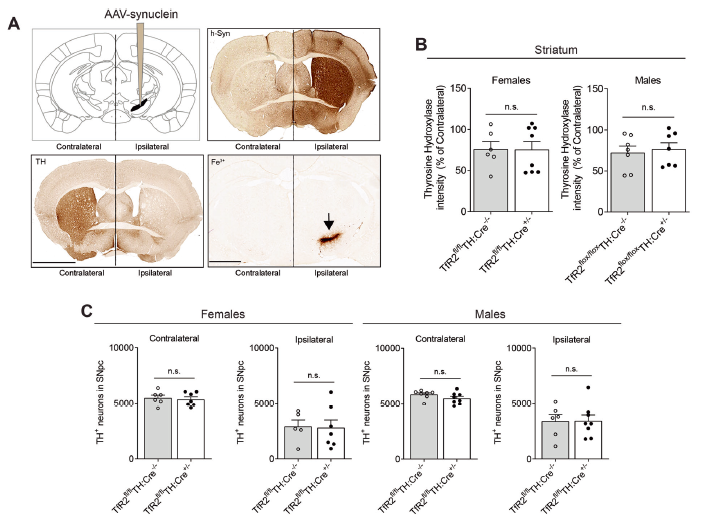
Tfr2靶向缺失对于PD模型的影响
为了验证该假设,该研究构建了多巴胺能神经元靶向敲除TfR2的小鼠模型。在该模型中,研究人员基于神经毒素的暴露或α-突触核蛋白的蛋白毒性机制,采用多种方法对PD进行建模。研究人员发现,TfR2的缺失可以通过抵抗多巴胺能神经元变性、PD以及衰老相关的铁超负荷来起到神经保护的作用。进一步的研究发现,该作用在女性而非男性中更明显。
总而言之,该研究结果显示,TfR2的铁转运作用或可成为一种阻遏PD发生发展的策略。然而,该研究结果也表明,针对TfR2的治疗策略应该考虑神经保护反应中潜在的性别二态性。
原始出处:
Milanese, C., Gabriels, S., Barnhoorn, S. et al. Gender biased neuroprotective effect of Transferrin Receptor 2 deletion in multiple models of Parkinson’s disease. Cell Death Differ (16 December 2020).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#CEL#
58
#Cell#
67
#Differ#
70
#神经保护#
103
#Death#
69
#保护作用#
58
学习到了
101
学习
116
好文章!
115
梅斯里提供了很多疾病的模型计算公式,赞一个!
77