好文推荐 | 猴痘病毒感染的神经系统表现研究进展
2024-03-27 中风与神经疾病杂志 中风与神经疾病杂志 发表于陕西省
本文将对猴痘病毒感染等神经系统表现及发病机制进行综述。
摘要
在过去的一年内,猴痘的爆发已成为全球关注的问题。猴痘是猴痘病毒感染引起的人畜共患病,除典型的皮疹症状以外,猴痘病毒感染还可引起一系列神经系统表现,潜在的机制可能包括感染后免疫介导的神经系统损伤,以及病毒直接侵入神经系统。本文围绕猴痘病毒感染的神经系统表现进行综述,以促进早期识别、诊断猴痘病毒感染神经系统并发症,及时采取相应的防治措施。
猴痘是一种罕见的人畜共患病,由属于正痘病毒的猴痘病毒(monkeypox virus,MPXV)感染引起。该病主要在西非和中非国家流行,其他地区的罕见报道与这些流行地区的输入病例相关。但在2022年5月出现了迄今为止在非流行国家中最大的猴痘疫情暴发,同年7月,世界卫生组织宣布猴痘为国际关注的公共卫生紧急事件。2022年9月在我国发现了首例境外输入病例,2023年6月开始出现本土猴痘疫情,截至2023年9月,我国确诊猴痘病例累计共1 403例,国家卫健委已将猴痘列为乙类传染病进行管理,急需预防和治疗措施。除典型的皮疹症状以外,猴痘病毒感染还可能导致各种并发症,如发热、淋巴结肿大、肺炎、脑炎以及角膜炎等多系统损害。本文将对猴痘病毒感染等神经系统表现及发病机制进行综述。
1 猴痘病毒与猴痘疫情
猴痘是由MPXV引起的人畜共患疾病。猴痘病毒是属于痘病毒科、脊椎动物痘病毒亚科和正痘病毒属的双链包膜DNA病毒,镜下为大小约200 nm×250 nm卵圆形或砖形颗粒,属于天花病毒的近亲,但传染力相对较弱。该病毒于1958年在丹麦哥本哈根国家血清研究所的饲养猴中首次发现。1970年首例人MPXV病例于刚果民主共和国发现,并成功分离出MPXV样病毒。已知两种不同的病毒亚型:西非亚型和中非(刚果盆地)亚型。目前病毒的常见和最主要的传播亚型是西非亚型,与中非亚型相比,西非亚型引起的疾病较轻。既往MPXV主要局限于西非和中非地区,但2022年6月27日发布的《世卫组织疫情更新》报告猴痘在英国、德国、西班牙和葡萄牙等非流行国家暴发,这次暴发疫情随后被世界卫生组织宣布为全球公共卫生紧急事件。MPXV发病率的增加可能部分归因于20世纪80年代初天花疫苗接种计划停止后人群免疫力的下降。
猴痘通过动物-人以及人-人之间两种模式进行传播。主要宿主为非洲啮齿类动物,灵长类动物也可成为传染源。传播途径包括接触感染动物或人的体液(如血液、唾液、呼吸道飞沫和病变渗出物)以及性行为传播。
病毒起初在接种部位增殖,继而扩散至引流淋巴结或血液(引起原发性病毒血症)。继发性病毒血症在其从淋巴器官扩散到血液后发生。最终,病毒寄居在皮肤和其他黏膜部位,如鼻、咽、眼和肛门生殖器区域。在细胞水平上,病毒蛋白与宿主糖胺聚糖相互作用,并通过细胞内吞作用进入宿主细胞。
2 猴痘病毒感染的全身症状
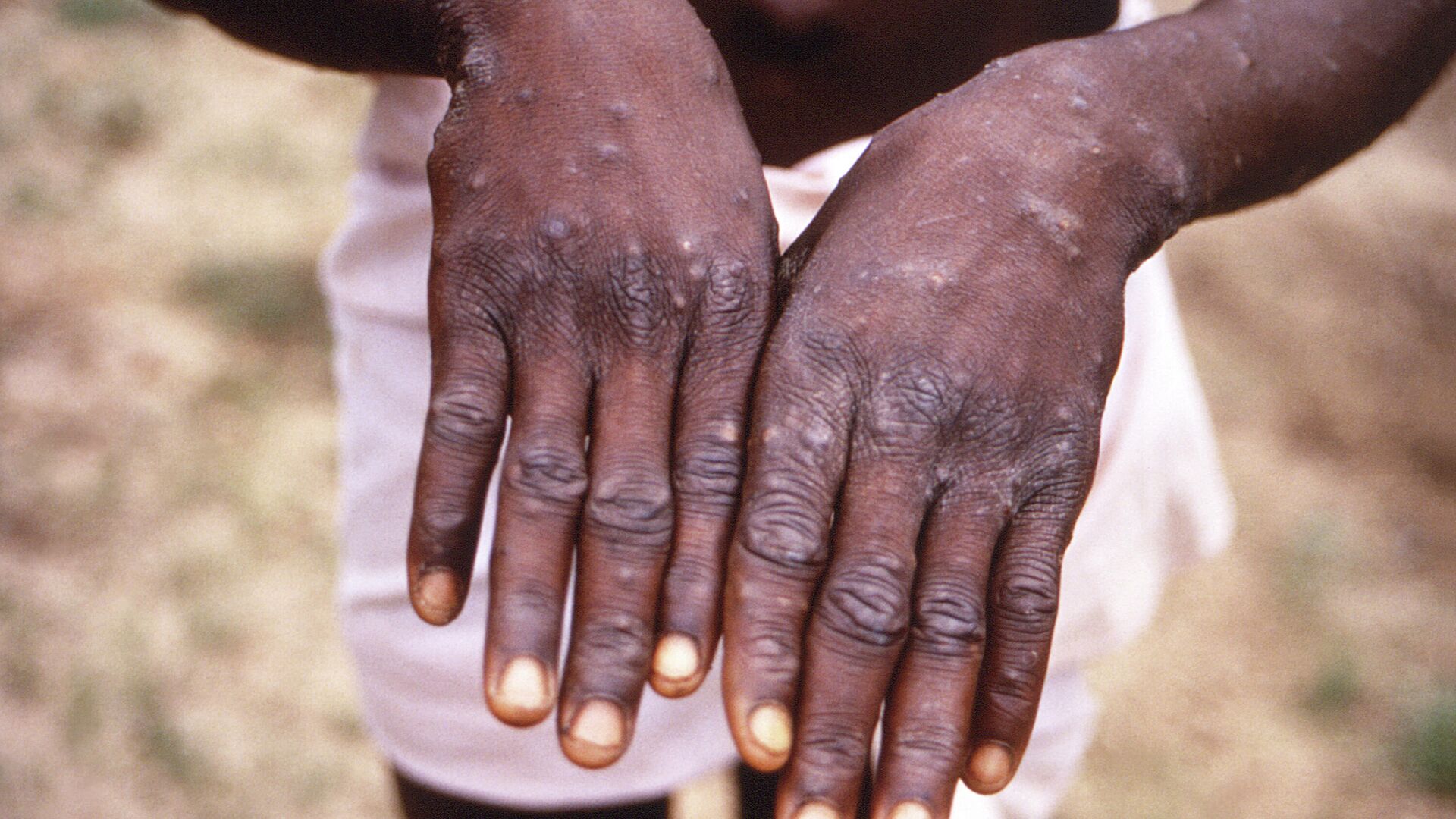
猴痘病毒感染的潜伏期约为7~17 d,前驱期表现为发热、寒战、头痛、肌痛、嗜睡和淋巴结肿大等非特异性症状,持续约1~4 d后进展为皮疹期,持续约14~28 d,特征为大小不等的疼痛和瘙痒性皮疹,首发于面部,随后蔓延至躯干、双手、下肢。皮疹呈离心性分布,经历从斑疹、丘疹、水疱、脓疱到结痂的演变阶段,约2~6周后结痂脱落,遗留色素沉着及瘢痕。皮疹可继发细菌感染,并可引起角膜感染、呼吸窘迫、肺炎、脑炎等并发症。
近期猴痘暴发的特征为口腔、泌尿生殖道及肛周黏膜受累,表现为咽炎、尿道炎、龟头炎及直肠炎,提示了双性恋和男男性行为者群体中的性传播比例的升高。
猴痘为自限性疾病,死亡率约1%~11%,主要发生于年轻人与儿童,尤其是处于免疫抑制状态的患者。天花疫苗的接种对感染猴痘病毒有一定的交叉保护作用。
3 猴痘病毒感染的神经系统症状
3.1 临床表现
既往对于MPXV感染的神经系统并发症的报道很少,已经报道的病例主要局限于15岁以下的儿童和严重免疫缺陷的患者。然而,在当前MPXV流行期间,神经系统并发症已经在青壮年中观察到。
猴痘病毒感染的神经系统表现包括头痛、肌痛、乏力及意识模糊等非特异性症状,以及癫痫、脑炎、急性播散性脑脊髓炎等严重并发症。神经系统查体可见意识水平下降,瞳孔散大,视盘水肿,角膜反射消失,深部腱反射减弱等。
脑炎是与猴痘病毒感染相关的最严重的神经系统表现,发生率较低(约为2.0%)。脑炎是由病毒、细菌、真菌、肿瘤或自身免疫反应引起的脑实质炎性病变。该病最常由病毒引起,病毒可直接作用于脑实质,引起先前感染的再激活,或诱导自身免疫反应。猴痘患者脑炎的发生率较低。首个详细描述的MPXV相关脑炎的病例是在2003年美国MPXV暴发期间的1例6岁女童,该患儿在皮疹出现后数日内迅速出现意识水平下降、肌肉僵直以及癫痫等症状。头部磁共振成像(magnetic resonance imaging,MRI)显示弥漫性皮质、丘脑和脑干水肿,脑膜强化,左侧丘脑及右侧顶叶异常信号。该患者的脑脊液(cerebral spinal fluid,CSF)化验最初为中性粒细胞轻度升高,几天后转变为淋巴细胞升高,CSF中检测出MPXV特异性IgM抗体,而MPXV 聚合酶链式反应(polymerase chain reaction,PCR)检测为阴性,由于IgM不能通过血脑屏障,CSF中IgM的检出提示病毒直接侵袭中枢神经系统,导致鞘内抗体的产生。
与其他正痘病毒相似,猴痘可能通过其嗜神经的特性以及继发性免疫反应介导神经系统损伤,引起格林-巴雷综合征、横贯性脊髓炎、急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)等疾病,具体的致病机制尚未明确。
在Money等报道的3例患者中观察到符合ADEM的影像学特征,头部MRI通常表现为多灶性、双侧不对称的斑片状、边界不清的T2加权磁共振成像液体衰减反转序列(fluid-attenuated inversion recovery,FLAIR)高信号,病灶多位于基底节区、小脑、脑干、皮质下白质、灰白质交界处和脊髓白质,伴或不伴病灶周围水肿和强化。脑脊液化验提示淋巴细胞增加、蛋白质升高。部分考虑为病毒直接感染中枢神经系统的病例CSF中MPXV PCR检测阳性,经过抗病毒治疗后症状缓解、MPXV转阴,但治疗过程中出现新的局灶性中枢神经系统缺损症状,复查腰椎穿刺提示蛋白升高、淋巴细胞增多,提示MPXV感染诱发了免疫介导的ADEM。
3.2 猴痘病毒入侵中枢神经系统的潜在途径
动物研究表明,受感染动物的脑组织中检测出MPXV,说明MPXV可以穿透血脑屏障(blood-brain barrier,BBB)并表现出神经侵袭能力。
实验研究数据表明,MPXV可以通过嗅上皮侵入中枢神经系统。在松鼠鼻腔接种刚果盆地MPXV株后,MPXV在鼻中隔黏膜和脑组织中的积累显著增加。此外,通过滴鼻接种MPXV,生物荧光成像显示该病毒在动物的鼻内和脑组织中复制增加。小鼠鼻腔接种MPXV后,病毒载量较高的的主要器官为脑、鼻中隔和鼻黏膜。这些结果表明鼻腔和嗅上皮可能是MPXV进入脑实质的主要途径。
此外,有研究表明MPXV可能通过感染白细胞,如单核/巨噬细胞侵入中枢神经系统。静脉注射MPXV病毒后,可在猕猴循环单核细胞中鉴定到MPXV-Zaire 79的特异性抗原。血液循环中受感染的单核细胞可以穿过血脑屏障,进入脑组织。MPXV也可在巨噬细胞中快速复制,并被释放到脑组织中。
在2021年刚果民主共和国发生的疫情中,约有20%的猴痘患者出现结膜炎,可导致视力下降,这也可能是病毒侵入中枢神经系统的潜在途径之一。
3.3 实验室检查
在怀疑MPXV相关神经侵袭性疾病时,需行脑脊液病毒PCR检测以及MPXV-IgM/IgG抗体检测,抗体通常可于脑脊液中存在较长时间。由于猴痘患者可表现为脊髓炎等症候群,需注意与视神经脊髓炎谱系疾病以及髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体相关疾病相鉴别,需完善血清水通道蛋白4(aquaporin 4,AQP4)抗体及MOG抗体检测。如果存在皮肤病变,那么还应进行水疱液MPXV PCR检测和皮肤活检。由于近期猴痘感染通过性行为传播的比率较前明显升高,猴痘患者合并其他性传播疾病的几率较高,在患病前即可存在免疫功能低下状态,因此对人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染等相关合并症的评估尤为重要。
4 猴痘的预防与治疗
4.1 疫苗接种
猴痘的预防及治疗与其他正痘病毒感染相似。接种天花疫苗可能对于猴痘病毒感染有交叉保护作用,感染后的临床症状较轻微。既往研究表明,在接种过天花疫苗的人群中,与感染MPXV的个体接触后患猴痘的风险降低了约85%。疫苗接种策略包括对已经接触过猴痘患者的人群在接触后4 d之内进行暴露后预防,以及对有高暴露风险的人群进行暴露前预防。
4.2 抗病毒药物
大多数病例较轻,通常为自限性病程。但对于免疫缺陷人群,预后通常较差,应在疾病早期启用抗病毒治疗。迄今为止,已有研究表明部分抗病毒药物在体外和动物模型中都表现出对MPXV的作用,包括tecovirimat、brincidofovir和cidofovir。其中用于治疗MPXV最有前景的药物是tecovirimat,曾于2018年7月被美国食品药品监督管理局(FDA)批准用于治疗天花。
Tecovirimat(TPOXX或ST-246)作用于正痘病毒包膜蛋白VP37,阻断病毒成熟和从受感染细胞中释放这一最后步骤,从而抑制病毒在受感染宿主体内的传播。用法为成人每次口服或静脉注射600 mg,每日2次,一个疗程为14 d。Tecovirimat已在美国及欧洲等地区的猴痘患者中应用,并证实了其安全性。
Cidofovir是一种抑制DNA复制的广谱抗病毒药物,已被批准用于治疗巨细胞病毒性视网膜炎,其抗MPXV的功效已在动物模型中得到证实。Brincidofovir(cidofovir的脂质共轭物)是一种正痘病毒核苷酸类似物DNA聚合酶抑制剂,口服生物利用度好,肾毒性较cidofovir减低,用法为成人每次口服200 mg,每周1次,共2剂(第1天和第8天)。
4.3 静脉注射病毒免疫球蛋白
静脉注射病毒免疫球蛋白(vaccinia immune globulin,VIG)是经FDA许可用于治疗牛痘疫苗某些接种并发症的超免疫球蛋白。虽然VIG是一种潜在的治疗方法,但目前还缺乏有关VIG对猴痘和天花有效性的数据,而且VIG对猴痘或天花的使用也未在人类身上进行过测试。由于T细胞功能严重免疫缺陷的患者禁忌接种疫苗,因此有猴痘接触史的此类患者可选择接种VIG。
4.4 免疫治疗
当考虑存在感染后免疫介导的神经系统损伤时,需加用免疫治疗,如静脉应用静注人免疫球蛋白、大剂量糖皮质激素冲击、血浆置换和/或利妥昔单抗等。
5 总 结
猴痘是一种全身性疾病,体外研究表明,MPXV具有神经侵袭性,近期的疾病暴发中神经系统并发症发生率的增长证实了这一点。除头痛、肌痛、乏力及意识模糊等非特异性症状以外,MPXV感染还可引起癫痫、脑炎、ADEM等严重并发症。可能的机制包括感染后免疫介导的神经系统损伤,以及病毒直接侵入神经系统。MPXV直接侵袭神经系统的潜在途径包括嗅上皮、循环单核/巨噬细胞以及结膜等。天花疫苗的接种对感染猴痘病毒有一定的交叉保护作用,近期MPXV的爆发可能与20世纪80年代初天花疫苗接种计划停止后人群免疫力的下降相关。对接触过猴痘患者的高危人群可考虑尽早进行疫苗接种。对于免疫缺陷人群,应在疾病早期启用抗病毒治疗。对于CSF中MPXV PCR及特异性IgM抗体阴性的患者,需考虑感染后免疫介导损伤可能,根据病情选择适当的免疫治疗方案。神经科医生需提高对MPXV感染引起的神经系统表现的认识,以促进早期识别、诊断这些神经系统并发症,采取相应的防治措施。
参考文献
[1]Anand A,Das AK,Bhardwaj S,et al. A brief review of the monkeypox virus and emerging concerns for neuroinvasiveness[J]. Surg Neurol Int,2023,14:78.
[2]Gong Q,Wang C,Chuai X,et al. Monkeypox virus:a re-emergent threat to humans[J]. Virol Sin,2022,37(4):477-482.
[3]Nuzzo JB,Borio LL,Gostin LO. The WHO declaration of monkeypox as a global public health emergency[J]. JAMA,2022,328(7):615-617.
[4]Farahat RA,Ali I,Al-Ahdal T,et al. Monkeypox and human transmission:are we on the verge of another pandemic?[J]. Travel Med Infect Dis,2022,49:102387.
[5]Thornhill JP,Barkati S,Walmsley S,et al. Monkeypox virus infection in humans across 16 countries-april-june 2022[J]. N Engl J Med,2022,387(8):679-691.
[6]Alakunle E,Moens U,Nchinda G,et al. Monkeypox virus in Nigeria:infection biology,epidemiology,and evolution[J]. Viruses,2020,12(11):1257.
[7]Petersen E,Kantele A,Koopmans M,et al. Human monkeypox:epidemiologic and clinical characteristics,diagnosis,and prevention[J]. Infect Dis Clin North Am,2019,33(4):1027-1043.
[8]McCollum AM,Damon IK. Human monkeypox[J]. Clin Infect Dis,2014,58(2):260-267.
[9]Patel A,Bilinska J,Tam JCH,et al. Clinical features and novel presentations of human monkeypox in a central London centre during the 2022 outbreak:descriptive case series[J]. BMJ,2022,378:e072410.
[10]Di Giulio DB,Eckburg PB. Human monkeypox:an emerging zoonosis[J]. Lancet Infect Dis,2004,4(1):15-25.
[11]Jezek Z,Szczeniowski M,Paluku KM,et al. Human monkeypox:clinical features of 282 patients[J]. J Infect Dis,1987,156(2):293-298.
[12]Beer EM,Rao VB. A systematic review of the epidemiology of human monkeypox outbreaks and implications for outbreak strategy[J]. PLoS Negl Trop Dis,2019,13(10):e0007791.
[13]Huhn GD,Bauer AM,Yorita K,et al. Clinical characteristics of human monkeypox,and risk factors for severe disease[J]. Clin Infect Dis,2005,41(12):1742-1751.
[14]Ogoina D,Iroezindu M,James HI,et al. Clinical course and outcome of human monkeypox in Nigeria[J]. Clin Infect Dis,2020,71(8):e210-e214.
[15]Money KM,Barnett TA,Rapaka S,et al. Monkeypox-associated central nervous system disease:a case series and review[J]. Ann Neurol,2023,93(5):893-905.
[16]Pastula DM,Tyler KL. An overview of monkeypox virus and its neuroinvasive potential[J]. Ann Neurol,2022,92(4):527-531.
[17]Cole J,Choudry S,Kular S,et al. Monkeypox encephalitis with transverse myelitis in a female patient[J]. Lancet Infect Dis,2023,23(3):e115-e120.
[18]Badenoch JB,Conti I,Rengasamy ER,et al. Neurological and psychiatric presentations associated with human monkeypox virus infection:a systematic review and meta-analysis[J]. EClinicalMedicine,2022,52:101644.
[19]Sejvar JJ,Chowdary Y,Schomogyi M,et al. Human monkeypox infection:a family cluster in the Midwestern United States[J]. J Infect Dis,2004,190(10):1833-1840.
[20]Sergeev AA,Kabanov AS,Bulychev LE,et al. Using the ground squirrel (Marmota bobak) as an animal model to assess monkeypox drug efficacy[J]. Transbound Emerg Dis,2017,64(1):226-236.
[21]Earl PL,Americo JL,Cotter CA,et al. Comparative live bioluminescence imaging of monkeypox virus dissemination in a wild-derived inbred mouse (Mus musculus castaneus) and outbred African dormouse (Graphiurus kelleni)[J]. Virology,2015,475:150-158.
[22]Sepehrinezhad A,Ashayeri Ahmadabad R,Sahab-Negah S. Monkeypox virus from neurological complications to neuroinvasive properties:current status and future perspectives[J]. J Neurol,2023,270(1):101-108.
[23]Song H,Janosko K,Johnson RF,et al. Poxvirus antigen staining of immune cells as a biomarker to predict disease outcome in monkeypox and cowpox virus infection in non-human Primates[J]. PLoS One,2013,8(4):e60533.
[24]Whitehouse ER,Bonwitt J,Hughes CM,et al. Clinical and epidemiological findings from enhanced monkeypox surveillance in tshuapa province,democratic republic of the Congo during 2011-2015[J]. J Infect Dis,2021,223(11):1870-1878.
[25]Nakhaie M,Arefinia N,Charostad J,et al. Monkeypox virus diagnosis and laboratory testing[J]. Rev Med Virol,2023,33(1):e2404.
[26]Billioux BJ,Mbaya OT,Sejvar J,et al. Neurologic complications of smallpox and monkeypox:a review[J]. JAMA Neurol,2022,79(11):1180-1186.
[27]Fine PE,Jezek Z,Grab B,et al. The transmission potential of monkeypox virus in human populations[J]. Int J Epidemiol,1988,17(3):643-650.
[28]Hammarlund E,Lewis MW,Carter SV,et al. Multiple diagnostic techniques identify previously vaccinated individuals with protective immunity against monkeypox[J]. Nat Med,2005,11(9):1005-1011.
[29]Poland GA,Kennedy RB,Tosh PK. Prevention of monkeypox with vaccines:a rapid review[J]. Lancet Infect Dis,2022,22(12):e349-e358.
30]Grosenbach DW,Honeychurch K,Rose EA,et al. Oral tecovirimat for the treatment of smallpox[J]. N Engl J Med,2018,379(1):44-53.
[31]Russo AT,Grosenbach DW,Chinsangaram J,et al. An overview of tecovirimat for smallpox treatment and expanded anti-orthopoxvirus applications[J]. Expert Rev Anti Infect Ther,2021,19(3):331-344.
[32]Desai AN,Thompson GR 3rd,Neumeister SM,et al. Compassionate use of tecovirimat for the treatment of monkeypox infection[J]. JAMA,2022,328(13):1348-1350.
[33]Adler H,Gould S,Hine P,et al. Clinical features and management of human monkeypox:a retrospective observational study in the UK[J]. Lancet Infect Dis,2022,22(8):1153-1162.
[34]Siegrist EA,Sassine J. Antivirals with activity against mpox:a clinically oriented review[J]. Clin Infect Dis,2023,76(1):155-164.
[35]Chittick G,Morrison M,Brundage T,et al. Short-term clinical safety profile of brincidofovir:a favorable benefit-risk proposition in the treatment of smallpox[J]. Antiviral Res,2017,143:269-277.
[36]Gilchuk I,Gilchuk P,Sapparapu G,et al. Cross-neutralizing and protective human antibody specificities to poxvirus infections[J]. Cell,2016,167(3):684-694.
[37]Thet AK,Kelly PJ,Kasule SN,et al. The use of Vaccinia Immune Globulin in the Treatment of Severe Mpox. Virus Infection in Human Immunodeficiency Virus/AIDS[J]. Clin Infect Dis,2023,76(9):1671-1673.
[38]Nalca A,Rimoin AW,Bavari S,et al. Reemergence of monkeypox:prevalence,diagnostics,and countermeasures[J]. Clin Infect Dis,2005,41(12):1765-1771.
[39]Rizk JG,Lippi G,Henry BM,et al. Prevention and treatment of monkeypox[J]. Drugs,2022,82(9):957-963.
[40]Wittek R. Vaccinia immune globulin:current policies,preparedness,and product safety and efficacy[J]. Int J Infect Dis,2006,10(3):193-201.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#猴痘病毒# #神经系统#
76