中山大学宋尔卫院士研究团队:高脂肪饮食促进癌症发展和导致不良预后,背后的机制找到了!
2024-05-21 Swagpp MedSci原创 发表于上海
来自中山大学的宋尔卫院士以及其团队揭开了高脂饮食的又一大危害——诱发乳腺癌、黑色素瘤等癌症,并明确了背后机制。
众所周知,垃圾食品能给人带来快乐,炸薯条、大汉堡、奶油蛋糕等高脂肪饮食真的越吃越上瘾啊!
在有选择的情况下,杂食动物(比如小鼠和人类)往往更喜欢富含脂肪的能量密集型食物,而非植物型食物。这也解释了为什么不少人在连续几天吃家常菜后,非常想念高脂食品或者外面大餐。
事实上,高脂肪饮食(HFD)带来的健康危害是巨大的!数据显示,超过33%的美国成年人口因高脂肪摄入,导致了超重或肥胖的发生;该比例在亚洲人口中也迅速增长。当然,不只是肥胖,HFD还会诱发一系列的疾病风险,包括:损伤大脑、血管变窄、诱发胆结石、形成脂肪肝、降低免疫力等等,可谓是“从头害到脚”。
近日,来自中山大学的宋尔卫院士以及其团队揭开了高脂饮食的又一大危害——诱发乳腺癌、黑色素瘤等癌症,并明确了背后机制。
具体来说,HFD会影响肠道微生物,导致其释放出大量的亮氨酸,从而激活髓系祖细胞中的mTORC1信号通路,促进具有多形核形态的髓源性抑制细胞(PMN-MDSCs)的产生和分化,进一步推动癌症进展。
该发现揭示了HFD介导癌症进展过程中“肠道-骨髓-肿瘤”轴的重要意义,同时也给医学界提供了抗癌治疗新思路,即从改善肠道微生物群代谢异常入手。

https://doi.org/10.1073/pnas.2306776121
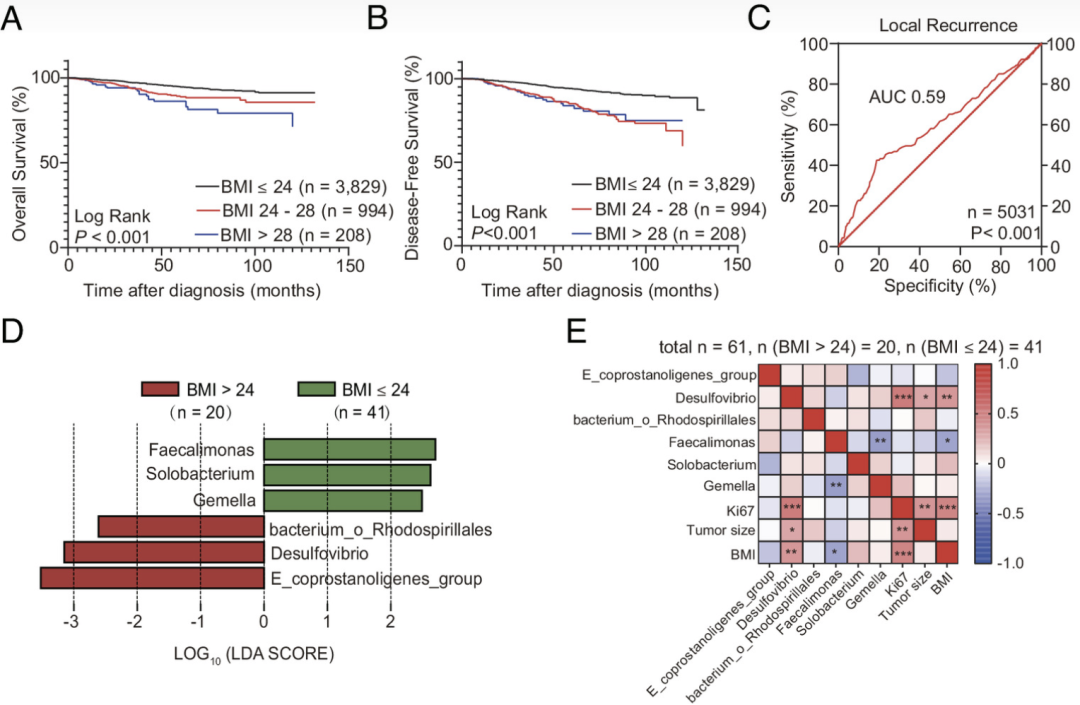
人群试验中,肥胖患者往往有着更快的肿瘤进展和更差的预后情况,这一现象引起了研究者的关注和好奇。于是,他们收集了5031名乳腺癌患者,并对其进行了中位36个月的随访。
Kaplan-Meier曲线显示,相比于体重指数(BMI)>24的超重患者来说,BMI≤24的乳腺癌患者有着更长的总生存期(OS)和无病存活率(DFS)。此外,在接受化疗的乳腺患者中,超重患者也有着明显更短的OS和DFS。可见,肥胖不仅会加速肿瘤的进展,还会降低化疗的效果,最终导致不良的预后。
紧接着,研究者使用16S rRNA基因测序检测了乳腺癌患者的肠道微生物群后发现,BMI>24的患者粪便中产粪甾醇真细菌属、脱硫弧菌和红螺菌科数量急剧增加;相反,Feacalimonas、Solobacterium和Gemella的丰度则显著下降。其中,脱硫弧菌的丰度与患者的肿瘤大小和Ki67阳性率呈正相关。
研究者表示,肥胖患者的肠道微生物群与乳腺肿瘤生长和不良预后之间存在紧密关联,彰显出肠道微生物群的变化在肥胖诱导癌症发展中发挥着至关重要的作用。
肥胖与癌症之间有着紧密的联系
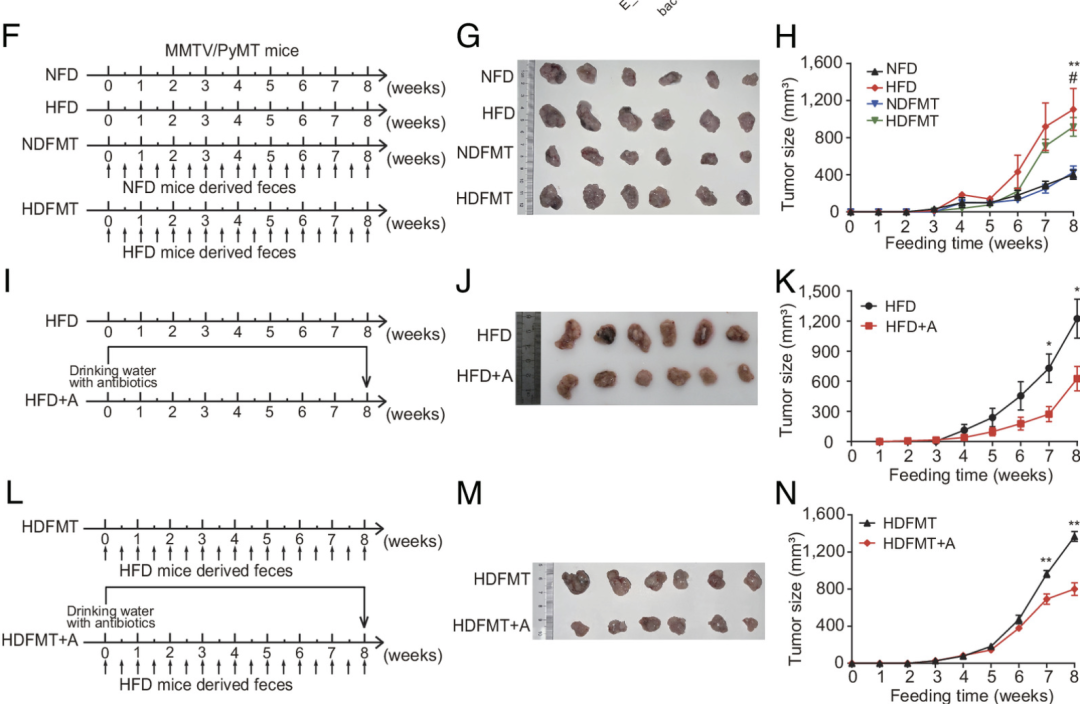
紧接着,研究者构建了小鼠模型,进一步评估了肥胖相关肠道菌群的改变在乳腺癌进展中的作用。与正常饮食相比,HFD组的体重明显增加;同时,在HFD的喂养下,小鼠乳腺肿瘤的进展显著加快。
然而,当研究者使用抗生素鸡尾酒疗法消除了HFD介导的肠道微生物变化,小鼠的体重虽没有发生变化,但促乳腺肿瘤生长的作用被明显减弱。再一次证实了肿瘤生长加速可归因于肥胖和HFD诱导的肠道微生物群的改变。
不同饮食模式下小鼠的癌症状况
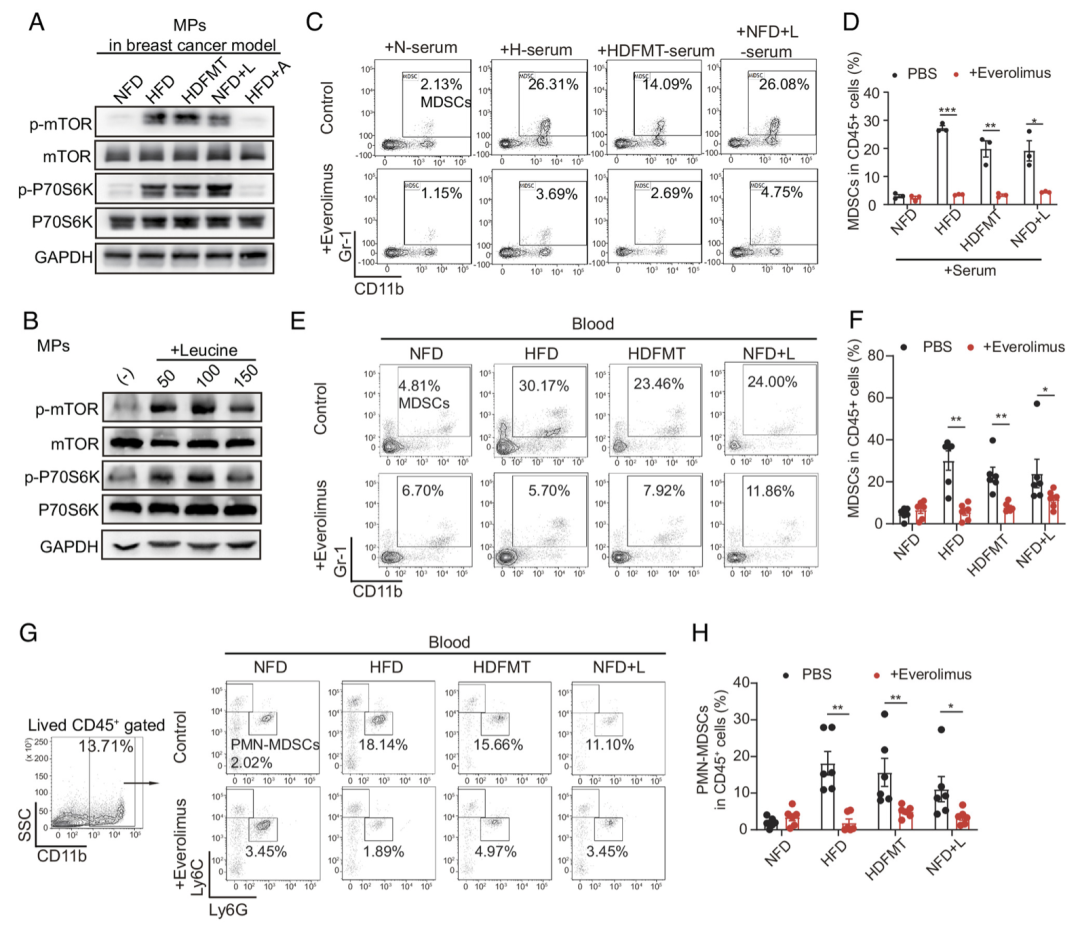
在整个过程中,研究者找到了关键一环——PMN-MDSC。具体来说,HFD介导肠道微生物群落的异常,通过PMN-MDSC促进了肿瘤的进展。
MDSC在骨髓中产生,会进一步迁移到肿瘤灶,形成免疫抑制微环境。与正常脂肪饮食模式的小鼠相比,HFD显著增加了小鼠循环中MDSCs的数量,而MDSCs含量的增多又会抑制CD3+T细胞增殖,同时表达更高水平的免疫抑制标志物,比如:S100A8、S100A9、ARG-1和VEGF。
而PMN-MDSC的增加,又要归因于支链氨基酸(BCAAs)水平的增加。具体来说,当摄入大量的高脂饮食之后,小鼠肠道菌群出现失调,包括L-亮氨酸、L-缬氨酸和L-异亮氨酸等在内的BCAAs水平显著提高。
其中,亮氨酸激活了骨髓中髓系祖细胞的mTORC1信号通路,并高度激活PMN-MDSCs的生成和分化。相反,当使用L型氨基酸转运蛋白抑制剂来抑制亮氨酸的转运之后,MPs中的mTOR信号通路也受到了抑制,循环中PMN-MDSC的水平自然有所减少。
亮氨酸通过激活mTORC1信号通路触发MP对PMN-MDSC的分化
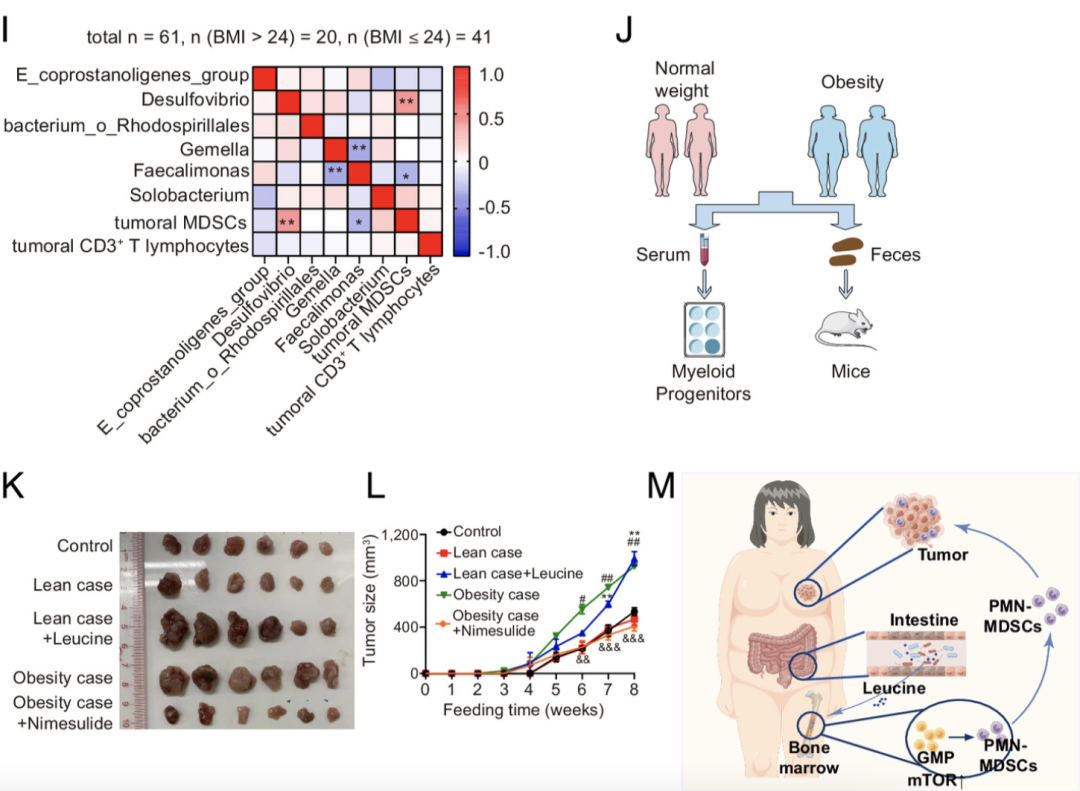
揭密了具体机制之后,研究者又回归了人群试验,分析了58名BMI>24的、105名BMI≤24的、和18名良性乳腺癌患者的血清。
与小鼠实验一致,与良性肿瘤携带者相比,乳腺癌患者的血清亮氨酸水平显著提高。此外,KM曲线和ROC显示,更低的血清亮氨酸水平与更长的无病存活率、更低的肿瘤复发率有关;反过来说,更高的亮氨酸水平,也意味着更高风险的肿瘤情况。
相关机制也在人群试验中得到了证实。从肠道-骨髓-肿瘤轴切入,肥胖的乳腺癌患者血清中有着更高水平的亮氨酸,增强了mTOR信号传导,从而促进了MDSC的产生和分化。研究者也观察到,与正常体重的相比,超重的乳腺癌患者组织中CD33+ MDSC数量显著增加,而MDSCs的主要免疫抑制作用是抑制T淋巴细胞的增殖和抗肿瘤功能,从而加剧了乳腺癌的进展。
乳腺癌患者体内的肿瘤生长情况
综上所述,研究者通过人群试验和动物模型,摸清了高脂肪饮食通过改变肠道菌群(尤其是脱硫弧菌的富集)产生了更多的亮氨酸,进一步激活了骨髓中的mTORC1信号,诱导PMN-MDSCs的分化,从而推动了癌症的进展。在整个过程中,肠道-骨髓-肿瘤轴发挥了重要的作用,为抗肿瘤治疗策略提供了新思路。
所谓“病从口入”,高脂饮食虽然香,但也存在着如此之多的健康危害,生活中应当尽量避开。像五花肉就尽量换成瘦肉,肥牛也应用精瘦牛肉取代,饮食中可增加深海鱼、虾等,优先选择脂肪含量低的食物。改善饮食习惯,永远不会太迟。
参考资料:
[1]Chen J, Liu X, Zou Y, Gong J, Ge Z, Lin X, Zhang W, Huang H, Zhao J, Saw PE, Lu Y, Hu H, Song E. A high-fat diet promotes cancer progression by inducing gut microbiota-mediated leucine production and PMN-MDSC differentiation. Proc Natl Acad Sci U S A. 2024 May 14;121(20):e2306776121. doi: 10.1073/pnas.2306776121. Epub 2024 May 6. PMID: 38709933.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#癌症治疗# #亮氨酸# #高脂饮食# #PMN-MDSCs#
80