Cell Metabolism:清华大学江鹏等团队合作揭示增强CAR-T效果新策略
2023-05-14 iNature iNature 发表于上海
该研究报道延胡索酸水合酶(FH)缺失的肿瘤表现出抑制功能性CD8+ T 细胞的激活、扩增和疗效,并增强恶性增殖能力。
微环境中的代谢改变显著调节肿瘤免疫敏感性,但其潜在机制尚不清楚。
2023年5月12日,清华大学江鹏、武汉科技大学祝海川及北京大学张新祥共同通讯在Cell Metabolism 在线发表了题为“Cancer-cell-derived fumarate suppresses the anti-tumor capacity of CD8+ T cells in the tumor microenvironment”的研究论文,该研究报道延胡索酸水合酶(FH)缺失的肿瘤表现出抑制功能性CD8+ T 细胞的激活、扩增和疗效,并增强恶性增殖能力。
机制上,肿瘤细胞FH耗竭使延胡索酸在肿瘤间质液中积累,延胡索酸增加可直接使ZAP70在C96和C102处琥珀酸化,并使其浸润CD8+ T细胞的活性丧失,从而抑制CD8+ T 细胞的活化和体内外抗肿瘤免疫反应。此外,通过增加FH表达减少延胡索酸,强烈增强了抗CD19 CAR - T细胞的抗肿瘤功效。因此,这些发现证明了延胡索酸在控制TCR信号传导中的作用,并表明延胡索酸在肿瘤微环境(TME)中的积累是CD8+ T细胞抗肿瘤功能的代谢屏障。总之,该研究表明延胡索酸耗尽可能是肿瘤免疫治疗潜在的重要策略。

癌症的特点是连续的基因变化,导致不受控制的生长和扩散到身体的其他部位。基因组的不稳定性会产生新抗原,这些抗原可以被捕获、加工并呈递给CD8+ T细胞,导致T细胞被激活、识别并靶向癌细胞。ZAP70是一种蛋白酪氨酸激酶,在CD8+ T细胞激活的启动事件中起关键作用。临床上,肿瘤浸润淋巴细胞(TIL)的存在已被证明与患者预后和生存率的改善有关。
然而,除了新抗原呈递缺失或对T细胞产生的细胞因子不敏感等内在因素外,肿瘤还可以通过免疫编辑肿瘤微环境(tumor microenvironment, TME)来抑制T细胞浸润和活化或诱导功能障碍(或衰竭),从而获得逃避免疫识别和/或破坏的能力。因此,深入了解TME中的免疫编辑可能为抗肿瘤免疫提供见解。事实上,已经开发了许多用于治疗癌症的免疫疗法,包括免疫检查点抑制剂阻断和工程细胞疗法。然而,主要由于微环境抑制,这些免疫疗法往往免疫功能低下,所涉及的分子机制在很大程度上仍然未知。
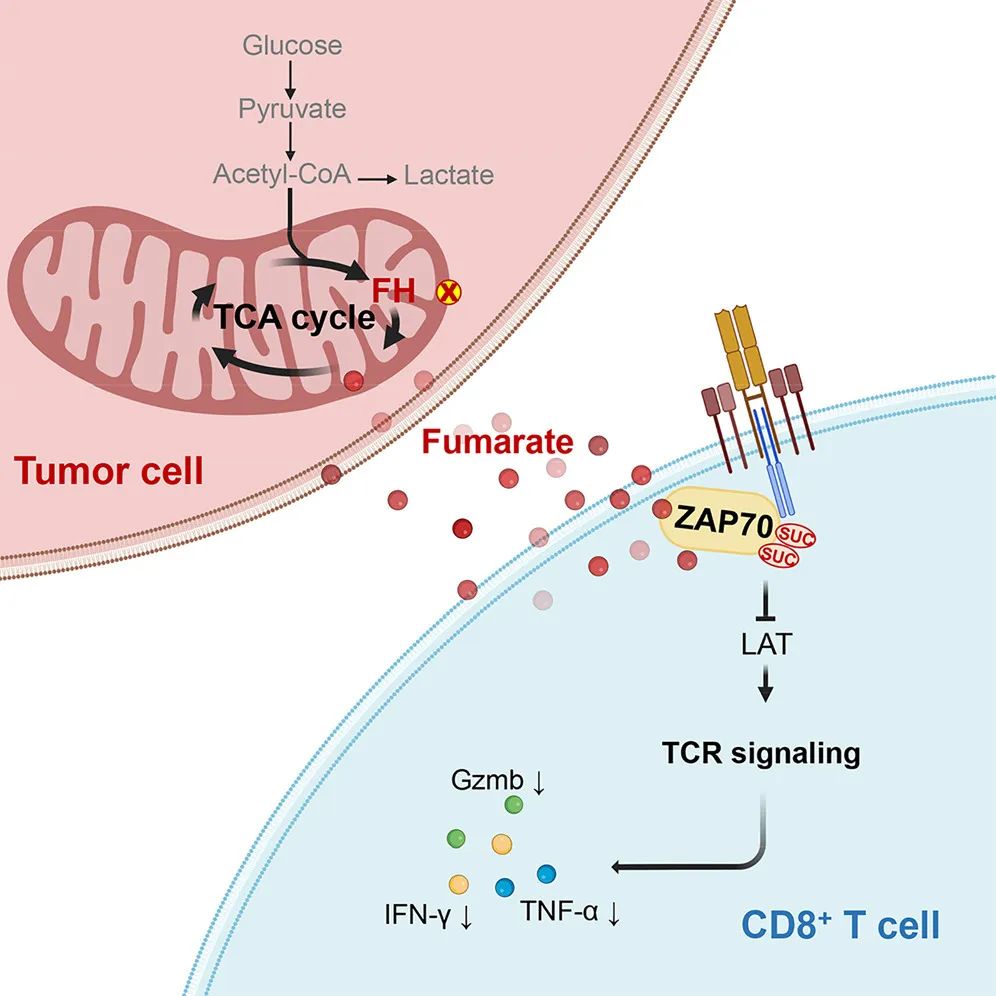
文章模式图(图源自Cell Metabolism )
像癌细胞一样,包括T淋巴细胞在内的免疫细胞依赖于TME中的某些营养物质来生存、扩张或激活。例如,活化的T细胞使用糖酵解来提供能量,一些氨基酸——包括谷氨酰胺、精氨酸和天冬酰胺——以及脂肪酸和甾醇等脂质分子被证明对T细胞的有效活化和/或扩增是必不可少的。由于代谢需求和T细胞功能都与TME密切相关,因此T细胞的抗肿瘤功能容易受到TME营养成分和组成变化的影响,例如缺氧对TIL功能的影响较大。
快速分裂的癌细胞的沃伯格效应(Warburg effect)与T细胞争夺葡萄糖,抑制了它们的抗癌功能。同样,肿瘤细胞中的谷氨酰胺溶解作用强烈地指导T细胞的代谢和功能。除了营养竞争外,TME中积累的代谢物也影响T细胞的功能。据报道,糖酵解产生的乳酸、吲哚胺2,3-双加氧酶(IDO)产生的犬尿氨酸和肿瘤细胞坏死产生的钾的增加会抑制T细胞的抗肿瘤能力。最近,脂质积累也被证明在诱导T细胞功能障碍中起关键作用。尽管代谢需求和变化对T细胞的影响越来越清楚,但关于代谢操纵如何帮助肿瘤细胞逃避T细胞杀伤的报道仍然非常有限。
该研究报道延胡索酸水合酶(FH)缺失或失活的肿瘤细胞在肿瘤间质液中积累延胡索酸,它可以在TME CD8+ T细胞中螯合ZAP70的C96和C102,并导致CD8+ T 细胞活化和对恶性细胞的免疫反应的阻断。在临床前模型中,FH的上调可提高嵌合抗原受体T (CAR - T)细胞在体内和体外的抗肿瘤功效。这些发现揭示了肿瘤细胞源性延胡索酸盐通过浸润CD8+ T 细胞调节抗肿瘤免疫监测的作用,这可能对肿瘤免疫治疗具有重要的治疗意义。
清华大学生命科学学院江鹏、武汉科技大学祝海川、北京大学张新祥为论文共同通讯作者。清华大学生命科学学院博士后程洁、博士生严金鑫、北京大学化学与分子工程学院博士后刘莹和武汉科技大学生命科学与健康学院史江舟为论文共同第一作者。
原文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(23)00171-7#%20
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言