罕见病例:同时性双原发胃癌伴深在性囊性胃炎及黏膜下脂肪瘤
2019-04-15 扫地僧一听 扫地僧一听
同时性双原发胃癌(混合胃肠黏液表型)伴深在性囊性胃炎(gastritis cystica profunda,GCP)及黏膜下脂肪瘤是一种罕见的疾病,发病机制尚不清楚,诊断和治疗难度较大。
一位61岁男性患者因上腹部不适10天转诊本院。一年前,患者因十二指肠溃疡穿孔接受外科手术。个人史和家族史无特殊。吸烟、饮酒40年,高血压10年,口服左旋氨氯地平控制血压。查体无异常。内镜检查发现两处胃同时性病变,贲门小弯侧的直径5mm黏膜糜烂(放大内镜窄带成像(ME-NBI)显示该处的密集的绒毛变化)和胃底体交界后壁直径10mm黏膜不规则凹陷伴边缘结节性隆起(ME-NBI可见一个不规则环状的绒毛结构与一个分界线)(图1 A和B)。病理提示中度慢性萎缩性胃炎,伴有局灶性肠上皮化生和高度不典型增生。强烈提示胃癌发生的可能性,需排除消化性溃疡。继续作进一步的诊断和治疗。
图1
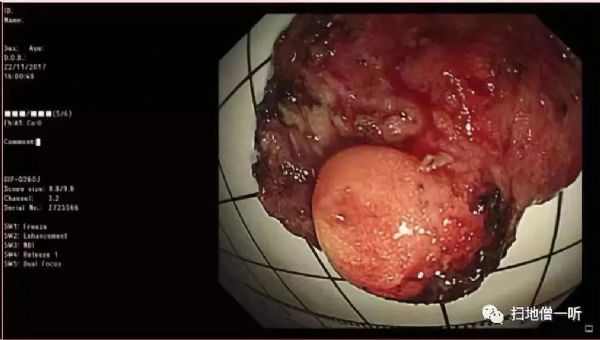
患者入院两天后,内镜黏膜下剥离(ESD)术前放大内镜检查提示,这两种病变的黏膜凹陷有一个清晰的边界(DL)和不规则的微血管(MV)位于loop结构内(图1C和D)。此外,沿病变外缘标记,靛胭脂稀释剂行黏膜下注射。两处病变均采用dual刀行黏膜下切除,手术时间3小时20分钟;胃底体交界后壁病变下方可见一个黄色结节(图2),同时切除。在ESD过程中采用电凝止血。
图2
肉眼可见黏膜不规则,大小为6.3cm*3 cm,黏膜下可见一个灰黄色结节(1cm*0.7cm*0.5 cm)。镜下常规苏木精-伊红(HE)染色切片显示2个成分(图3A和图B):(贲门小弯侧病变)分化良好的管状腺癌(约4mm*3mm),完全累及下方GCP;(胃底体交界后壁处病变)分化良好的管状腺癌(约9mm*3mm),局部侵犯黏膜肌层,累及GCP,病变下方无血管内癌栓及溃疡形成,黏膜下脂肪瘤。周围的胃黏膜可见中度慢性萎缩性胃炎,伴局灶性肠上皮化生和GCP(图3C)
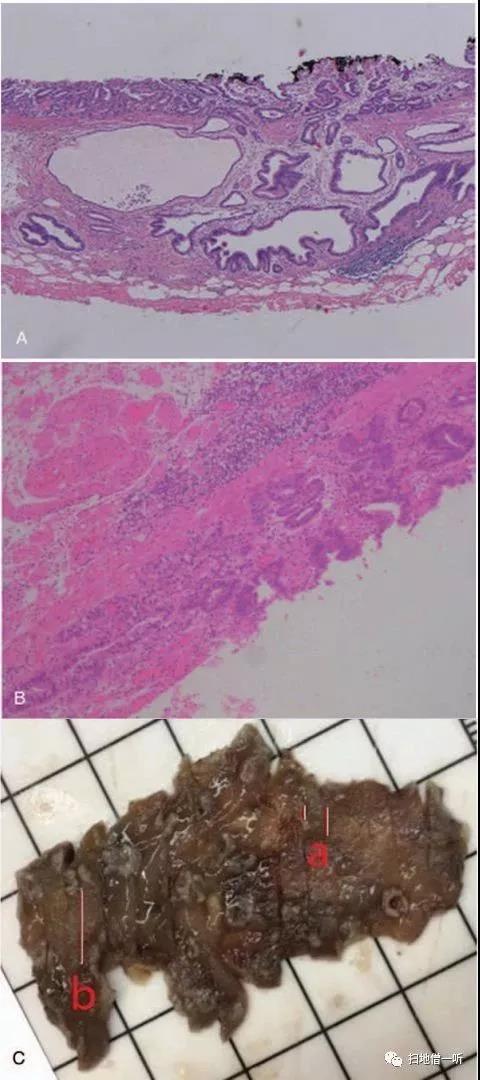
图3
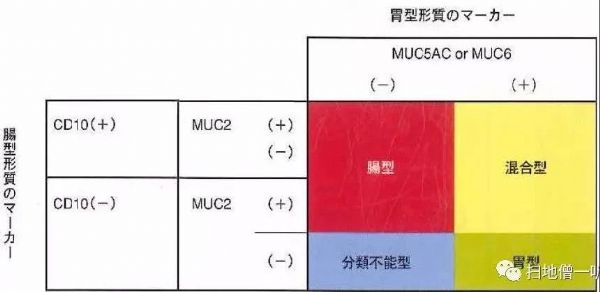
组织病理学发现幽门螺杆菌感染。弹性纤维染色和免疫标记物CD31染色显示胃底体交界处黏膜下静脉有癌栓(图4A)。免疫组织化学分析,肿瘤组织证明MUC5AC(部分+),MUC6(部分+),CDX2 (+),P53 (+),HER2(不确定阳性)和ki - 67(约40%以上),混合胃肠黏液表型(图4 B和C)。基于上述发现,患者被诊断为同时性双原发高分化腺癌(胃肠黏液混合表型)黏膜下静脉癌栓,同时伴有深在性囊性胃炎和黏膜下脂肪瘤。

图4
患者于ESD术后第7天出院。另一所医院于ESD术后第三周为黏膜下静脉癌栓追加近端部分胃切除术,病理未见癌组织残留或淋巴结转移。最终TNM分级为T1b(sm1)N0M0,病理分期为IA。术后随访5个月,无复发和转移的迹象。
知识拓展
同时性多灶性胃癌
根据以往的报道,同步多灶性胃癌在胃切除手术中占4.8% ~ 20.9%,多与早期胃癌(EGC)相关,多灶性胃癌占全部EGC的6% ~ 14%。EGC常发生在胃的下三分之一处。然而,多个EGC往往位于胃的不同部位(上、中、下三分之一),是内镜检查中的重要盲点。此外,男性和黏膜下浸润是同时性多发EGC的预测危险因素。因此,在内镜筛查和内镜肿瘤切除过程中,有危险因素的患者应进行更细致的内镜检查,以免被忽视。此外,还需要新的成像技术,如黏膜染色技术和ME-NBI。
ESD是同时性EGC的理想方法。应用ESD治疗同时性胃癌可以缩短住院时间,降低整体医疗费用。Kasuga等报道,同时性癌同时ESD并发症与手术时长有显著相关性。较大肿瘤、位于上段以及不符合指南ESD标准的肿瘤可能是手术时间较长的指标。如果需要较长的手术时间,分次切除可能是避免并发症的较好选择。
深在性囊性胃炎
深在性囊性胃炎(gastritis cystica profunda, GCP)是一种罕见的疾病,常见于老年男性,中位发病年龄为60岁,其典型的组织病理学特征为腺体间质内结缔组织增生,伴不同程度扩张的胃体腺、幽门腺或化生性腺体向黏膜深层及黏膜下浸润,且腺体形态多无异常。主要位于贲门、胃体前后壁或底幽门腺与幽门腺之间的中间地带。GCP常表现为黏膜下肿瘤(SMT)、孤立性息肉、胃粘膜皱褶,甚至黏膜表面无异常表现。虽然GCP通常发生在胃切除的吻合部位,但也可以在未切除的胃中发现;GCP通常被认为与幽门螺杆菌感染有关。虽然GCP是一种增生性良性病变,但GCP占胃癌病例的3%,有报道认为GCP是一种癌前病变,是基于从异常增生到浸润性癌的恶性进展。超声内镜(EUS)对GCP的内镜诊断具有重要价值。主要表现为无回声,混合不均质,上覆黏膜增厚,或低回声伴微囊。GCP需与胃癌、肥厚性胃炎、胃淋巴瘤、间质瘤、Brunner瘤鉴别。然而,使用内镜或活检很难诊断GCP内的EGC。ESD是诊断此类病例的一种有效方法。
GCP可能与某些胃癌的发生有关,EGC可能是某些GCP发生的重要因素。当检测到GCP时,应仔细监测EGC的存在。EGC合并GCP的病例应与黏膜下浸润和血管内癌栓分开评估;此外,由于主观性高,应采用组织学观察以外的方法(如免疫组织化学和弹性蛋白染色)进行评价。
胃脂肪瘤
胃是脂肪瘤的罕见部位,脂肪瘤约占胃良性肿瘤的3%;这些很容易被忽视,导致误诊和延迟愈合。早期胃癌合并胃脂肪瘤的病例很少。两者位置非常接近,表明这些肿瘤常常是同时发生的。胃镜检查发现“坐垫征”、“张拉效应”、“裸脂征”时,应高度考虑脂肪瘤。早期诊断,内镜下早期切除,损伤小,恢复快。
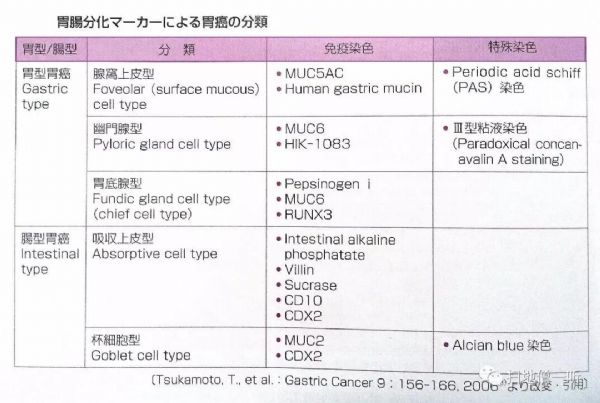
胃肠道黏液表型
此篇报道病例病变是一种混合的胃肠道黏液表型腺癌。一般认为,非贲门腺癌(GAC)通常是通过从非萎缩性胃炎发展为萎缩性胃炎、肠上皮化生(IM)、异型增生和腺癌的一系列的黏膜改变。然而,Tatematsu等人提出IM可能不是胃癌前病变,而是肠型细胞可能独立出现在IM或GAC的胃黏膜中。胃癌细胞的表型表达与周围胃黏膜的表型变化无关,因为胃型GACs可能被肠化的胃黏膜所包围,而肠型GACs可能存在于普通黏膜中。胃黏膜和癌细胞的肠化可能是一种同源转化。
综上所述,同时伴有GCP和黏膜下脂肪瘤的同时性双原发混合胃肠黏液表型胃癌是罕见而复杂的。ESD是同时性EGC的理想治疗方法。当观察到GCP时,应仔细监测EGC的存在。EGC与GCP联合出现的病例应严格排除黏膜下浸润和血管内癌栓,不能只进行组织学观察。弹性纤维染色和免疫标记染色是有用的,在诊断时应加以考虑。
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#罕见病例#
92
#囊性#
89
#脂肪瘤#
78
#罕见#
78
#黏膜#
79