专家论坛|李军:慢性乙型肝炎合并非酒精性脂肪性肝病——当前的认识与争议
2023-08-31 临床肝胆病杂志 临床肝胆病杂志 发表于上海
本文就CHB合并NAFLD进行简要综述,并对目前二者关系进行探讨,为这类患者的临床治疗提供参考。
HBV感染是导致肝硬化及肝细胞癌(HCC)的主要病因,在我国分别占77%和84%[1]。随着社会经济发展,人群的生活方式发生很大的改变,如运动量下降,饮酒量增加,肥胖和糖尿病发病率上升,酒精性肝病和非酒精性脂肪性肝病(NAFLD)发病率不断上升。全球范围内,虽然HBV感染相关死亡人数在下降,但2010—2019年HCC相关死亡人数却增加25%,其中非酒精性脂肪性肝炎(NASH)和酒精导致的年龄标准化死亡率(ASDR)增长最快[2]。由于HBV感染和NAFLD的最终结局均与肝硬化及HCC的发生相关,但在慢性乙型肝炎(CHB)合并NAFLD的HCC风险、全因死亡率和抗病毒治疗效果等方面仍有很多争议,因此本文就CHB合并NAFLD进行简要综述,并对目前二者关系进行探讨,为这类患者的临床治疗提供参考。 1CHB合并NAFLD流行病学 CHB患者合并NAFLD目前缺乏大型的多中心研究。范建高教授团队[3]总结了全球范围内22个队列研究发现,CHB和HBV慢性感染患者中肝脂肪变(hepatic steatosis,HS)的患病率为12.1%~76%。最近一项针对亚洲国家或地区的流行病学调查[4]发现,CHB合并NAFLD患者综合患病率为29.0%(范围13.5%~56.0%),其中中国内地的患病率为25.9%,中国台湾地区为35.2%。总体而言,CHB合并NAFLD的患病率呈现上升趋势,从2010年之前的21.0%上升到2010年之后的31.8%,这也和NAFLD的患病率上升相吻合。CHB合并NAFLD患者的独立危险因素括年龄、性别、BMI、糖代谢紊乱、血脂和尿酸,这些因素也是单纯NAFLD患者的危险因素;而HBsAg和HBV DNA不是HS的独立因素,说明宿主代谢因素是CHB患者发生肝脂肪变性的主要原因。2023年欧洲肝病学会提出将NAFLD更名为代谢异常相关脂肪性肝病(MASLD),而NASH也相应的更名为MASH;这一更名与2020年亚太肝病专家提出的代谢相关脂肪性肝病(MAFLD)概念有相似也有差异,这有待全球肝病领域的专家学者进一步精诚合作推动该领域的进展。 2CHB合并NAFLD发病机制 目前,HBV感染和NAFLD之间的因果关系还没有完全阐述清楚。CHB患者发生肝脂肪变的主要原因是宿主代谢因素,而NAFLD进展后激活免疫细胞及代谢组分可直接抑制HBV复制或间接诱导抗病毒免疫反应,从而对CHB患者产生积极影响;虽然HBsAg和HBV DNA不是宿主HS的独立危险因素,但HBV感染仍能影响机体脂代谢。因此CHB和NAFLD之间存在相互作用,共同影响机体疾病进展。 2.1 NAFLD对CHB的影响 首先,NAFLD/NASH中的免疫细胞激活对HBV复制的影响。在NASH阶段,Toll样受体(TLR)的表达明显升高,并通过TLR激活固有免疫系统。研究[5]显示,在HBV转基因小鼠构建NAFLD模型及体外硬脂酸(SA)诱导的HepG2.2.15细胞中发现TLR4/MyD88信号通路的激活,并抑制HBV的复制;进而发现,体内游离脂肪酸(FFA)和LPS激活TLR4信号通路,从而产生抗病毒免疫细胞因子IFN-β,最终抑制HBV DNA的复制。动物实验数据[5-6]显示,HBV感染合并NAFLD动物在14周和24周后血清中的HBsAg、HBeAg与HBV DNA均明显下降,但IFN-β水平明显上升。由此看来,NASH中固有免疫细胞的激活和释放的抗病毒因子可抑制HBV DNA的复制,从而在HBV感染过程中起到积极作用。另一方面,固有免疫细胞的激活可能恶化NAFLD的进展,如TLR4的激活刺激Kupffer细胞产生促炎细胞因子如:TNF-α、IL-1、IL-6、趋化因子和TGF-β,从而促进肝纤维化的发生,导致NAFLD进展为肝硬化、甚至肝癌[7]。同样适应性免疫细胞(如CD8+T淋巴细胞、Th17细胞)的浸润增加并激活也会影响HBV复制。如NASH患者Th17细胞相关的基因表达明显增加,包括细胞因子IL-21,IL-21不仅能够直接有效地抑制HBV的复制,还能通过抑制IL-10的分泌来减少HBV的复制[8-9],在HBV感染的免疫清除阶段,IL-21的水平与HBeAg和HBV DNA水平呈负相关[10]。 除了免疫细胞激活,代谢因素也参与HBV复制。如在空腹状态下,过氧化物酶体增殖物激活受体-γ(PPAR-γ)共激活因子1α(PGC-1α),(葡萄糖生成、脂肪酸β-氧化和酮体生成的关键酶的转录因子)可通过营养信号刺激HBV复制[11],但在NAFLD进展过程中PGC-1α表达明显减少,且与NAFLD疾病严重程度呈负相关,因此NAFLD导致PGC-1α,表达减少也可能是抑制HBV复制机制之一。NAFLD还可通过诱导HBV感染的肝细胞凋亡来抑制HBV复制和疾病的进展,在NASH患者的肝脏样本中,发现Fas介导的凋亡增加。 临床研究发现,NAFLD与HBsAg血清学清除和HBV DNA抑制呈正相关。与非脂肪肝CHB患者相比,CHB合并NAFLD患者的HBsAg血清清除率更高[12],且中重度脂肪肝更有助于HBsAg携带者的HBsAg血清学清除[13]。合并NAFLD的患者,有更高的HBeAg阴性率(74.3% vs 62.8%)[14],且HBeAg阴性的CHB/NAFLD患者HBsAg清除率明显高于单纯CHB患者[15]。虽然在CHB合并NAFLD患者中,获得功能性治愈的机会更高,但也有研究[16]认为NASH与HBsAg清除率、纤维化进展或HCC发展没有明显关联,甚至认为宿主HS会导致肝硬化和HCC的风险增加[17]。 由此可见,NAFLD/NASH通过激活免疫细胞诱导抗病毒免疫,也可通过非免疫因素防止HBV相关的肝脏疾病进展,但是TLR及适应性免疫细胞的过度激活及促炎细胞因子的释放则加重NAFLD向肝硬化及HCC的进展。因此NAFLD/NASH与HBeAg/HBsAg血清学清除或HBV DNA抑制间的关系,不是简单的CHB患者因NAFLD过程而获益,另也有研究表明HBV对NAFLD的疾病进展和预后有促进作用,为此需要大样本、多中心、随机、前瞻性的研究进一步阐明二者之间的关系。 2.2 HBV感染对NAFLD的影响 HBV感染影响NAFLD发生和发展的机制仍未完全阐明。HBV DNA在肝细胞内转录需要宿主细胞中的各种转录因子和共激活因子作用下进行,包括CCAAT/增强结合蛋白、环AMP反应元件结合蛋白、肝细胞核因子3/FoxA和HNF4、法尼醇X受体、视黄醇X受体、PPAR-γ和PGC-1,而这些转录因子与肝脏糖代谢、脂代谢、胆汁酸代谢密切相关,并在肝脏的再生、炎症和坏死中起到重要作用,从而影响NAFLD发生和发展。 在动物模型中,已经观察到HBV相关的代谢改变。首先,HBV感染可能促进肝脂质合成加速了NAFLD的进展。体内外试验[18]发现HBV感染后,肝脏糖酵解中间产物和糖原代谢显著增加,从而导致脂肪合成底物增加;同时发现HBV转基因小鼠肝脏中脂质生物合成基因表达显著上调,包括固醇调节元件结合蛋白2、ATP柠檬酸裂合酶、视黄醇结合蛋白1和脂肪酸合成酶[19],致脂肪合成增加,加重NAFLD进展。也有研究[20]发现HBx的过表达后上调脂肪酸结合蛋白1,从而促进脂肪合成,加重肝细胞脂质积累。其次,HBV感染还可能影响胆固醇代谢。如HBV包膜的前S1结构域可以阻碍牛黄酸钠共转运多肽介导的胆汁酸摄取,并导致代偿性胆固醇的产生和摄取。最后,HBV感染对NAFLD患者有遗传易感染性可能,含有蛋白酶域的蛋白3(PNPLA3)和跨膜6超家族成员2的单核苷酸多态性是NAFLD的两个重要遗传决定因素。在活检证实的CHB患者的队列研究中,无论有无NAFLD,PNPLA3的几个单核苷酸多态性都与脂肪肝和炎症独立相关。此外,与TT基因型相比,PNPLA3 rs1010023的C等位基因可使CHB患者发生HS的风险增加[21]。但也有研究认为,HBV感染对脂代谢没有影响。Hu等[6]在HBV免疫正常和NAFLD诱导的小鼠模型研究中发现,HBV感染对脂质代谢和胰岛素抵抗没有特异性影响;与NAFLD组相比,HBV/NAFLD组的血浆和肝脏内脂质或胆固醇没有增加,血糖和胰岛素水平未见变化。 慢性HBV感染相关的炎症也可影响NAFLD的进展。在HBV感染中,HBx可诱导肝细胞ROS产生增加,并通过与TXNIP蛋白相互作用激活NLRP3炎性小体,NLRP3的激活诱导Kupffer细胞产生IL-1β,导致介导免疫相关基因的表达和淋巴细胞向感染部位募集,启动炎症反应,导致肝损伤,加速NAFLD进展[22]。HBV感染导致的NLRP3炎症小体的激活还可能通过高迁移率族蛋白1参与了NASH的炎症损伤,但具体机制不清。 一项对7 695例成年人群的横断面临床研究[23]表明,HBV感染者发生高胆固醇血症、高甘油三酯血症和高低密度脂蛋白胆固醇水平的风险较低。此外,两项基于社区的大型队列研究[24-25]发现,慢性HBV感染与血脂水平(如甘油三酯和胆固醇)之间存在负相关。在122例CHB患者的回顾性队列[26]中,血清HBV DNA水平与甘油三酯水平之间存在负相关,但也有研究[27]发现在HBV感染者中,NAFLD主要与代谢因素有关,如肥胖、胰岛素抵抗和血脂异常,而不是病毒因素。 由此可见,慢性HBV感染诱导的代谢改变和慢性炎症,可能加重NAFLD的发展;当然HBV感染与宿主的代谢因素协同发挥作用的机制仍有待进一步研究。 3CHB合并NAFLD的结局 众所周知CHB的发生与肝纤维化和HCC密切相关,同样NAFLD的疾病谱从非酒精性脂肪性变、NASH、肝硬化和肝癌逐一或同时发生,一项来自法国的研究[28]显示,NAFLD相关HCC患病率从1995—1999年的2.6%上升到2010—2014年的19.5%,在一些发达国家甚至达到30%以上。CHB和NAFLD都是HCC发生的独立因素,而随着CHB合并NAFLD患者发病率逐年增加,那二者同时发生是否能加速疾病的进程呢? 一项招募1 466例CHB患者的前瞻性研究[29]显示,代谢综合征增加了心血管事件(如急性冠状动脉综合征)和脑血管事件的风险,但没有增加肝硬化并发症、HCC和/或肝脏相关病死率。在6 786例亚洲成年CHB患者队列中,合并脂肪肝并不增加肝硬化的发生率[14]。其他相关研究也表明,NAFLD不是CHB患者发展为肝硬化或HCC的危险因素。虽然NAFLD不能预测CHB患者不良结局,但NAFLD是CHB患者纤维化的一个独立危险因素。研究[30]发现无脂肪肝的患者5年累计肝硬化发生率为4.17%,而有脂肪肝的患者为5.19%,虽然二者发生率无显著性差异,但年龄大和S3阶段的纤维化可能是患有NAFLD的CHB患者进展为肝硬化的危险因素,且NAFLD可能会加重肝脏疾病,促进HCC的进展。研究发现,合并脂肪肝的CHB患者全因死亡率和癌症发展的风险增加[31],其相关风险增加7.3倍[32]。另一项纳入1 089例患者回顾性研究也发现,合并严重NAFLD与CHB患者的肝纤维化发展密切相关,且合并NASH会进一步增加CHB患者肝脏相关事件的风险,包括HCC和死亡。 综上所述,NAFL虽然不是CHB预后的危险因素,但是针对晚期纤维化,强调NASH患者病例出现气球样变和炎性细胞浸润的情况下,NAFLD仍加速CHB的进展,进而导致恶性肝脏疾病的发生。从机制上来讲,异常的脂质物质在肝细胞内沉积,加速肝细胞的损伤,受损的肝细胞释放危险相关分子模式(DAMP)及细胞因子,招募并激活免疫细胞浸润,导致肝星状细胞的激活及增殖,促进细胞外基质沉积和胶原纤维的产生,最终导致肝硬化,同时肝细胞内脂质物质的毒性,氧化应激的产生和低级别炎症反应也会导致肝内微环境改变及促肿瘤微环境的生成。而HBV慢性感染导致的慢性炎症、免疫细胞浸润和代谢失调进而又加重NASH的进展。故机制上CHB和NAFLD虽不是互为因果关系,但二者表现为相互恶化的关系,最终可能加速疾病的进展;然而疾病的进展受到多种因素影响,CHB合并NAFLD时能决定疾病最终结局的内在机制尚有待进一步阐明。 4CHB合并NAFLD的治疗 抗病毒治疗是目前用于预防CHB患者疾病进展和HCC发病最主要的治疗手段。而对于NAFLD的治疗,目前尚无被批准的有效治疗药物,主要通过改变饮食方式、增加运动量、控制体质量的方式降低患病风险。CHB合并NAFLD患者是否会影响抗HBV治疗的效果目前仍存争议。 2020年的一项回顾性单中心队列研究[14]发现,NAFLD对CHB治疗的完全病毒学抑制(CVS)或生化应答(BR)没有影响,并且合并NAFLD组CVS+BR累积率还高于单纯CHB组(32.5% vs 22.8%),故而此研究认为CHB合并NAFLD启动抗病毒治疗无需考虑NAFLD的影响。另外一项研究[33]比较了合并HS的CHB患者使用恩替卡韦(ETV)或替诺福韦治疗效果,结果显示无论使用EVT组和替诺福韦组的病毒学应答和生化应答无明显差异。来自韩国的一项回顾性研究[34]也观察到单纯CHB组和CHB合并NAFLD组对抗病毒治疗的疗效类似结果,虽然两组CVS相似,但是无HS组HBeAg阴转率却高于合并HS患者。我国的两项回顾性研究[35-36]却发现,在抗病毒的24周和96周并没有观察到NAFLD组与非NAFLD组之间HBeAg血清学转换的差异,但早期(12周)NAFLD组病毒学应答率高于非NAFLD组,在24和96周未见明显差异。综合上述研究可见合并NAFLD的CHB患者,不管是单药治疗还是联合治疗,并不影响宿主对抗病毒治疗的应答,但也有研究获得相反的结果。如我国的一项前瞻性研究[37]发现,合并HS可降低PEG-IFNα-2a对CHB患者的疗效。土耳其的一项回顾性研究[38]虽然也发现CHB合并HS患者对PEG-IFN治疗的持续病毒学应答(SVR)呈下降趋势,但无统计学差异。笔者认为不同研究的结论差异、甚至相悖与目前研究缺乏多中心数据、样本量较小(最少的是50例样本)、随访周期不足(最长随访5年)、对CHB的亚组分层不详细等因素密切相关(表1)。 反之,CHB患者抗病毒治疗是否能影响NAFLD疾病的进展亦存在争议。已有研究显示,富马酸替诺福韦酯(TDF)治疗可降低CHB患者体内脂蛋白[47]和血清胆固醇水平[48],进一步研究发现TDF是通过激活PPAR-α上调肝脏CD36的表达,从而通过提高脂质转运来改善脂质沉积和胰岛素抵抗[48]。但最新一项荟萃分析[49]显示,使用替诺福韦艾拉酚胺后CHB患者血清TG、TC和LDL-c的水平上调。因此对于CHB合并NAFLD患者选择NA抗病毒需注意个体化选择。由于NAFLD尚无批准的特异性治疗药物,故针对NAFLD治疗影响CHB进展研究极少,有待未来开展更多NAFLD治疗对CHB疗效和进展影响的研究。 5总结与展望 由于慢性HBV感染和NAFLD均可导致慢性肝损伤,其共同的临床结局最终走向肝硬化和HCC,因此临床医生和科研工作者应高度关注CHB和NAFLD并存患者的疾病自然史、临床转归和诊治策略探索。慢性HBV感染导致的慢性炎症、免疫细胞浸润和激活与NAFLD导致的脂质代谢失调和脂毒性在肝细胞内异常沉积,将促进肝细胞损伤-炎性细胞浸润-炎性因子分泌-细胞死亡恶性循环的发生,最终导致细胞坏死、HSC激活增殖和HCC的发生。虽然目前的有限研究认为NAFLD可减低HBV复制的风险,且不影响CHB抗病毒治疗的病毒学应答,同时有些抗病毒药物显示能降低宿主的血清脂蛋白和血清胆固醇水平,从而降低宿主高脂血症导致心血管意外事件的发生,呈现两种疾病并未表现相互损伤,甚至表现出互利的影响;但机体是复杂的,特别是肝脏内免疫微环境的改变与免疫细胞异常浸润和激活,这将会影响CHB和NAFLD的最终走向。因此,还需要更多的基础研究,包括从CHB合并NAFLD的动物模型、体外研究模型,肝细胞、HSC与免疫细胞之间的对话,并结合单细胞组学、空间组学等组学的探索,揭示二者之间相互作用的分子机制,从而阐明二者之间的关系;临床医生需要更加关注CHB合并NAFLD患者,开展更多的大样本、多中心、跨区域、随机、对照、前瞻性临床研究,为临床治疗提供更强有力的证据,为CHB合并NAFLD患者的临床管理和治疗提供新的策略。 http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.08.005 阳韬, 李军. 慢性乙型肝炎合并非酒精性脂肪性肝病: 当前的认识与争议[J]. 临床肝胆病杂志, 2023, 39(8): 1797-1804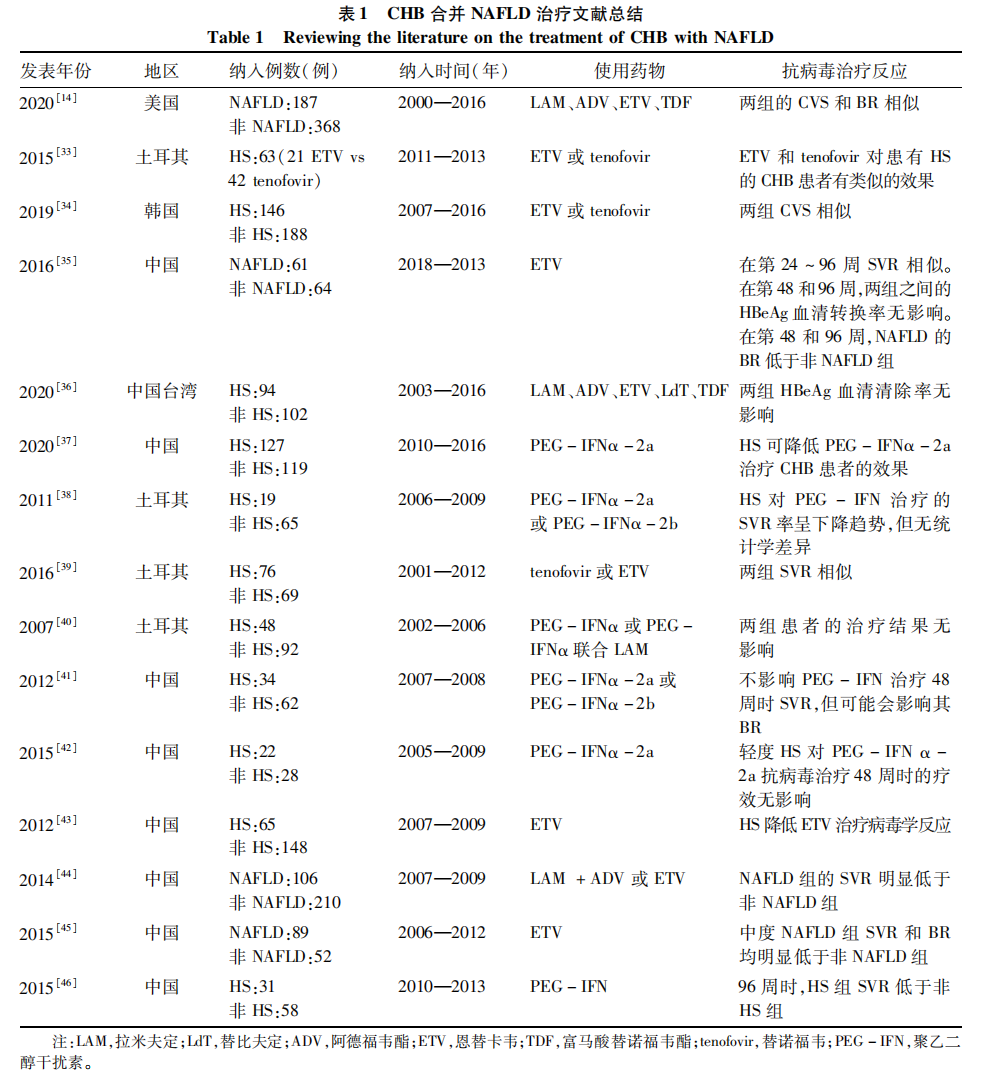
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












HBV感染还是导致肝硬化及肝细胞癌的主要病因
84