Cell子刊:黄爱龙/唐霓团队揭示高果糖饮食促进肝癌进展的机制
2023-10-08 医诺维 医诺维 发表于上海
该研究在多种小鼠肝癌模型中证实了高果糖促进肝癌进展,并揭示果糖的肠道菌群衍生物。
近年来,随着高糖和高脂的西方饮食方式逐渐流行,全世界范围内糖的消费量剧增,人们对于果糖的摄入大大增加。而果糖的过量摄入与肥胖、糖尿病和脂肪肝等代谢性疾病密切相关。早期研究发现,多种肿瘤细胞通过增强经典的果糖代谢,促进细胞的增殖和肿瘤进展。
流行病学资料提示果糖的摄入量与肝癌的发生率和死亡率正相关。2023年8月,哈佛大学医学院张学宏团队发表在JAMA上的一项流行病学研究显示,与从不喝含糖饮料或每月饮用少于3份(每份355毫升)的女性相比,每天饮用1份或更多含糖饮料的绝经后女性,患肝癌风险增加85%,死于慢性肝病的风险增加68%。
然而高果糖摄取会导致肝癌细胞ATP耗竭、活性氧和脂质的异常累积,最终诱导细胞死亡。同时,果糖分解代谢的关键酶KHK和ALDOB在肝癌中失活或低表达,经典的果糖代谢明显减弱。因此,高果糖饮食是否促进肝癌进展仍缺乏足够的实验证据,其具体的分子机制尚不明确。
2023年10月4日,重庆医科大学黄爱龙/唐霓团队在 Cell Metabolism 期刊发表了题为:High dietary fructose promotes hepatocellular carcinoma progression by enhancing O-GlcNAcylation via microbiota-derived acetate 的研究论文。
该研究在多种小鼠肝癌模型中证实了高果糖促进肝癌进展,并揭示果糖的肠道菌群衍生物——乙酸盐增强O-GlcNAc糖基化修饰促进肝癌增殖的分子机制,为合理使用添加糖、防治代谢性疾病发生发展提供了重要的理论依据和新思路。

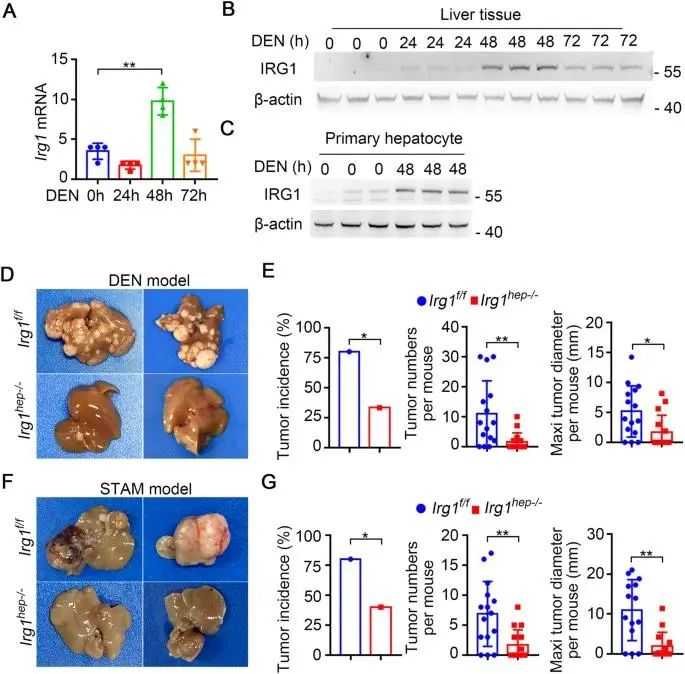
该团队首先利用多种化学诱导(DEN、DEN联合CCl4)和基因缺陷(Pten cKO)的小鼠肝癌模型,明确了高果糖促进小鼠肝癌的进展。随后通过代谢组学发现,高果糖诱导小鼠肝癌组织中氧连-N-乙酰葡萄糖胺修饰(O-GlcNAcylation)的供体底物——尿苷二磷酸-N-乙酰基葡萄糖胺(UDP-GlcNAc)水平显著升高。UDP-GlcNAc作为己糖胺生物合成途径 (HBP) 的最终产物,在细胞营养条件改变或者受到外源刺激时,通过乙酰葡萄糖胺转移酶(OGT)对蛋白质进行O-GlcNAc糖基化修饰,调节蛋白质功能,促进细胞存活和增殖,参与肿瘤的发生发展。为了探究OGT介导的O-GlcNAc修饰在高果糖促进肝癌进展中的作用,研究团队敲低小鼠肝脏OGT的表达,发现高果糖诱导的肝癌进展被明显抑制。
肝癌中经典果糖代谢明显减弱,研究团队由此假设非经典的肠道果糖代谢参与了高果糖诱导的高水平O-GlcNAc修饰。非经典的果糖代谢是指肠道菌群将额外的果糖衍生为远超生理浓度的短链脂肪酸,包括乙酸、丙酸和丁酸。
该团队发现乙酸盐能在体内外上调谷氨酰胺水平和UDP-GlcNAc的合成,最终导致O-GlcNAc修饰增强。在果糖饲喂的条件下,通过口服广谱抗生素抑制肠道菌群,乙酸盐的产生和肝癌组织的O-GlcNAc修饰均受到明显抑制;而补充乙酸盐则促进O-GlcNAc修饰和肿瘤进展。最后,研究人员利用定量O-GlcNAcylomic修饰组学全面描绘了果糖诱导O-GlcNAc修饰图谱,并重点解析了高果糖摄入诱导eEF1A1 蛋白T279位、CAPNS1蛋白S88位的O-GlcNAc修饰并促进肝癌细胞增殖的分子机制。
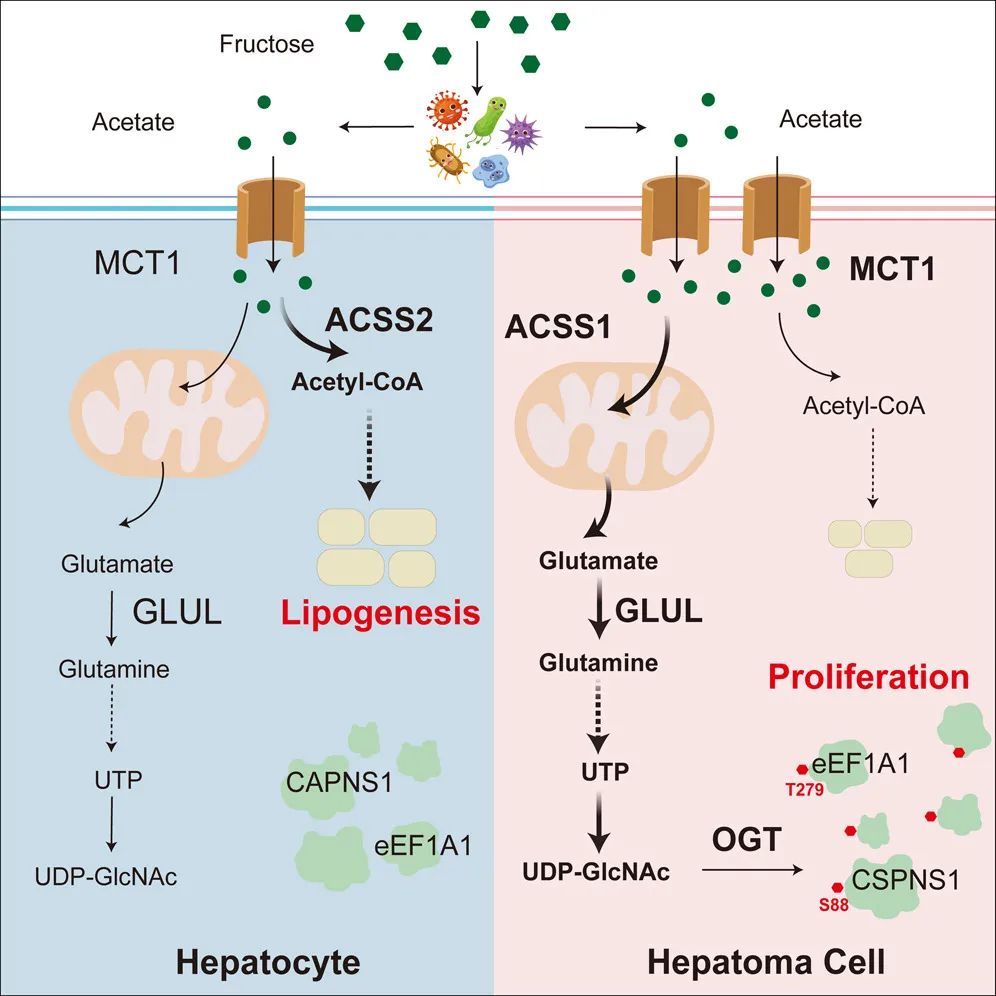
高果糖饮食促进肝癌进展的机制图
该研究在动物模型中证实了高果糖摄入促进肝癌进展,首次揭示了应激环境下肠道菌群衍生的乙酸盐通过己糖胺代谢重塑调控蛋白质糖基化修饰、促进肝癌进展的新机制,该研究也为添加糖的合理使用和肝癌的防治提供了理论依据和潜在的干预靶点。
重庆医科大学感染性疾病分子生物学教育部重点实验室黄爱龙教授、唐霓教授和汪凯副研究员为论文的共同通讯作者,课题组周鹏博士、常文译博士、龚德敖硕士和夏杰副研究员为论文共同第一作者。
论文链接:
https://doi.org/10.1016/j.cmet.2023.09.009
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言