JCO综述:对于CR1期AML患者,哪些因素影响移植的决策?
2023-09-01 聊聊血液 聊聊血液 发表于上海
综述重点关注CR1期新诊断AML患者,从MRD评估、精准基因组学的预后价值以及新药方面讨论了它们如何影响进行allo-HCT的决策。
AML患者移植的影响因素
就在40多年前,Ernest Beutler教授提出了首次完全缓解(CR1)期的急性髓系白血病(AML)患者进行异基因造血细胞移植(allo-HCT)的概念,这与当时流行的血液学传统观念相悖。从历史上看,allo-HCT只被建议用于晚期患者,作为“最后的绝望措施——生命的最后赌注”。但从那时起,在CR1期推荐哪些患者进行allo-HCT的决策一直存在争议和未解决的问题。
移植物抗白血病效应(GvL)于1979年首次在人类中被描述,导致了对驱动allo-HCT的免疫治疗机制的重新评估。考虑到对于几乎所有AML亚型(急性早幼粒白血病除外),allo-HCT均可通过GvL提供最有效的抗白血病治疗,因此最重要的考虑因素仍然是相关的毒性、发病率和死亡率,并推动了临床和伦理中何时提供allo-HCT的决策:预期的无病生存期(DFS)的改善必须明显高于预测的非复发死亡率(NRM)。
多年来,移植领域的变化,特别是在支持治疗方面的变化,带来了更低的NRM和allo-HCT适应症的不断完善,但推荐allo-HCT的策略还必须考虑来自巩固或自体移植的较低NRM以及复发后的挽救潜力。总的来说,如果患者风险评估中预测复发风险为40%,并且DFS至少改善10%,则建议推荐allo-HCT。表1总结了这些广泛的考虑因素;其中合并症的影响,特别是对老年患者的影响,将在allo-HCT和年龄一节中简要讨论。
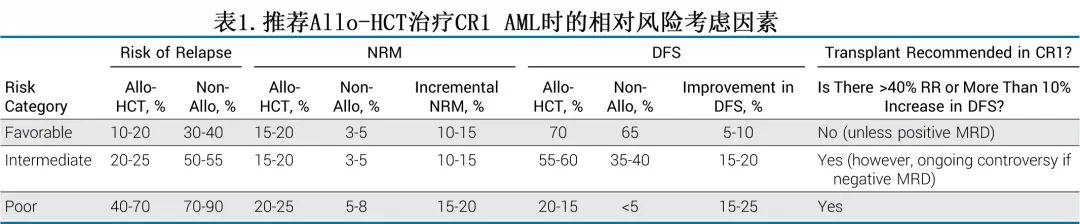
《Journal of Clinical Oncology》近日发表的一篇综述重点关注CR1期新诊断AML患者,从MRD评估、精准基因组学的预后价值以及新药方面讨论了它们如何影响进行allo-HCT的决策。注:本文未讨论供者类型、干细胞来源或移植预处理方案对移植决策的影响。

MRD状态如何影响CR1期AML患者的移植决策?
随着检测工具越来越敏感,可以检测到低于5%骨髓原细胞的临界值,MRD的临床相关性已经成为一个重要的研究领域。对于具有可检测疾病(包括具体到MRD)时进行移植的患者,allo-HCT后复发的风险显著增加。十年前MRD被视为一种“潜在的关键工具”,而目前MRD对预后和临床管理的价值极高,且独立于突变谱和细胞遗传学,然而许多问题仍未得到解答。
复杂性之一在于MRD本身的定义以及如何最好地检测持续的低水平病变,其中的固有问题是现有MRD测定法的灵敏度差异。目前有三种主要的MRD测量方法:多参数流式细胞术(MFC)、二代测序(NGS)和特定突变(NPM1、RUNX-RUNX1T1、CBFB-MYH1、KMT2A-MLLT3)的聚合酶链反应(PCR)。MFC的灵敏度为10-3~10-4,PCR的灵敏度为10-4~10-5,而NGS的灵敏度尚未确定。然而即使在没有检测到MRD的患者中,仍可能持续存在残留的白血病。此外,靶向MRD检测并不适用于所有患者,因为大多数患者没有易识别的突变。因此,MFC检测的MRD(部分患者中可以NGS)具有更广泛的适用性。MRD检测的局限性之一在于跨机构的对比解释可能很困难。靶向分子学异常的作用仍是一个研究中的领域,例如通过NGS监测FLT3-ITD MRD,因其具有新兴的预后价值。
MRD在移植决策中的作用源于对NPM1突变AML的研究:Ivey等人的一项研究表明,在两个周期的强化化疗后,通过逆转录PCR检测到NPM1突变的持续MRD,则治疗后3年复发风险为82%,而MRD阴性的复发风险为30%。Balsat等人探索了通过血液NPM1-MRD的减少对患者进行分层时生存率是否有所不同,表明只有在诱导后NMP1突变转录物减少少于4个对数的患者中,allo-HCT才有生存获益。
核心结合因子(CBF) AML情况类似,其中MRD状态与治疗反应相关,因此有助于指导移植决策。在一项针对t(8;21) AML患者的前瞻性研究中,allo-HCT可降低诱导和两个巩固周期后MRD阳性患者的复发风险;其他CBF AML的前瞻性研究则强调,在多变量分析中,MRD减少而非分子谱是关键预后因素。即使在中危患者中,MRD也可发挥作用:在一项基于分子学/细胞遗传学和MRD决定年轻患者移植策略的研究中,诱导和巩固后MRD阳性的中危患者(NCCN 2009,版本1)可受益于allo-HCT,其结局与低危患者相当。综上所述,对于低危患者(以及部分中危患者),仅凭分子学特征可能无需考虑CR1期allo-HCT,但MRD持续存在可提示考虑移植。
十多年来的研究证实移植时存在MRD可增加复发风险并降低总生存期(OS)。与此相一致,许多研究表明,通过各种MRD检测策略,移植前MRD阳性患者移植后复发的风险增加。然而一个固有限制在于混杂变量,如高危细胞遗传学高发生率,特别是在MRD阳性患者中,可能反映出潜在的疾病生物学。
Araki等人的一项分析解决了一个基本问题:与形态学活动性患者相比,移植时MRD阳性患者的预后是更好、更差还是相似?虽然是回顾性的,但该研究证实形态学活动性患者的OS或PFS与MRD阳性患者没有差异。
然而allo-HCT时MRD阳性并不一定预示着复发。在一项研究中,移植时MFC检测MRD+患者中26%在移植后3年存活,尽管部分患者可能复发。令人困惑的是,分子MRD评估也可以识别克隆造血引起的遗传改变,如ASXL1、DNMT3A和TET2突变,但这些突变无法预测复发风险,也不应该引发临床干预。此外有报道称,在长期形态学缓解的情况下,CBF AML患者持续检测到RUNX1-RUNX1T1融合转录。
新出现的数据强调突变谱可能与MRD清除有关:虽然NPM1、IDH或KRAS突变的患者可能更有可能实现MRD阴性CR,但RUNX1-、SF3B1-或tp53突变的患者不太可能实现缓解。研究的一个关键领域为确定哪些患者可受益于MRD引导治疗,然后再进行allo-HCT。
最后,尽管超出了本文的重点,但对于MRD阳性患者进行移植,很多研究试图探索预处理方案、异基因移植来源和移植后维持策略如何减少这一特别高危群体的复发。
细胞遗传学和分子遗传学的影响
新诊断AML患者通常根据其低危、中危或高危遗传学异常分为不同风险类别。虽然低危AML患者也很难使用“预后良好”这一术语,但很明显的是,这一组中遗传学或分子学异常的患者仍比其他组的患者更好,即使其中部分患者仍会死于疾病。
CR1时allo-HCT的获益随复发风险而变化,与细胞遗传学和分子学亚类有关。在过去的20年里这一概念已经融入到治疗策略中,必须在谨慎评估风险/收益的基础上决定是否采用allo-HCT。一般来说,中危和高危患者可获益于CR1期移植,而低危患者有足够的无复发生存期(RFS),足以放弃移植。然而这些定义仍在不断演变,以适应进一步的遗传学、分子学和临床数据。
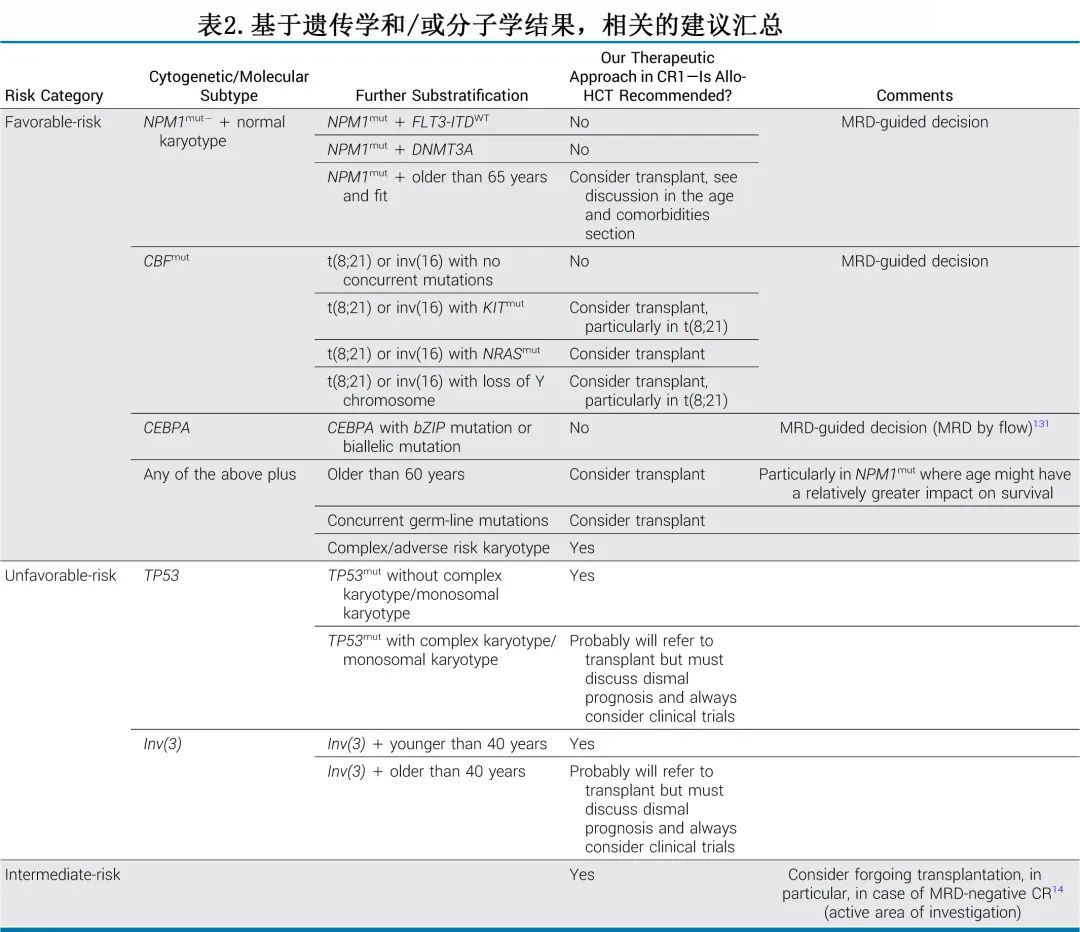
本节的重点在于存在特别争议或关注的亚组上(表2),将回顾由于预后相对较差而确实可能从移植中获益的低危组内亚型,并探讨了高危组以评估移植的真正获益。
低危AML
NPM1突变
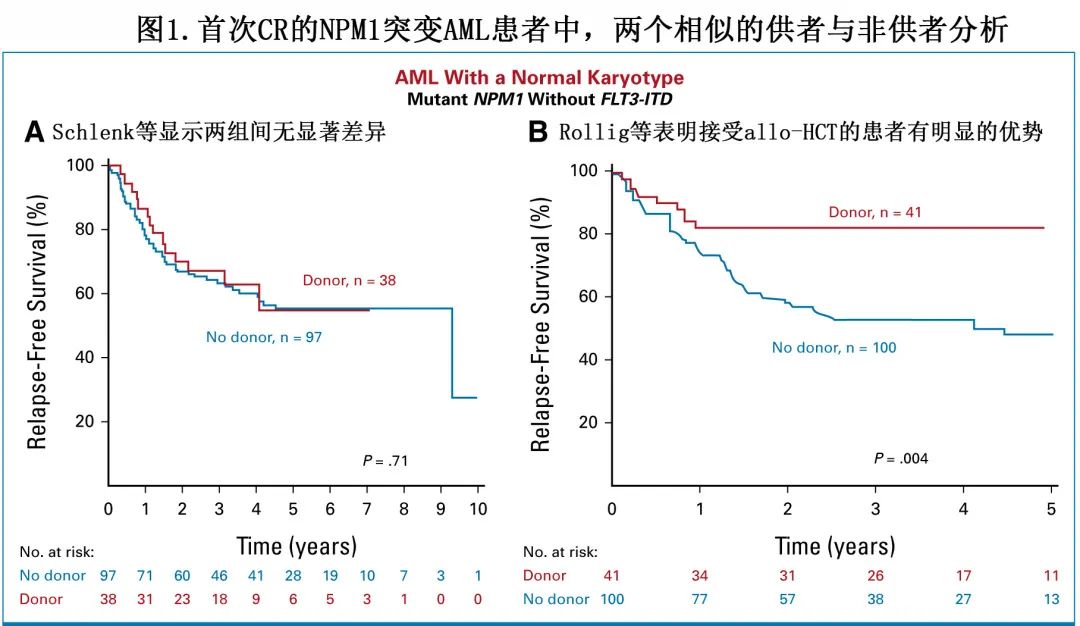
NPM1是AML中最常见的遗传异常之一,20%-30%的新诊断患者携带,其中核型正常的患者携带该突变一般预后相对较好。15年前这类患者与其他核型正常的患者类似,通常划分为中危组,并在CR1进行allo-HCT,但2008年德-奥AML研究小组发布报告后,该做法发生了变化。该研究基于四项前瞻性临床试验的汇总分析,并使用了供者(donor)与非供者(no-donor)分析。38例有供者的NPM1突变患者(其中约30人实际上接受了移植)与97例无供者的患者相比没有明显的生存优势。但SAL-AML 2003研究(同样基于供者与非供者分析,包括几乎相同的数字)却描述了完全相反的结论,报告了NPM1mut患者使用allo-HCT的明显RFS获益(图1)。尽管缺乏证据,但目前普遍做法已经坚定地将这一亚组AML患者置于低危类别中,不建议CR1进行移植。这个难题未来不太可能得到评估,因此作者机构与主流观点一致,不常规给予这类患者移植,但MRD阳性患者除外。
NPM1和FLT3-ITD突变
2005年在首次发现NPM1突变在AML中具有重要意义后,人们发现该突变通常与其他突变同时发生。D¨ohner等人率先证明了合并FLT3-ITD突变的不良预后影响。在2010年ELN指南中,NPM1mut合并FLT3-ITDmut AML归为中危。随着分子学检测方法的改进,等位基因比例(AR)的重要性业逐渐显现,有研究表明只有高AR的FLT3-ITD突变才会给NPM1mut患者带来不良预后。在2017年ELN指南的更新中,如果AR<0.5,则NPM1mut和FLT3-ITDmut患者重新分类为低危类别,且这一区分很快被一些治疗指南采用。但这一观点最近受到了研究的挑战,这些研究表明,无论AR状态如何,NPM1mut伴FLT3-ITDmut均受益于allo-HCT。因此最近的2022年ELN指南中,AR在分类中被省略,中危类别已包括任何水平的FLT3-ITD突变。实际上,作者为所有FLT3-ITD突变患者提供移植,不考虑等位基因水平或NPM1状态。尽管2022年ELN指南提供了一些新颖的变化,但这些变化是否被广泛采用或在进一步的研究中得到证实,仍有待观察,就像2017年关于低AR FLT3突变的ELN指南未被统一采用一样。
NPM1和DNMT3A突变
在首次报道AML患者的DNMT3A突变后,Ley等人认为其与较低的OS和无事件生存期(EFS)相关;但某些组合似乎比其他组合预后更差。因此,虽然NPM1mut和DNMT3Amut单独共存可能不会对预后产生不利影响,但DNMT3A、NPM1和FLT3-ITD突变之间似乎存在三方相互作用,从而对生存产生负面影响。ELN 2022指南并未将NPM1mut和DNMT3Amut共存患者从低危类别排除,最近的数据也与此一致。因此,如果只有NPM1mut和DNMT3Amut分子学异常,作者不会在CR1时移植。
NPM1突变伴核型异常
2019年的一项META分析认为细胞遗传学风险类别应占主导地位,因此当NPM1突变与高危细胞遗传学共存时,这些患者的预后同样较差。随后,在最近的ELN 2022指南中,增加了一个新的类别——NPM1mutAML伴高危细胞遗传学,并将其纳入高危组。在实践中只有高危细胞遗传学才能否决NPM1突变的获益。
CBF突变
CBF属于在正常造血中起重要作用的转录因子家族,涉及CBF的两种不同异常包括t(8;21)和inv(16)(p13q22),具有这些异常的患者归为CBF-AML类别,约占成人AML的15%,并且被认为具有足够良好的预后,可以在CR1放弃allo-HCT。尽管CBF-AML的缓解率很高,复发率也很高。此外,CBF-AML的基因组特征已经确定了几个亚组,这些亚组似乎具有不同的结局。
共存KIT突变
KIT突变发生于大约1/3的CBF-AML中。KIT突变对CBF-AML患者预后的影响在20多年前进行了研究,但由于样本量少而数据相互矛盾。随后Paschka等人检查了当时最大的患者队列,确定KIT突变在inv(16)患者中具有不良预后。然而许多研究表明,KIT突变的存在与t(8;21)患者预后较差相关,而与inv(16)患者无关。另一项研究报告了KIT突变对两种类型的CBF-AML患者的有害影响。然而另一个报告KIT无预后价值。一项评估KIT突变对预后影响的META分析称,共存KIT突变并不影响inv(16)或t(8;21)的CR,但仅在t(8;21)例患者中确实增加复发风险并缩短OS。然而许多这样的研究中接受allo-HCT的患者通常排除于分析之外,从而进一步混淆了数据。值得注意的是,尽管大多数研究将不同的KIT突变归类在一起,但也有研究表明是KIT外显子17突变导致CBF-AML的不良预后。
这些数据显然是相互矛盾的,不鼓励采取教条主义的方法。2017年和2022年的ELN指南未将KIT突变从低危类别中删除,而2019年的NCCN指南建议将这些患者作为中危治疗,不过这些指南仍在动态变化。
CBF-AML中其他细胞遗传学和分子学异常
与NPM1突变一样,数据表明共存FLT3-ITD突变对CBF-AML结局有不利影响。最近的一项前瞻性研究表明,inv(16) AML中存在NRAS突变也与RFS呈负相关。
另一个混杂因素为突变负荷,尽管其可能影响KIT和FLT3-ITD突变的预后,但在许多研究中并未考虑到这一点。
细胞遗传学也与结局有关。例如22三体与inv(16)共存似乎是预后良好的独立因素,而t (8;21)男性中Y染色体的缺失会对生存产生负面影响。一项回顾性研究描述了AML患者的一个亚组,其中包含inv(16)、FLT3-ITD和22三体;这些患者似乎对化疗特别敏感,可归类为低危,不考虑FLT3-ITD状态。
继发性病变与不良结局的单纯关联并不一定意味着移植有获益,例如一项研究表明,在t(8;21)的Y染色体缺失患者中,移植相关死亡率会抵消allo-HCT的获益。在一项前瞻性研究中,198例CBF-AML患者接受两种不同的诱导方案治疗,然后根据治疗反应进行allo-HCT;多变量分析显示,同时存在KIT或FLT3-ITD突变无不良影响。
鉴于报告相互矛盾、实践建议存在差异以及缺乏明确数据,作者通常只考虑下列患者进行移植:CBF突变同时携带高危核型或FLT3-ITDmut或高危KIT突变,但除外携带22三体的inv(16)患者;当然MRD也应该考虑(如上文所述)。
CEBPA突变
CCAAT增强结合蛋白α (CEBPA)在7%-20%的AML患者中存在且预后良好,共定义了两种不同的突变类型,进一步的研究表明,良好的预后似乎仅限于携带双等位基因突变的患者;研究未报道双等位基因CEBPA患者allo-HCT后OS得到改善。
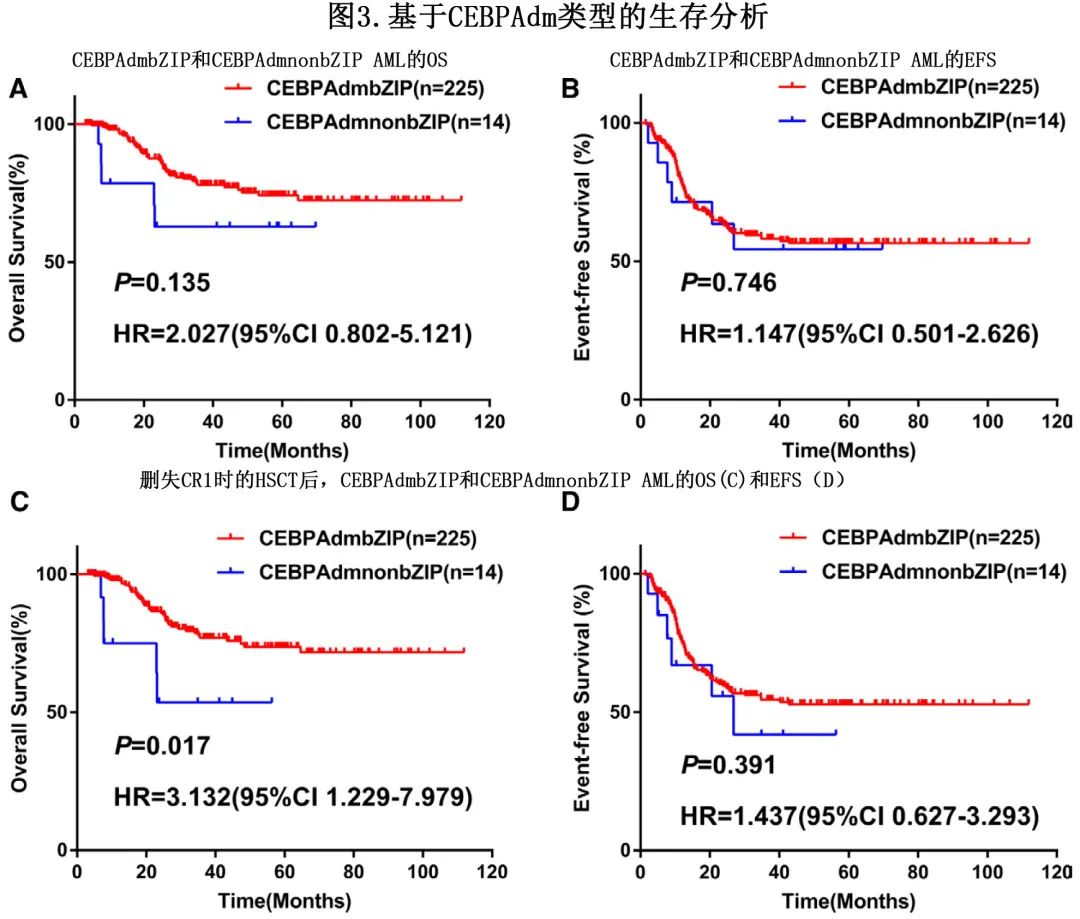
2017年ELN指南及2016年WHO分类仅将双等位基因CEBPA突变指定为低危类别,但该分类最近受到了挑战。在一项对近5000名AML患者的回顾性研究中,CEBPA的碱性亮氨酸拉链区(bZIP)的特异性框内突变(in-frame mutation)与良好的预后相关,而非等位基因状态。bZIP与双等位基因突变之间的强相关性可以解释,为什么后者最初被认为是不良结局较少的重要标志。随后,最近的ELN指南用框内bZIP CEBPA突变(双等位基因或单等位基因)取代了既往的双等位基因定义,以确定低危类别,而新的世卫组织分类则包括两种定义。
这强调了基因组分层仅限于可以测量的部分,并且是不断变化的。在更多的证实性研究报告之前,作则不会对CR1双等位基因CEBPA突变的患者进行移植。
高危AML
高危AML患者很少能通过目前的治疗方法获得长期生存,存活率令人失望,部分人认为常规移植可能是徒劳的。Yanada等人对五项研究进行了META分析,显示高危细胞遗传学患者使用allo-HCT有获益。随后的研究似乎与此一致,尤其是年轻的高危患者。高危患者中缺乏移植与不移植的结局对比,主要是因为基本都进行了移植。
当检查确实存在的数据时,尽管样本量很小,但移植的获益似乎仍不确定,特别是在极高危的患者中。例如在复杂核型AML伴TP53mut的亚分析中,15例CR1移植的患者中有14例复发并死亡。其他研究表明,无论是否在CR1移植,特定的单体型(monosomies)预后都很差;对于这一极高危亚组,尚缺乏令人信服的证据证明CR1移植的获益。
然而由于缺乏替代治疗策略或在高危患者中进行随机试验的伦理问题,如果患者达到CR1仍可能会进行移植。同样,在作者的机构中所有这样的患者都在CR1移植。如果这些患者进行allo-HCT,最好采用一种提供新颖移植策略的方案进行治疗。此外,与低危组一样,高危患者之间也存在显著的异质性,因此进一步的分层可能具有预后意义,并且可能特定患者中移植的获益更为明确。
TP53突变
大约10%的患者携带tp53突变,其与不良预后和对化疗反应不足有关。有一个极高危遗传风险组,包括存在TP53突变与复杂核型,主要是5q、7q和/或17p缺失。一个相似但不完全重叠的分类,定义单体型为两个或多个常染色体单体或单个单体伴其他结构异常。有一些互补数据来自最近欧洲血液和骨髓移植协会审查委员会,分析了179例TP53突变AML患者CR1移植的结果,并与601例无突变的患者进行比较;研究确定了一个亚组,他们携带TP53突变但没有并发复杂核型或17p缺失,其移植后的OS与无TP53突变的患者惊人地相似。因此,TP53突变本身可能不会导致不良预后,但可能是复杂核型、TP53活性双等位基因缺失或单体核型的替代标志物。正在研究的其他因素包括突变负荷和各种突变的数量以及与结局的相关性,其中变异等位基因频率(Variant allele frequency,VAF),特别是在TP53mut AML中,可能相当重要。一项研究明确指出,VAF每增加1%与死亡风险增加1%相关。上述定义可用于区分高危患者中哪些特定亚组比其他亚组更可能从allo-HCT中获益。
INV(3)
另一种罕见的高危亚型为inv(3)(q21;Q26.2)或t(3;3)(q21; Q26.2)。发生率仅1%,因此很少有数据表明CR1 allo-HCT的获益。一项研究描述了CR1移植患者的2年生存率为23.8%,另一项研究的5年生存率高达44%,表明移植可能会带来一些好处,特别是在年轻患者中。
在作者的实践中,对于任何达到CR1的高危细胞遗传学AML患者,都会考虑移植,因其复发风险很高,其中部分患者会达到有意义的DFS(表1)。
遗传突变
最近出现的一个需要考虑的因素为共存胚系(germline)突变。有研究建议,在患者有家族史的情况下,应对AML患者进行遗传性髓系恶性综合征筛查,如果检测到胚系突变,无论风险类别如何,都应考虑allo-HCT。但这是一个高度动态的研究领域,还需更多的研究来进一步指导临床实践。
年龄和合并症
尽管深入研究患者移植合格性超出了本文的范围,但很明显仍必须考虑年龄和合并症,特别是它们对NRM的影响。一些基于统计的工具已经被创建并验证用于预测AML的NRM,包括基于机器学习的算法。
在控制了其他合并症后,年龄成为移植环境中一个独立的预后因素。在一项试图验证ELN 2017风险分层系统预后意义的大型研究中,一个有趣的发现与≥75岁患者亚组有关:即使属于低危组也与更好的结局无关。存在一个悬而未决的问题,这是由于年龄本身还是疾病生物学?这对60-75岁的患者尤其重要,他们通常足够健康,可以考虑进行移植。值得注意的是,许多为低危组患者的分类提供证据的关键研究排除了≥60岁的患者,因此这个年龄段的移植缺乏明确的指南。目前作者指导临床决策更关注的是患者的健康状况,而非实际年龄。
新药是否影响CR1患者移植的决策?
2017年至2023年间FDA批准了10种治疗AML的新药,这些药物将提高CR率,从而影响CR1进行allo-HCT的决策,然而总的来说情况并非如此。大多数情况下,白血病细胞的遗传因素会影响CR1患者进行allo-HCT的决策,例如与化疗相比,FLT3抑制剂midostaurin可改善CR1患者的生存,但无法改善CR;而第二代FLT3抑制剂显示出巨大的前景。因此,FLT3抑制剂并不直接影响CR1进行allo-HCT的决策,而存在FLT3-ITD突变会促使这样的决策。
在几项针对低危和可能中危患者的研究中,50-70岁初治AML患者中Gemtuzumab ozogamicin (GO)联合化疗显示出EFS优势。然而由于预后良好,CBF AML患者通常不会接受allo-HCT。同样,应当是特异性突变决定GO在CR1中allo-HCT的推荐,而非GO的可用性。
BCL-2抑制剂联合去甲基化药物(HMA)或低剂量阿糖胞苷对高危患者有效。HMA+维奈克拉在中危和高危患者中具有诱导CR的能力,并且经常实现MRD阴性CR1,尽管缺乏移植后的长期数据,但该方案可使更多患者能够在CR1进行allo-HCT。然而,决定哪些患者可能受益于CR1的allo-HCT是由白血病细胞遗传学和分子遗传学所驱动。
总之,为CR1 AML患者提供移植的决策已经发展了40多年。早期只进行同胞移植,而且AML是通用的,因此所有患者均给予移植,包括APL患者!在20世纪80年代后期,AML的生物多样性被报道,临床实践因此发生了巨大变化,突然间并不是所有患者都适合在CR1进行allo-HCT,预后因细胞遗传学亚型而异。从那时起,利用分子基因组学的进步和定义残留疾病的创新技术,对CR1 AML的预测有了稳步的改进。在这篇综述中作者考虑了这些因素,强调在有希望的地方进行移植的必要性,并在患者无需移植即可治愈的时候“退后一步”。
参考文献
DeWolf S, et al. What Infl uences the Decision to Proceed to Transplant for Patients With AML in First Remission?J Clin Oncol . 2023 Aug 23;JCO2202868. doi: 10.1200/JCO.22.02868.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












新知识,新收获!!
85