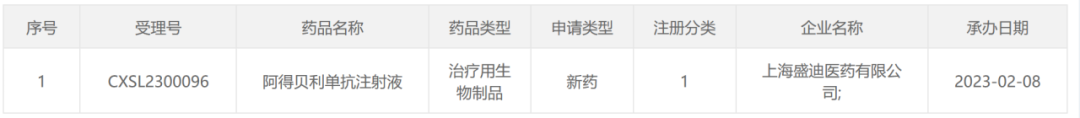
国内获批上市的5款PD-L1抑制剂
2023-03-26 精准药物 网络 发表于上海
国内获批上市的5款PD-L1抑制剂:阿得贝利单抗、舒格利单抗、恩沃利单抗、阿替利珠单抗和度伐利尤单抗。
前言
近日,中国国家药品监督管理局(NMPA)官网公示,由恒瑞医药自主研发的PD-L1抑制剂阿得贝利单抗获批上市。这是国内第5款获批上市的PD-L1抑制剂。
随着肿瘤免疫治疗时代的到来,PD-1抑制剂市场不断扩大,越来越多的患者从中获益。相比之下,PD-L1抑制剂的市场规模较小,赛道前景相对广阔。该情形下,阿得贝利单抗获批上市造就了PD-L1抑制剂“五足鼎立”的局面,那么,谁能更胜一筹?
本期内容,小编将回溯科研长河,带领大家全面认识国内5款已获批上市的PD-L1抑制剂。
作者|高山子
01
度伐利尤单抗
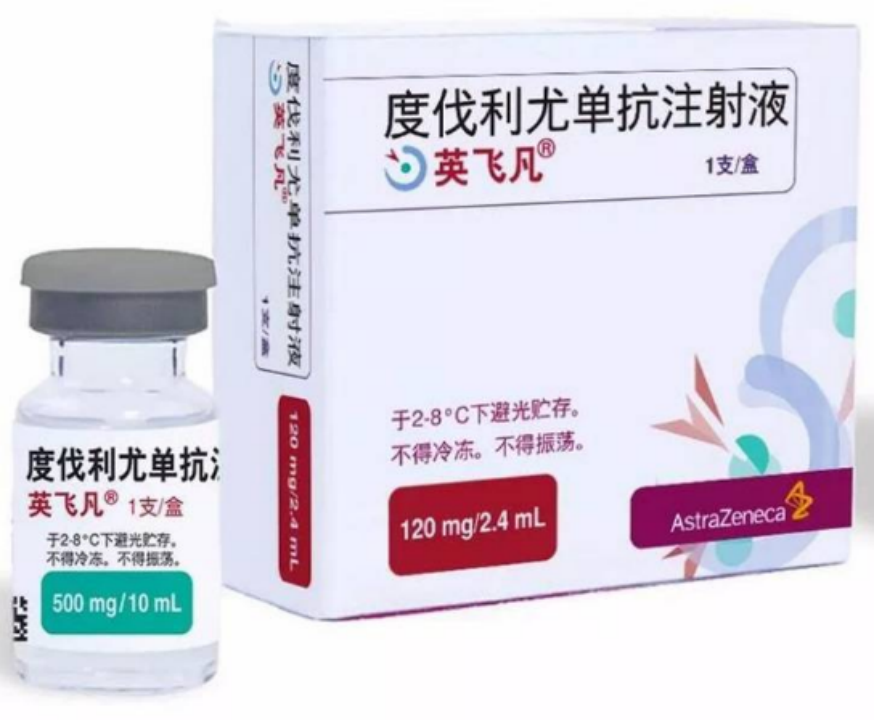
2019年12月9日,NMPA批准阿斯利康重磅PD-L1抑制剂度伐利尤单抗用于治疗经同步放化疗后无疾病进展的不可切除、III期非小细胞肺癌(NSCLC)(图1)。作为我国首款获批上市的PD-L1抑制剂,度伐利尤单抗开启了III期NSCLC免疫治疗的新时代。
图1 度伐利尤单抗获批上市(来源:NMPA官网)
1.1 药物介绍
约三分之一NSCLC患者确诊时即为III期(局部晚期)非小细胞肺癌(LA-NSCLC),其异质性较强,可根据癌细胞的局部转移范围和能否进行手术切除,分为IIIA、IIIB和IIIC三种类型。大部分LA-NSCLC患者不可手术切除,既往治疗以放疗同步含铂双药化疗为主,但患者预后普遍较差,5年生存率仅为15%。
随着对免疫检查点抑制剂的研究越来越深入,发现度伐利尤单抗作为一种具有选择性、高亲和力的人源化IgG1型抗PD-L1单克隆抗体,可阻断PD-L1、PD-1及CD80的结合,从而阻断肿瘤免疫逃逸并释放被抑制的免疫反应。
1.2 研究介绍
度伐利尤单抗获批是基于一项随机、双盲、安慰剂对照的国际多中心III期PACIFIC临床研究,该研究旨在评估度伐利尤单抗用于III期不可切除NSCLC患者标准含铂方案同步放化疗后巩固治疗的疗效。研究的共同主要终点为无进展生存期(PFS)和总生存期(OS)。
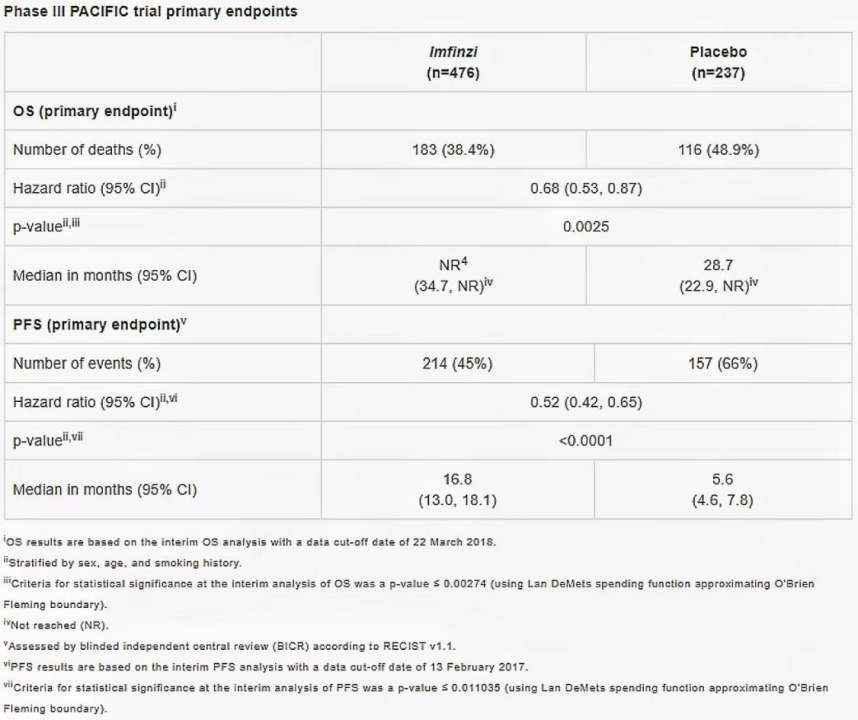
图2 PACIFIC研究主要终点结果
1.3 销售概况
阿斯利康最新发布的2022年度业绩报告显示,公司全年总营收443.51亿美元,同比增长19%。其中,度伐利尤单抗年度销售额为27.84亿美元,同比增长21%,位居阿斯利康年度药品销售收入排行榜第四,排位较2021年上升1位。
价格方面,度伐利尤单抗作为进口药较为昂贵,且尚未进入医保,目前定价为18088元/500mg、6066元/120mg。值得注意的是,其已参加慈善赠药计划,具体执行方案为:低收入患者[2+2;4+4;6+8],低保患者免费至疾病进展,综合下来,患者治疗费用最低约为14.5万/年。
02
阿替利珠单抗

2020年2月13日,NMPA批准罗氏重磅肿瘤免疫创新药物阿替利珠单抗联合化疗用于一线治疗广泛期小细胞肺癌(ES-SCLC)(图3)。这意味着中国ES-SCLC迎来首款免疫疗法,同时也标志着罗氏正式步入中国肿瘤免疫治疗领域。

图3 阿替利珠单抗获批上市(来源:NMPA官网)
2.1 药物介绍
SCLC是一种侵袭性强、预后差的高度恶性肿瘤,可根据病灶累及范围将其分为局限期和广泛期,约三分之二SCLC确诊时即处于广泛期。ES-SCLC的标准一线治疗方案为以铂类为基础的化疗,但患者预后较差,中位OS仅约10个月。
阿替利珠单抗作为一种靶向PD-L1的人源化单克隆抗体,可阻断肿瘤细胞表达的PD-L1和免疫细胞上的PD-1与B7.1受体相互作用,并激活人体免疫系统T细胞攻击肿瘤细胞,从而实现清除肿瘤细胞的目的。
2.2 研究介绍
阿替利珠单抗基于IMpower133研究在华获批上市,该研究是一项多中心、随机、双盲、安慰剂对照试验,旨在评估阿替利珠单抗联合依托泊苷+卡铂(EC)化疗一线治疗ES-SCLC的疗效和安全性。研究的主要终点为PFS和OS。
结果显示,中位随访13.9个月,阿替利珠单抗组中位OS较安慰剂组显著延长2个月(12.3个月 vs. 10.3个月,HR=0.70;P=0.007),降低患者死亡风险30%,两组的中位PFS分别为5.2个月 vs. 4.3个月(HR=0.77;P=0.02)(图4)。未发现新的安全性信号。研究证实,阿替利珠单抗联合依托泊苷+卡铂(EC)化疗一线治疗ES-SCLC可显著延长患者PFS和OS,且安全性良好。
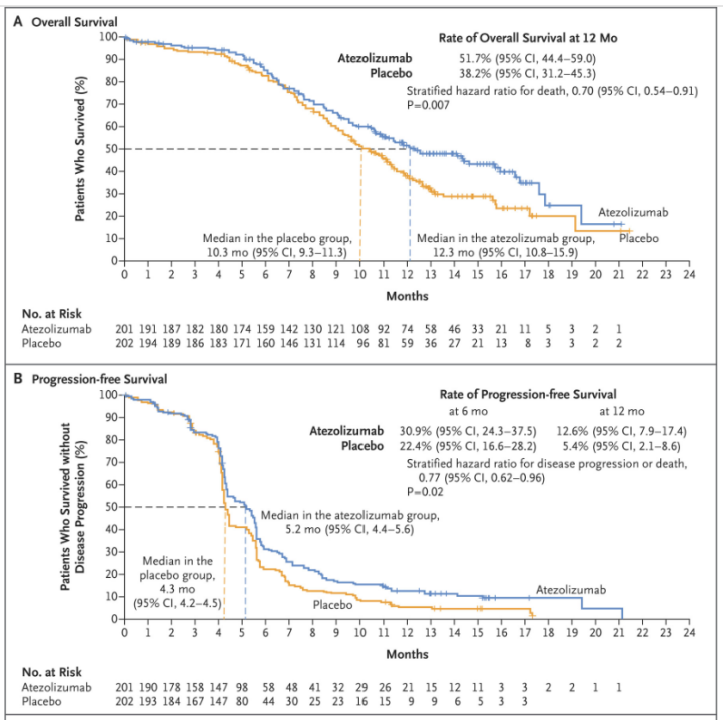
图4 IMpower133研究主要终点结果
2.3 销售概况
罗氏最新发布的2022年度业绩报告显示,公司全年总营收632.81亿瑞士法郎,同比增长 2%。其中,阿替利珠单抗年度销售额为37.17亿瑞士法郎,同比增长14%,位居罗氏年度药品销售收入排行榜第四,排位较前3Q没有变化。
03
恩沃利单抗

2021年11月25日,NMPA公示,由四川思路康瑞药业自主研发的创新PD-L1抑制剂恩沃利单抗获批上市(图5)。适用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗,包括既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者以及既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。
图5 恩沃利单抗获批上市(来源:NMPA官网)
3.1 药物介绍
MSI-H/dMMR是目前预测免疫治疗疗效最重要的生物标志物之一,已被应用于包括胃癌和结直肠癌在内的多种晚期实体瘤免疫治疗优势人群筛选。
作为我国首款原研获批的PD-L1抑制剂,恩沃利单抗是一种重组人源化PD-L1单域抗体Fc融合蛋白注射液,可结合人PD-L1蛋白,并阻断其与受体PD-1的相互作用,解除肿瘤通过PD-1/PD-L1途径对T细胞的抑制作用,从而调动免疫系统的抗肿瘤活性杀伤肿瘤。此外,恩沃利单抗作为一款可用于皮下注射的抗PD-L1单克隆抗体,患者依从性和便利性也更好。
3.2 研究介绍
恩沃利单抗本次获批是基于一项单臂多中心II 期临床研究,该研究旨在评估其治疗晚期MSI-H/dMMR实体瘤患者的疗效及安全性。研究的主要终点为独立审评委员会(BIRC)根据RESIST v 1.1评价确认的ORR。
结果显示,恩沃利单抗单药用于103例MSI-H/dMMR实体瘤患者二线以上治疗的ORR为42.7%,其中包括65例结直肠癌(CRC)患者,ORR达43.1%。中位PFS为11.1个月,1年OS率为74.6%(图6)。药物安全性可接受。研究证实,恩沃利单抗在MSI-H/dMMR晚期实体瘤患者中具有良好的治疗价值。

图6 恩沃利单抗治疗中国MSI-H/dMMR实体瘤患者疗效
3.3 销售概况
价格方面,相比其他免疫抑制剂每年数十万的高昂费用,恩沃利单抗表现的十分友好,目前定价为5980元/200mg,加之[4 赠4+8赠PD]的慈善赠药方案,患者治疗费用最低仅约3.6万/年,极大减轻了患者经济负担,更适合长期使用。
较为遗憾的是,随着最新医保目录公布,恩沃利单抗惨遭出局。期待未来推动进入医保,惠及更多患者。
04
舒格利单抗

2021年12月21日,NMPA公示,由基石药业研发的PD-L1抑制剂舒格利单抗获批上市(图7),适用于联合培美曲塞和卡铂一线治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状NSCLC患者,以及联合紫杉醇和卡铂一线治疗转移性鳞状NSCLC患者。
图7 舒格利单抗获批上市(来源:NMPA官网)
4.1 药物介绍
作为我国第二款原研获批的PD-L1抑制剂,舒格利单抗是一种全人源全长抗PD-L1的IgG4单克隆抗体,可阻断PD-L1与T细胞上PD-1和免疫细胞上CD80间的相互作用,通过消除PD-L1对细胞毒性T细胞的免疫抑制作用,发挥抗肿瘤作用。
4.2 研究介绍
舒格利单抗本次获批是基于一项多中心、随机、双盲的III期研究GEMSTONE-302的积极结果,该研究旨在评估舒格利单抗联合化疗对比安慰剂联合化疗,在未经一线治疗的、IV期NSCLC患者中的有效性和安全性。研究的主要终点为研究者评估的PFS。
结果显示,中位随访18个月,舒格利单抗组可显著延长患者中位PFS 4.1个月(9.0个月 vs. 4.9个月[HR=0.48,P<0.0001]),两组的12个月PFS率分别为36.4%和14.8%,患者疾病进展或死亡风险显著降低52%。两组的ORR分别为63.4% vs. 40.3%,中位缓解持续时间(DOR)分别为9.8个月 vs. 4.4个月(图8)。药物安全性良好。研究证实,舒格利单抗联合化疗疗效优异,安全性可靠。
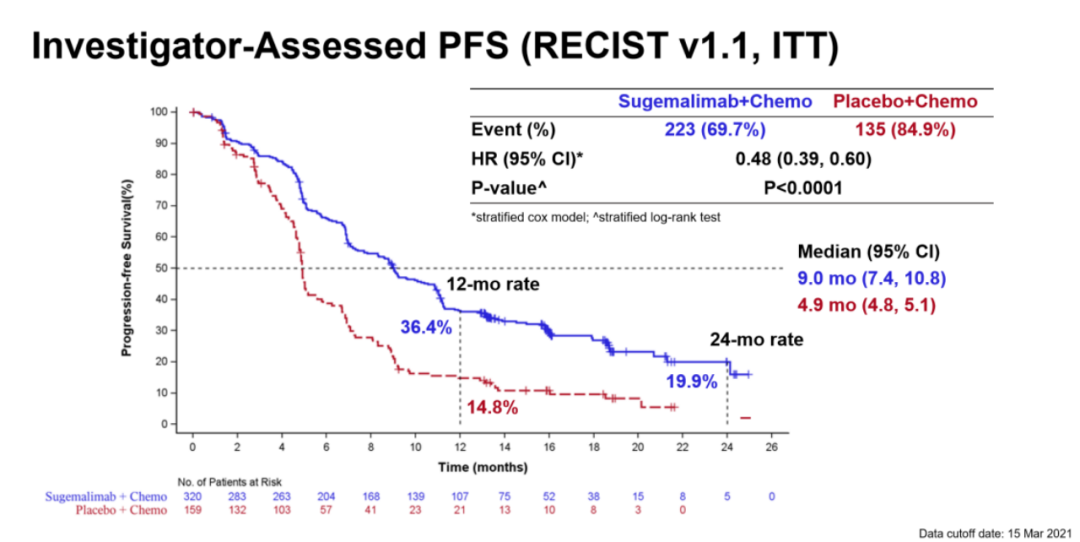
图8 GEMSTONE-302研究结果
4.3 销售概况
基石药业最新发布的2022年度业绩报告显示,公司全年总收入为4.814亿人民币,包括商业化收入3.941亿人民币,其中,舒格利单抗特许权使用费收入为2980万人民币,同比增长142%。
价格方面,目前定价为12375元/600mg,且尚未进入医保,但最新慈善赠药方案是[2+2;2+25;1+3],综合下来,患者治疗费用最低约为61875元/年,价格适中,大部分患者可以负担。
05
阿得贝利单抗
2023年3月3日,NMPA公示,由恒瑞医药自主研发的PD-L1抑制剂阿得贝利单抗获批上市(图9),用于联合卡铂和依托泊苷一线治疗ES-SCLC。阿得贝利单抗成为我国首款获批SCLC适应症的自主研发PD-L1抑制剂,打破了进口PD-L1抑制剂在这一领域的垄断地位,为广大患者带来全新治疗选择的同时再次力证了我国自主研发创新药物的雄厚实力。
图9 阿得贝利单抗获批上市(来源:NMPA官网)
5.1 药物介绍
作为中国首款自主研发获批ES-SCLC适应症的PD-L1抑制剂,阿得贝利单抗是一种人源化抗PD-L1单克隆抗体,能够通过特异性结合PD-L1分子从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活免疫系统的抗肿瘤活性,从而达到治疗肿瘤的目的。
5.2 研究介绍
阿得贝利单抗本次获批基于一项随机、双盲、安慰剂对照Ⅲ期临床研究CAPSTONE-1的积极研究结果,该研究旨在评估阿得贝利单抗或安慰剂联合依托泊苷和卡铂一线治疗ES-SCLC的有效性和安全性。研究的主要终点为接受至少一种研究药物治疗患者的OS。
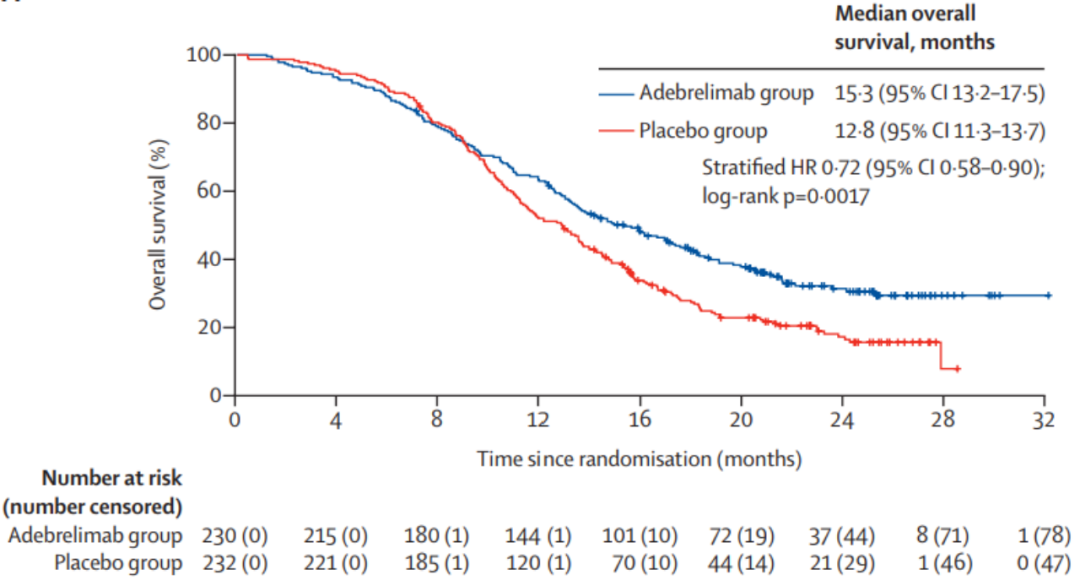
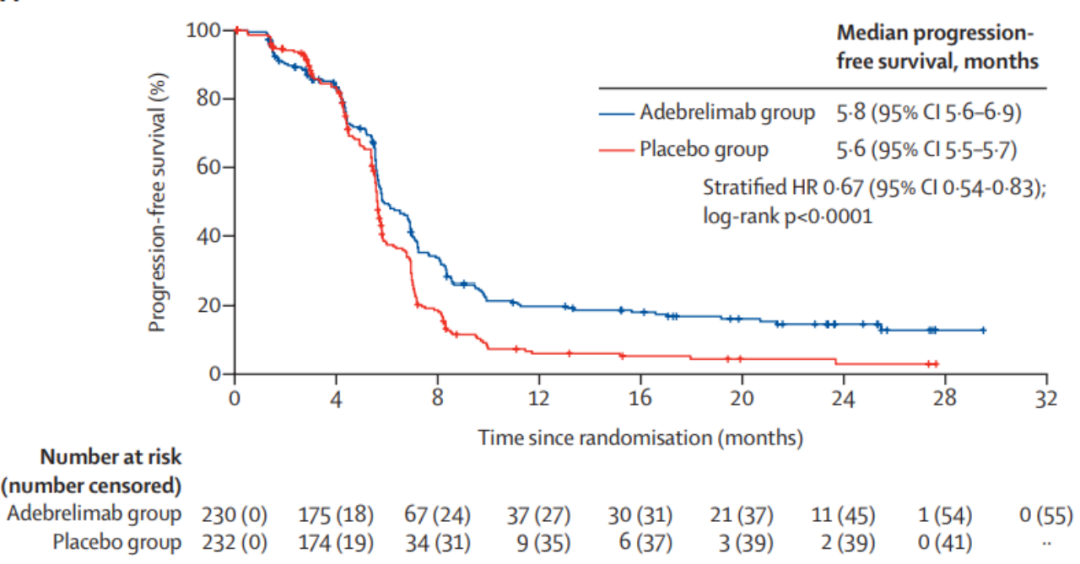
结果显示,阿得贝利单抗组较安慰剂组可显著延长患者中位OS(15.3个月 vs. 12.8个月),患者死亡风险降低28%,两组的2年OS率分别为31.3% vs. 17.2%(图10)。同时,阿得贝利单抗组中位PFS为5.8个月,降低患者疾病进展风险33%,1年PFS率达安慰剂组3倍多(19.7% vs. 5.9%)(图11)。药物安全性良好。研究证实,阿得贝利单抗联合化疗可作为ES-SCLC一线治疗的新选择。
5.3 销售概况
价格方面,阿得贝利单抗目前定价为9500元/600mg,据悉,其赠药政策为[3+3;2+2],患者治疗费用最低约为16.5万/年。
据了解,药物获批上市仅1个工作日,恒瑞医药子公司苏州盛迪亚生物医药有限公司便举行发货仪式,首批阿得贝利单抗从苏州出发,正式发往全国药房,创下创新药物供应的新纪录。相信阿得贝利单抗未来将不负众望,为万千患者带来优质药物新选择。
总结
回溯我国PD-L1抑制剂历史长河,从国外垄断,到自主原研,国家肿瘤免疫治疗事业高速发展。此次阿得贝利单抗获批上市,彰显了我国学者、原研药物、临床研究稳步前进的实力。
期待未来在精准免疫治疗领域取得更多突破,力争成为赛道领跑者。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#阿得贝利单抗#、#舒格利单抗#、#恩沃利单抗#、#阿替利珠单抗#和#度伐利尤单抗#
104