Cancer research:张会来教授团队揭示CD58基因变异调控抗肿瘤免疫反应的新机制
2024-05-04 聊聊血液 聊聊血液 发表于上海
该研究揭示了CD58缺失或突变通过LYN/CD22/SHP1-JAK2/STAT1轴上调PD-L1及IDO表达,促进细胞毒性T细胞和CAR-T细胞免疫杀伤能力减弱,最终导致肿瘤免疫逃逸的全新机制。
CD58基因变异
免疫监视相关基因的频繁异常在弥漫大B细胞淋巴瘤(DLBCL)的疾病进展过程中起着重要作用。CD58作为一种重要免疫调控分子,其受体CD2通常表达在T或NK细胞表面,CD58与CD2结合在维持肿瘤微环境中T或NK细胞活化和抗肿瘤免疫应答过程发挥重要作用。然而肿瘤组织中CD58常常发生基因变异,这些变异包括缺失或突变,其中在血液系统恶性肿瘤中表现尤为频繁。过去研究显示,CD58基因变异(缺失或突变)将影响CD58-CD2轴、促进细胞毒性T细胞和NK细胞活化不足,导致肿瘤细胞逃避免疫监视,最终促进肿瘤免疫逃逸[1]。最近,德国Chong Sun团队于2023年9月发表在Cancer cell的研究创新性地发现[2],CMTM6可以通过泛素‑蛋白酶体降解途径同时竞争性结合并维持CD58稳定性和PD-L1稳定性,当CD58缺失时,CMTM6更多竞争性与PD-L1结合从而促进PD-L1稳定和过表达,进一步促进细胞毒性T细胞免疫杀伤能力减弱,最终导致肿瘤免疫逃避。
2024年4月18日,天津医科大学肿瘤医院张会来教授团队在《Cancer research》在线发表了题为“CD58 alterations govern antitumor immune responses by inducing PD-L1 and IDO in diffuse large B-cell lymphoma”的文章[3]。该研究揭示了CD58缺失或突变通过LYN/CD22/SHP1-JAK2/STAT1轴上调PD-L1及IDO表达,促进细胞毒性T细胞和CAR-T细胞免疫杀伤能力减弱,最终导致肿瘤免疫逃逸的全新机制,为CD58缺失或突变DLBCL疾病进展和CAR-T细胞治疗耐受的机理提供了新视野,亦为这部分患者未来个体化治疗提供潜在治疗靶点和策略。

研究结果
该研究首先从多组学角度阐明了DLBCL患者肿瘤组织中CD58基因变异频率即缺失率为44.7%、突变率为9.1%,并确定了CD58基因变异是导致患者一线免疫化疗反应应答率低、无进展生存期和总生存期短的重要因素之一。为了揭示这种临床结局现象背后的原因,该研究整合了bulk转录组和单细胞转录组测序数据,发现CD58缺失(低表达)与肿瘤免疫抑制和免疫耗竭微环境相关,缺失的患者CD8+ T细胞耗竭/功能障碍程度显著增加,同时与PD-L1、IDO表达上调呈正相关。体外实验发现,CD58突变/敲低可显著抑制T细胞增殖和CAR-T细胞对DLBCL细胞的杀伤作用,同时上调PD-L1、IDO表达;CD58过表达则逆转上述效应。当采用CD2单抗阻断CD58-CD2轴后,上述效应并不能完全消除,这提示CD58缺失或突变并不仅仅依赖于CD58-CD2轴,同时存在新的免疫应答调控机制。为了进一步揭示具体的分子机制,该研究通过分析患者肿瘤组织的测序数据发现,CD58缺失或突变患者伽马干扰素介导的JAK2-STAT1通路活化增加。随后通过CD58突变/敲低/过表达在细胞水平确定了其通过活化JAK2-STAT1信号通路,上调PD-L1和IDO表达,介导肿瘤免疫逃逸,影响免疫应答。深入分子机制研究显示,CD58缺失或突变通过影响Lyn招募、阻断抑制性受体CD22的ITIM磷酸化、从而抑制LYN/CD22/SHP1通路的负调控作用,导致JAK2/STAT1的去磷酸化减少,最终活化JAK2/STAT1信号通路,介导PD-L1和IDO转录增加和过表达。体外细胞共培养实验及体内小鼠异种移植瘤模型实验结果显示,DLBCL细胞中CD58缺失或突变可使CD19 CAR-T细胞对肿瘤细胞的杀伤敏感性降低;CD2激动剂与PD-L1单抗/IDO抑制剂联合应用,能够促进T细胞增殖,并恢复CAR-T对CD58突变或缺失DLBCL杀伤的敏感性。
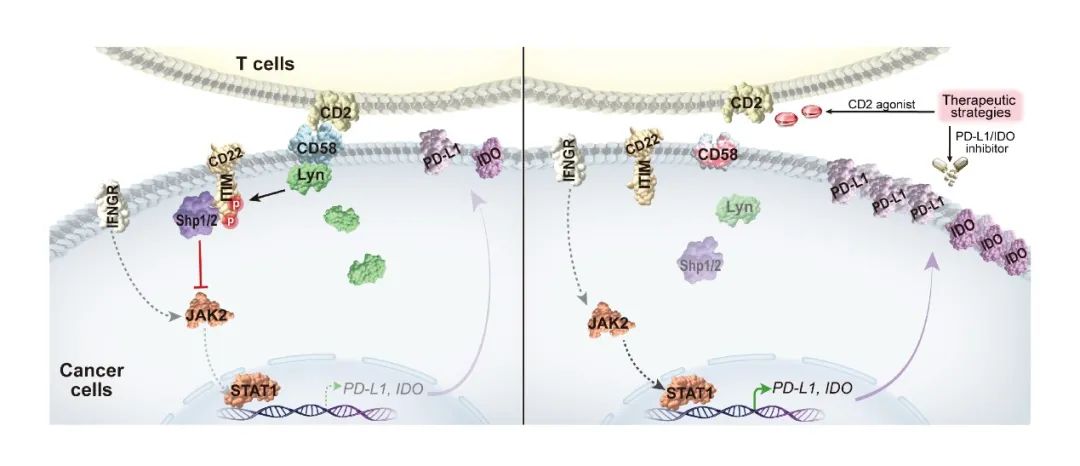
综上,本研究全面解析了DLBCL中CD58基因变异及表达特征,并揭示了CD58基因变异通过LYN/CD22/SHP1-JAK2/STAT1轴上调PD-L1及IDO表达、抑制细胞毒性T细胞和CAR-T细胞免疫杀伤能力、最终促进肿瘤免疫逃逸的全新机制。此外,本研究探索了直接激活CD2共刺激信号或与免疫检查点抑制剂联合应用的策略,以克服CD58基因变异DLBCL对抗肿瘤免疫反应的不利影响,为改善这部分患者的治疗提供了潜在靶点和治疗策略。
天津医科大学肿瘤医院张会来教授和王先火教授为共同通讯作者,张会来教授团队博士研究生徐溪悦为该文第一作者,硕士研究生张译丹和博士研究生逯亚晓为该文共同第一作者。该研究得到天津市海河医学英才等项目的支持。
参考文献:
1. Quastel M, et al. The CD58-CD2 axis in cancer immune evasion. Nat Rev Immunol. 2022 Jul;22(7):409.
2. Miao B, et al. CMTM6 shapes antitumor T cell response through modulating protein expression of CD58 and PD-L1. Cancer Cell. 2023 Oct 9;41(10):1817-1828.e9.
3. Xu X, et al. CD58 alterations govern antitumor immune responses by inducing PD-L1 and IDO in diffuse large B-cell lymphoma. Cancer Res. 2024 Apr 18. doi: 10.1158/0008-5472.CAN-23-2874.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#DLBCL# #肿瘤免疫# #CD58基因变异#
80