Nature重磅:CAR-T治疗多发性骨髓瘤又添特异性新靶点,临床前研究结果安全有效
2017-12-07 小博 医麦客
MMG49 CAR T细胞靶向MM细胞上表达的integrin b7蛋白的活性构象(图片来源 Osaka University)近年来,在癌症治疗领域,相比较于传统的单克隆抗体药物(mAb)、抗体偶联药物(ADC)和双特异性抗体(BsAb),CAR-T细胞疗法已经明显表现出了对肿瘤细胞更强的靶向性和杀伤力。据Carl June等多个研究团队的报道,我们认为CAR-T可以有效杀死细胞表面抗原表达
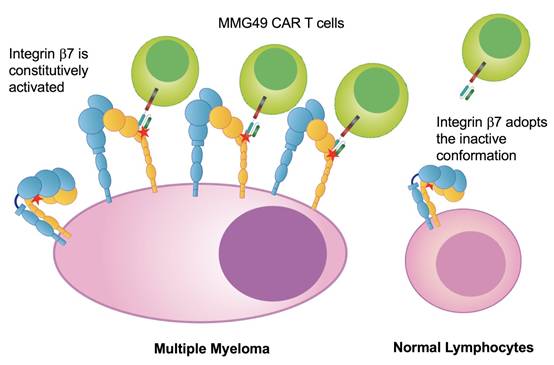
MMG49 CAR T细胞靶向MM细胞上表达的integrin b7蛋白的活性构象(图片来源 Osaka University)
近年来,在癌症治疗领域,相比较于传统的单克隆抗体药物(mAb)、抗体偶联药物(ADC)和双特异性抗体(BsAb),CAR-T细胞疗法已经明显表现出了对肿瘤细胞更强的靶向性和杀伤力。据Carl June等多个研究团队的报道,我们认为CAR-T可以有效杀死细胞表面抗原表达量较低的肿瘤细胞(拷贝数为几十到几百),而抗体介导的抗肿瘤药物只能杀死细胞表面抗原高表达的肿瘤细胞(拷贝数为几千到几万)。

右-Carl June(图片来源 pennmedicine.org)
但同样由于CAR-T疗法的高灵敏度,和传统抗体药物相比,其on-target/off-tumor毒性会导致更为严重的毒副作用。因此,CAR-T治疗的靶点选取不能套用传统抗体治疗的靶点选取标准,而是需要寻找更为严格的肿瘤特异性抗原作为靶点。而目前CAR-T最成功的案例则是以CD19为靶点针对B细胞淋巴瘤的一系列临床试验(已有两款CAR-T细胞产品获批上市)。其中针对急性B-淋巴细胞白血病(B-ALL)的缓解率更是达到了90%。
而除了B细胞淋巴瘤之外,在血液系统恶性肿瘤中,多发性骨髓瘤(MM)也相当常见(彻底治愈极为困难,且容易复发)。MM起源于骨髓中的浆细胞,而浆细胞是B淋巴细胞发育到最终功能阶段的细胞。因此通常将MM归到B淋巴细胞瘤的范畴。但MM的异常浆细胞几乎不表达CD19,而且大部分B细胞标志蛋白表达量极微,甚至不表达,因此针对MM的CAR-T治疗需要寻找新靶点。
而除了B细胞淋巴瘤之外,在血液系统恶性肿瘤中,多发性骨髓瘤(MM)也相当常见(彻底治愈极为困难,且容易复发)。MM起源于骨髓中的浆细胞,而浆细胞是B淋巴细胞发育到最终功能阶段的细胞。因此通常将MM归到B淋巴细胞瘤的范畴。但MM的异常浆细胞几乎不表达CD19,而且大部分B细胞标志蛋白表达量极微,甚至不表达,因此针对MM的CAR-T治疗需要寻找新靶点。
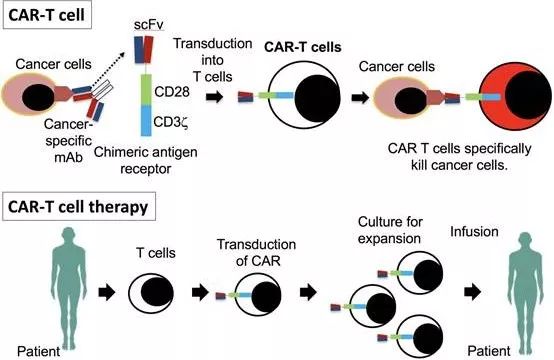
CAR-T细胞疗法(图片来源 Osaka University)
近日,来自日本大阪大学(Osaka University)的研究团队又发现了一个极具潜力的新靶点,实验结果表明,整合素β7蛋白(integrin β7)的活性构象对多发性骨髓瘤细胞具有特异性,或可成为CAR T细胞治疗的靶点,为广大骨髓瘤患者提供新型细胞免疫疗法,相关研究结果发表在权威学术期刊Nature Medicine上。

众所周知,CAR T细胞是通过特异性识别癌细胞上的抗原来发挥作用的,但不幸的是,由于在同一肿瘤和肿瘤之间的细胞中会表达大量的蛋白质,因此T细胞很难识别出针对癌细胞的蛋白质。面临这样的挑战,日本大阪大学的研究人员开始寻求突破点,他们表示,在之前的分析中可能已经错过了在合成期间或之后通过蛋白质修饰形成的癌症特异性抗原,例如糖基化(糖部分与蛋白质的连接)或构象变化。研究小组认为新的抗原表位是免疫细胞识别的抗原的一部分,而且可以通过彻底地搜索癌症特异性的mAbs并鉴定其识别的抗原来发现。
MMG49为MM特异性mAb

MM特异性mAb MMG49识别integrin β7(图片来源 Nature)
研究人员首先建立了>10000个产生与各种MM细胞系反应的mAbs的杂交瘤,选择并储存大约500个产生不与正常外周血单核细胞(PBMC)结合的mAbs的杂交瘤。接下来,他们使用候选mAbs对MM患者的骨髓(BM)细胞进行染色,最终鉴定出一种称为MMG49的特殊抗体,其在51个MM样本中45个,都显示出了与MM细胞的结合,但对正常白细胞或非MM细胞的结合可忽略。
MMG49特异性靶向integrinβ7的活性构象
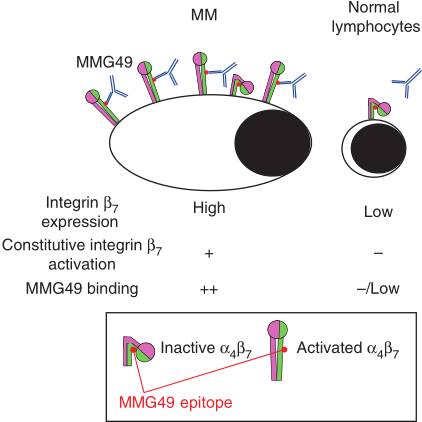
在MM细胞中,MMG49的MM特异性反应基于integrin β7的组成性激活和高表达(图片来源 Nature)
并确定了这种特定的抗体只能靶向integrinβ7的活性构象。由于integrin β7在大多数骨髓瘤细胞中高度表达并且具有活性构象,因此研究人员使用来自MMG29单克隆抗体的片段开发了MMG49 CAR T细胞。

CAR构建体(图片来源 Nature)
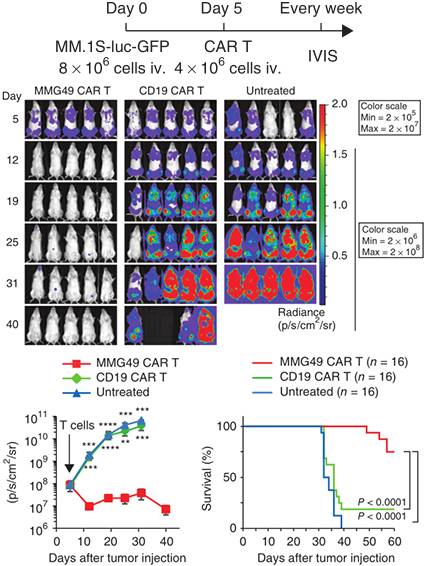
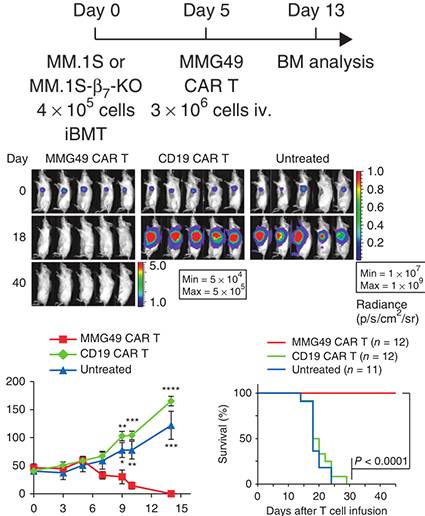
MMG49 CAR T细胞在体内发挥抗MM效应而不损伤正常的造血细胞(图片来源Nature)
结果发现,MMG49 CAR T细胞会特异性的杀死小鼠体内的骨髓瘤细胞,具有显著的抗癌效果,并且对正常细胞没有损害。
作为该研究报告的共同作者,Yukiko Matsunaga说:“我们的研究结果还表明,integrin β7的活性构象可以作为抗多发性骨髓瘤的免疫治疗靶点,即使蛋白本身的表达不是MM特异性的。
此外,论文作者还指出,虽然一种特定的蛋白质可能不是特定表达于一种癌细胞上的,但它在细胞表面的构象却有可能。也就是说,即使蛋白质本身的表达不是癌症特异性的,癌症免疫治疗靶点仍然可以在许多经历构象变化的细胞表面蛋白质中被鉴定出来。
以上结果表明,MMG49 CAR T细胞具有特异性抗MM而不损伤正常组织的治疗潜力。而且MMG49 CAR T细胞不仅可以靶向MM浆细胞,还可以靶向作为候选MM前体细胞的克隆型CD19+ B细胞。此外,MMG49对正常浆细胞的反应性并不排除MMG49 CAR T细胞的临床应用,因为任何可能由浆细胞耗竭导致的低血球蛋白血症都可以通过注射免疫球蛋白来安全地校正。将源自小鼠的单链可变片段人源化以降低其免疫原性后,研究人员将在临床试验中测试MMG49 CAR T细胞疗法的安全性与有效性,并与靶向其他候选抗原的CAR T细胞疗法进行比较。
针对多发性骨髓瘤的CAR-T治疗靶点
CD38:表达与分布相当广泛,无细胞系限制性,在定向髓系和淋巴细胞系祖细胞表达水平很高,在NK细胞、T细胞、B细胞等也有表达。有文献报道,与正常浆细胞相比,骨髓瘤细胞CD38的表达明显增加。2015年FDA加速批准了针对CD38的单克隆抗体药物Darzalex(daratumumab)用于MM的治疗。Daratumumab具有广谱杀伤活性,靶向结合MM肿瘤细胞表面高表达的跨膜胞外酶CD38分子,可通过多种机制诱导肿瘤细胞的快速凋亡,延长病人的存活期,并且没有严重的髓细胞生长抑制作用。但是,迄今还没有CD38 CAR-T的临床报道。
CD138:又称为syndecan-1,在血液系统中仅表达于浆细胞,是一个浆细胞的标志性抗原,在MM的肿瘤细胞表面高表达。同时,可溶性CD138可以作为浆细胞病特异性指标,能够精确反应恶性浆细胞病的严重程度,在MM中的作用更为明显,它的浓度与骨髓瘤细胞的负荷呈正相关。处在二期临床试验的针对CD138靶点的ADC药物—BT062,与来拉度胺(lenalidomide)联合使用,在MM患者中的应答率可以达到83%。但由于CD138也广泛表达于各类上皮细胞,因此BT062的毒副作用之一就是肝脏和皮肤的毒性反应。可以预见,CD138 CAR-T的类似毒副作用会更显著。
BCMA:(B细胞成熟抗原)正常表达于成熟的B细胞和浆细胞,在MM中也有广泛的表达,是一个非常理想的免疫治疗靶点。针对BCMA的ADC药物(GSK2857916)和双靶向抗体药物(BI836909)现正处于一期临床和临床前研发过程中。可溶性BCMA在MM病人血清中会升高,且浓度与肿瘤恶性程度呈正相关。但血清中BCMA对免疫治疗的影响还不清楚。针对BCMA的CAR-T 在U Penn, NCI 和 Bluebird Bio 都已进入一期临床试验。
虽然B细胞表面的常见标志蛋白(如CD19, CD20等)不被传统的MM免疫治疗所看好。但是,去年U Penn 和Novartis在NEJM上报道的一个CD19 CAR-T成功治疗MM的病例似乎为这一类抗原带来了新的希望。其文章指出,MM肿瘤细胞中一组抗药性强,增殖能力强(具有肿瘤干细胞特性的)的细胞克隆虽然CD19表达量低,但的确是CD19 阳性的。一例被报道的病例中,尽管99.5%的恶性增生的浆细胞上都缺乏CD19 的表达,该患者依旧获得完全治愈。如果CD19 CAR-T在未来的MM临床实验中,在更多的病人体内证明了其疗效,将是MM治疗的一个重大突破。
如上所述,已有许多靶点可供应用,进一步临床试验将揭示其治疗效用。我们期待着,研究人员能够找到与CAR-T 治疗 B 细胞淋巴瘤的靶点(CD19)疗效相媲美的其他靶点,为广大多发性骨髓瘤患者(MM)提供治愈的希望。
作者:小博
来源:微信公众号“医麦客”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#特异性#
78
#研究结果#
84
#多发性#
77
#Nat#
90
#CAR-#
128
学习了谢谢分享
149
#新靶点#
63
#重磅#
135
谢谢分享.学习了
134
学习了很有用不错
212