PD-L1与PD-1有何不同?一文读懂!
2022-12-06 e药安全 e药安全 发表于上海
目前国内免疫药物主要有PD-1单抗和PD-L1单抗两大类。大家可能觉得,这两种药物其实是针对同一免疫通路的两个端点,机制上似乎是一致的。
目前国内免疫药物主要有PD-1单抗和PD-L1单抗两大类。大家可能觉得,这两种药物其实是针对同一免疫通路的两个端点,机制上似乎是一致的。
其实不然,两者之间存在着一定的区别,无论是在药物设计、作用机制到临床疗效,甚至耐药处理上都有不同之处。今天就全面给大家分析PD-1与PD-L1之间的不同。
一、免疫系统与“狡猾”的肿瘤细胞
我们人体有一套完整的自我防护系统称之为免疫系统,免疫系统就像守护人体健康的“特种部队”。免疫系统能够清除体内的“异己”成分,如肿瘤细胞、病毒、细菌等,并避免伤害自身的组织和器官。
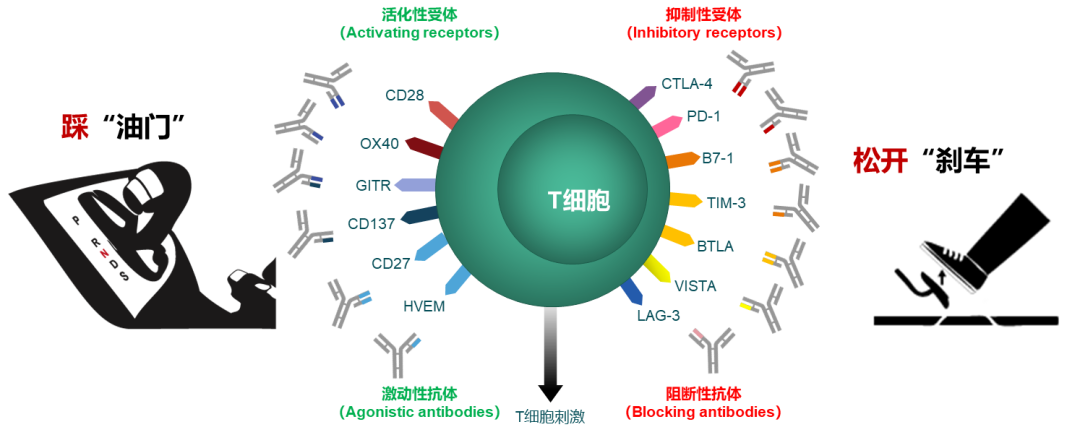
图1 T细胞的活化和抑制信号通路[1]
在免疫系统中,T细胞介导的细胞免疫是消灭肿瘤的“主力军团”。T细胞需要活化才能发挥抗肿瘤效应,T细胞的活化幅度和质量取决于活化信号和抑制信号之间的平衡,活化性抗体发出活化信号就像车的油门,抑制性抗体发出抑制信号就像踩刹车。免疫检查点可以认为是免疫细胞的刹车系统,是指在免疫细胞上表达、能调节免疫激活程度的一系列分子,使T细胞的活化水平保持在正常范围,防止对机体健康组织的损伤。PD-1/PD-L1和CTLA-4就是我们目前最熟知的免疫检查点。
我们的机体是具备自我消杀肿瘤的能力的,但总有一些“狡猾”的肿瘤细胞却能逃脱免疫系统的监视,肆意的生长从而危害机体的健康。“狡猾”的肿瘤细胞就是利用了免疫检查点的特点,肿瘤细胞表面表达PD-L1蛋白,导致T细胞失去杀伤肿瘤细胞的活性,从而实现免疫的逃逸。

图2 PD-1和PD-L1
二、什么是PD-1和PD-L1?
PD-1(programmed cell death protein 1)是程序性死亡受体1,是活化的T细胞表达的免疫检查点受体,是一种重要的免疫抑制分子。PD-1通过向下调节免疫系统对人体细胞的反应,以及通过抑制T细胞炎症活动来调节免疫系统并促进自身耐受。这可以预防自身免疫疾病,但它也可以防止免疫系统杀死癌细胞。
PD-L1是PD-1的配体,PD-L1与免疫系统的抑制有关,可以传导抑制性的信号。肿瘤细胞也可以表达PD-L1,PD-1和PD-L1一旦结合便会向T细胞传递负向调控信号,导致T细胞无法识别癌细胞,肿瘤细胞从而实现“免疫逃逸”。
PD-1可表达在T细胞、B细胞等免疫细胞表面。不过在T细胞未活化时,几乎是不表达PD-1的,仅在T细胞活化之后,PD-1才表达在T细胞表面。
PD-L1除了会表达在肿瘤表面,参与免疫逃逸,还会在IFN-γ刺激下,表达在抗原提呈细胞(DC细胞、巨噬细胞等),以及血管内皮细胞的表面。

图3 PD-1/PD-L1抑制剂重新激活T细胞[2]
阻断PD-1/PD-L1途径的治疗已经成为癌症免疫治疗的焦点。PD-1单抗和PD-L1单抗,是用来进行癌症免疫治疗的药物,PD-1单抗或PD-L1单抗阻断PD-1与PD-L1的结合,恢复T细胞肿瘤活性,激活T细胞,杀伤肿瘤细胞。一旦抗肿瘤免疫循环建立,可以产生持久的抗肿瘤效应。目前国内有多款PD-1抑制剂/PD-L1抑制剂获批上市。
三、PD-L1抑制剂和PD-1抑制剂有什么区别?
1、药物结构不同
PD-1抑制剂大多为IgG4抗体[3],靶细胞为T细胞,PD-1抑制剂影响的是免疫T细胞的功能。IgG4抗体结构稳定性较差,因此几乎所有的PD-1抑制剂进行了修饰增加稳定性,不够完美的修饰,可能会导致不良反应的发生。
PD-L1抑制剂大多为IgG1抗体,靶细胞为肿瘤细胞,PD-L1抑制剂影响的是肿瘤细胞。IgG1单抗是最常用的单抗,半衰期长,稳定性好。
2、作用机制不同
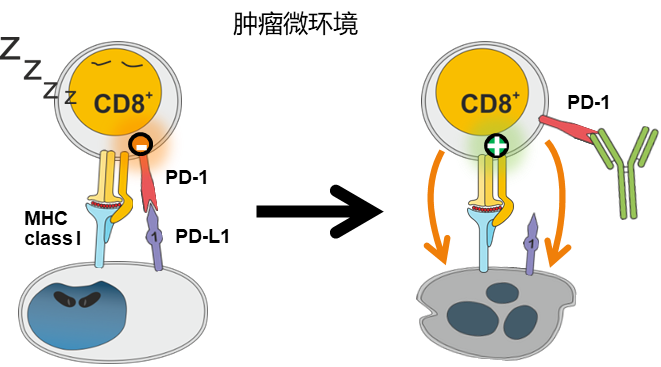
图4 PD-1单抗的作用机制
PD-1抑制剂与T细胞表面的PD-1相结合,阻断PD-1:PD-L1/PD-L2的结合,解除T细胞的活化和增值抑制,使肿瘤特异性T细胞处于活化状态,恢复T细胞的杀伤功能;PD-1抑制剂同时阻断了T细胞表面的PD-1与免疫细胞表面的PD-L1、PD-L2结合,增加潜在自身免疫反应风险。
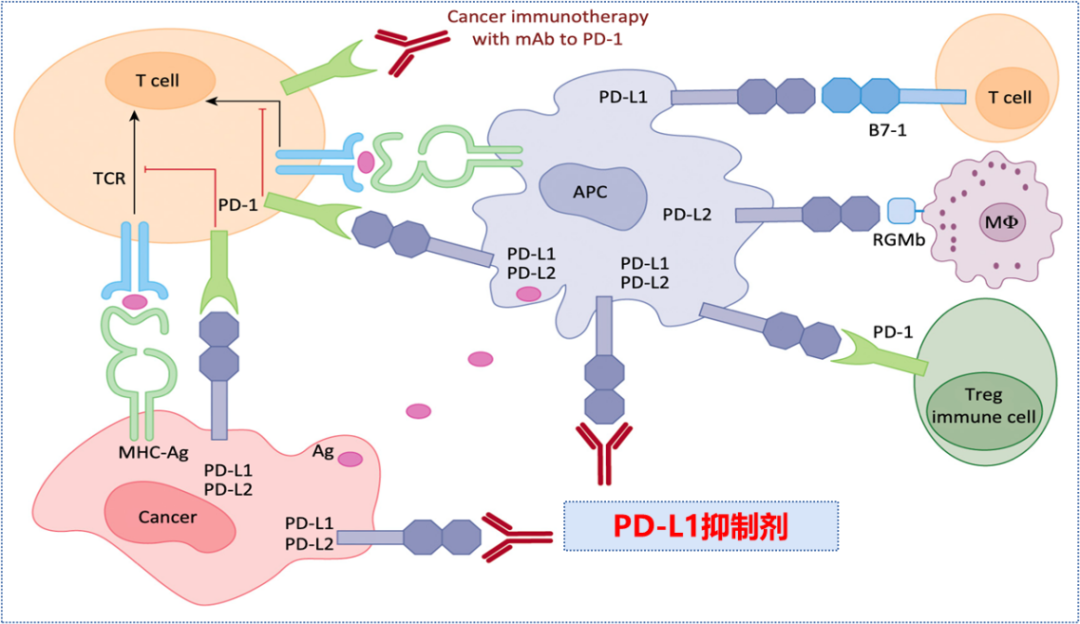
图5 PD-L1单抗的作用机制[4]
PD-L1抑制剂相比PD-1抑制剂同时结合肿瘤细胞与抗原呈递细胞表面的PD-L1,整体免疫疗效更强,恢复T细胞介导的抗肿瘤免疫作用,且不影响PD-L2的生理功能;PD-L1抑制剂具有阻断肿瘤细胞表面PD-L1与T细胞表面B7-1的结合能力,有利于全面激活T细胞;抑制剂树突状细胞表面的B7-1分子与自身高表达的PD-L1结合,因而难以结合CD28启动免疫激活,PD-L1抑制剂解除DC细胞的自我抑制,进一步强化抗肿瘤免疫应答;PD-L1单抗定向阻断PD-L1与PD-1的结合,保留巨噬细胞PD-L2的功能,避免ILD等副作用的发生[5]。
3、不良反应发生率不同
免疫检查点抑制剂在提高对肿瘤细胞的杀伤作用的同时,活化的T细胞攻击正常组织、自身抗体增加,细胞因子增加等诱发自身免疫炎症,产生一系列免疫治疗相关不良反应(irAEs)。与PD-1抑制剂相比,PD-L1抑制剂的3级以上不良反应事件的发生率较低[3],这可能和PD-L1抑制剂还保留了PD-L2通路有关,维持巨噬细胞PD-L2的局部稳态,减少相关不良反应的发生。
2019年JAMA Oncol上一项Meta分析纳入125项应用PD-1/PD-L1单药的临床研究,以评估PD-1抑制剂和PD-L1抑制剂治疗相关不良反应事件的发生率,研究数据显示:接受PD-1抑制剂治疗的患者3级及以上不良反应事件发生率高于接受PD-L1抑制剂的患者(OR, 1.58; 95% CI, 1.00-2.54)[6]。
表1 PD-1抑制剂和PD-L1抑制剂不良反应事件的发生率
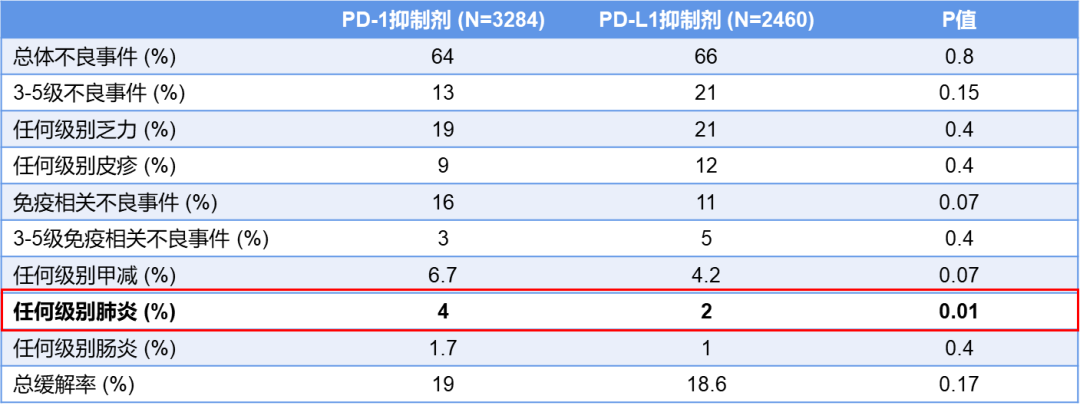
一项Meta分析系统性分析了23个非小细胞肺癌免疫治疗的临床研究,PD-1抑制剂12项,PD-L1抑制剂11项,研究数据显示:PD-1单抗免疫相关不良反应事件的发生率更高,(16% vs 11%,p=0.07);间质性肺炎发生率:PD-1抑制剂是PD-L1抑制剂的两倍,有显著性意义(4% vs 2%,p=0.01)[7]。
4、对EGFR/ALK突变的疗效不同
EGFR/ALK突变大家都知道不适合使用免疫治疗,不仅疗效低,还容易出现超进展、严重不良反应等负面情况。但是在PD-L1单抗“I”药的一项三线ATLANTIC研究中,采用durvalumab对EGFR/ALK阳性的PD-L1表达≥25%的肺癌患者进行免疫治疗,却能明显获益。三线有效率达到12.2%。为EGFR突变患者提供了依照PD-L1分选的治疗依据。

无独有偶,在PD-L1单抗T药的一项临床研究IMpower150中,采用T药+贝伐单抗+化疗治疗EGFR突变靶向治疗失败的肺癌患者,也获得了不错的结果。
在临床适应症方面,PD-1/PD-L1单抗的研发重点及联合方案也有不同,获批适应症及使用范围有很大的区别。
近年来,以PD-1/PD-L1抑制剂为代表的免疫检查点抑制剂在肿瘤免疫治疗方面取得突破性进展,给肿瘤患者带来生存的获益。在中国,不同的PD-1/PD-L1抑制剂获批的适应症不同,患者在选择用药时,需要按照适应症和指南推荐进行合理化使用。
参考文献:
[1].Drew M. Pardoll. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer. 2012 Mar 22;12(4):252-64.
[2].Annika De Sousa Linhares, Claire Battin, Sabrina Jutz, et al. Therapeutic PD-L1 antibodies are more effective than PD-1 antibodies in blocking PD-1/PD-L1 signaling[J]. Sci Rep. 2019 Aug 7;9(1):11472.
[3].Jifeng Yu, Yongping Song, Wenzhi Tian. How to select IgG subclasses in developing anti-tumor therapeutic antibodies[J]. J Hematol Oncol. 2020 May 5;13(1):45.
[4].Kim C Ohaegbulam, Amer Assal, Eszter Lazar-Molnar, et al. Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J]. Trends Mol Med. 2015 Jan;21(1):24-33.
[5].Maud Mayoux, Andreas Roller, Vesna Pulko, et al. Dendritic cells dictate responses to PD-L1 blockade cancer immunotherapy[J]. Sci Transl Med. 2020 Mar 11;12(534):eaav7431.
[6].Yucai Wang, Shouhao Zhou, Fang Yang, et al. Treatment-Related Adverse Events of PD-1 and PD-L1 Inhibitors in Clinical Trials: A Systematic Review and Meta-analysis[J]. JAMA Oncol. 2019 Jul 1;5(7):1008-1019.
[7].Rathi N Pillai, Madhusmita Behera, Taofeek K Owonikoko, et al. Comparison of the toxicity profile of PD-1 versus PD-L1 inhibitors in non-small cell lung cancer: A systematic analysis of the literature[J]. Cancer. 2018 Jan 15;124(2):271-277.
来源|今日肿瘤、找药宝典、e药界(如有侵权,请联系小编删除)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言