Cardiovasc Res 中国药科大学徐明教授团队揭示NLRP3炎性小体介导的免疫早衰驱动糖尿病性血管衰老的新机制
2024-04-29 论道心血管 论道心血管 发表于陕西省
该研究揭示了2型糖尿病背景下,Toll样受体4 (TLR4)-核因子-kappa B-NLRP3轴介导的免疫早衰先于并驱动血管老化及损伤。
2型糖尿病(Type 2 diabetes mellitus, T2DM)加速的血管老化过程是相关心血管疾病(Cardiovascular diseases, CVDs)风险升高的重要原因。代谢紊乱诱导的免疫衰老与多器官/组织损伤有关。然而,对于免疫衰老是否先于并驱动T2DM期间的血管衰老和损伤,以及糖尿病性免疫早衰的分子机制,仍未很好的确立。
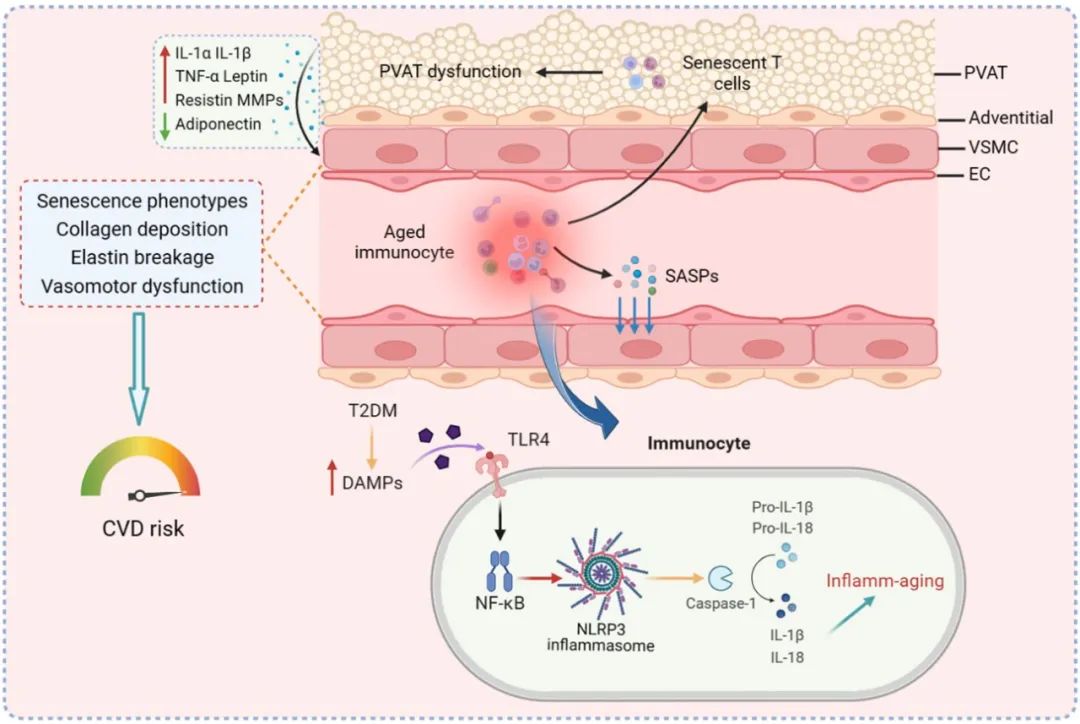
2024年4月21日,中国药科大学徐明教授团队在Cardiovascular Research杂志上在线发表了题为 “ NLRP3 inflammasome-mediated premature immunosenescence drives diabetic vascular aging dependent on the induction of perivascular adipose tissue dysfunction” 的研究论文,揭示了2型糖尿病背景下,Toll样受体4 (TLR4)-核因子-kappa B (nuclear factor kappa-B, NFκB)-NLRP3轴介导的免疫早衰先于并驱动血管老化及损伤。此外,作者证实了衰老免疫细胞对血管老化的促进作用是其直接作用和诱导血管周围脂肪组织(PVAT)功能障碍的综合效应,并且后者伴随的分泌组变化可独特地影响血管收缩。值得注意的是,衰老T细胞的浸润与PVAT功能障碍及其分泌组改变有关。

首先,作者发现,在STZ/HFD诱导的T2DM小鼠或 db/db小鼠中,免疫系统的衰老特征的出现先于脉管系统。而与移植正常对照小鼠的脾细胞相比,将老年小鼠脾细胞或T2DM小鼠脾细胞移植到年轻小鼠体内会引发血管衰老和损伤。
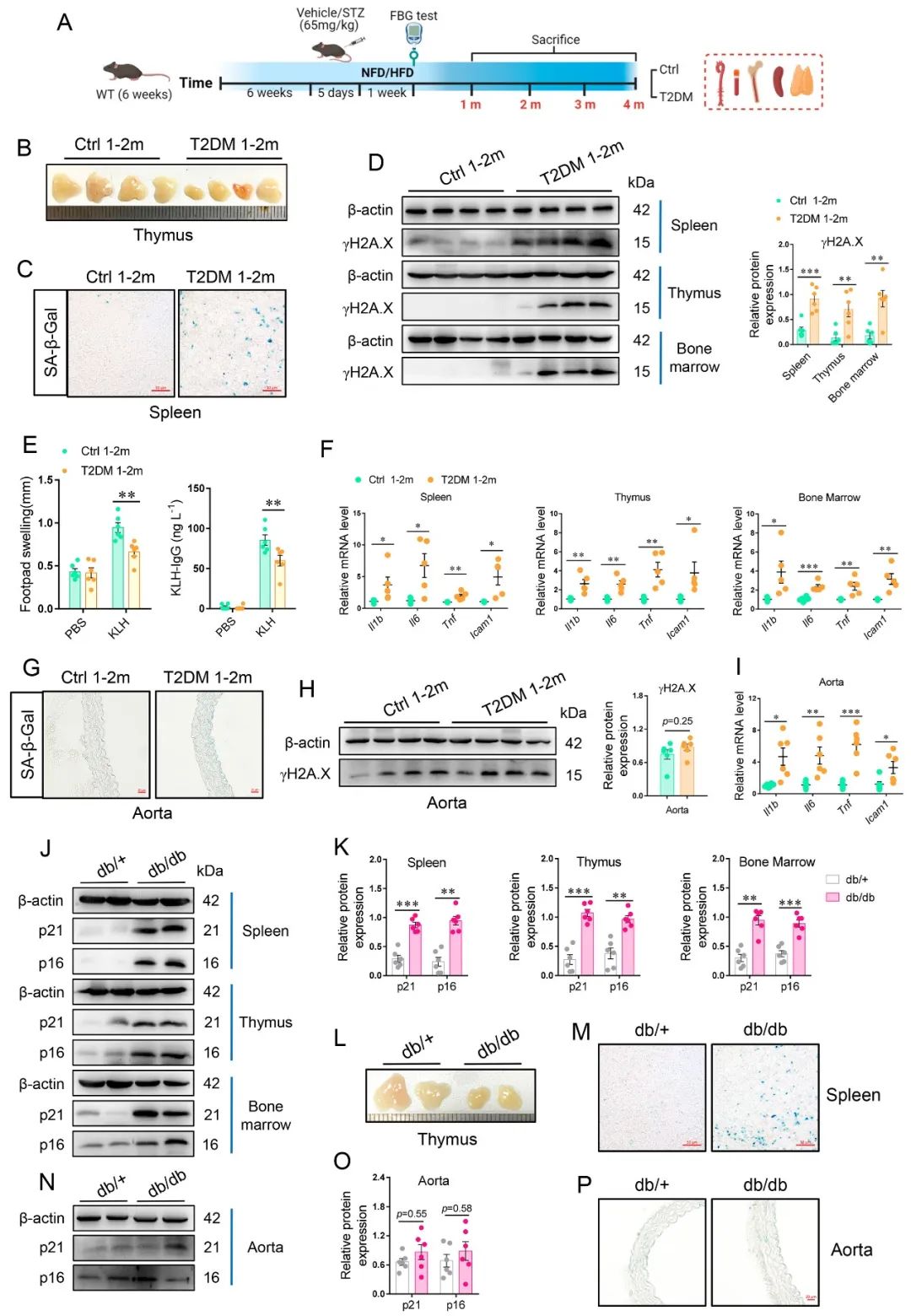
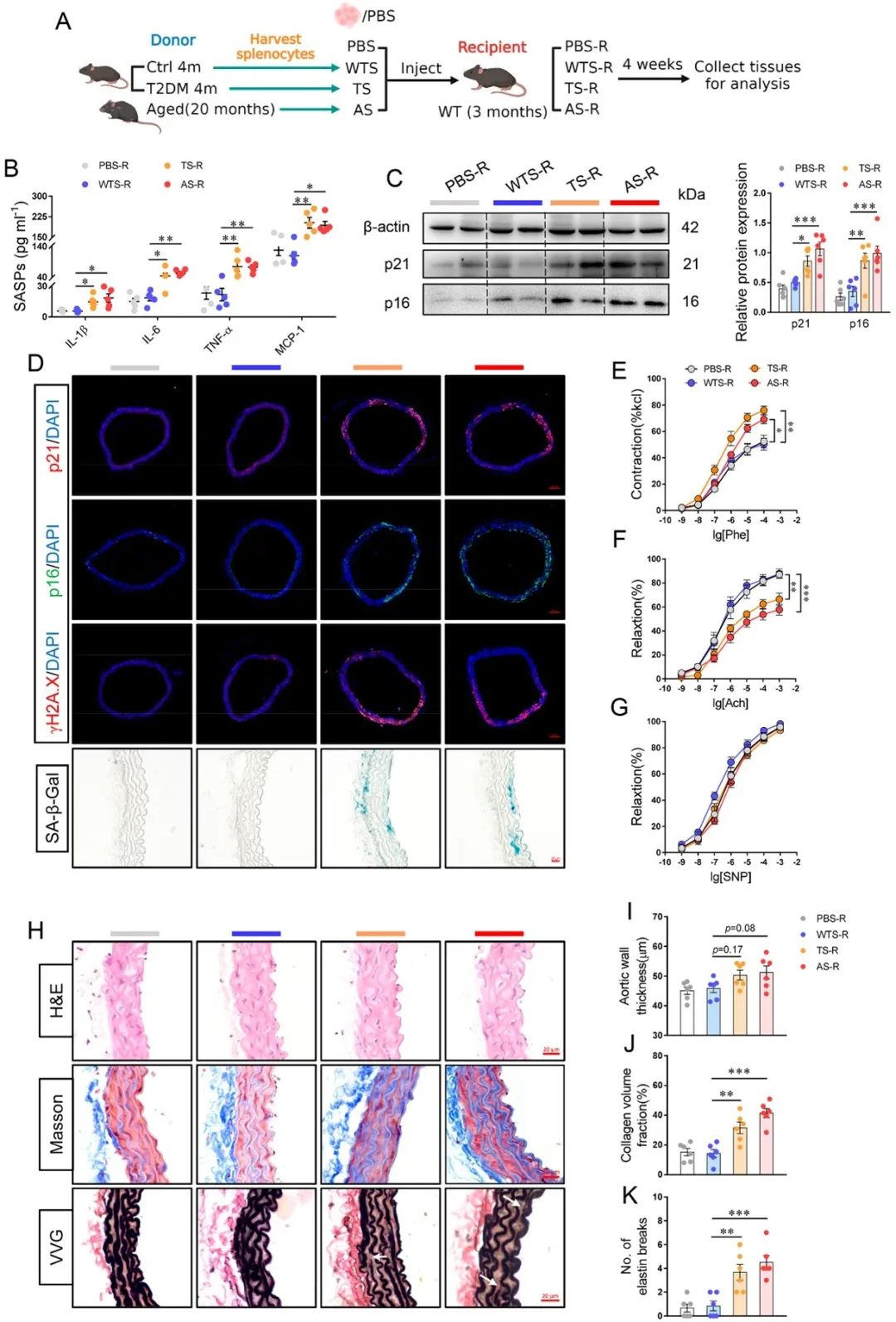
为了进一步探究糖尿病性免疫早衰机制,作者利用人外周血单个核细胞(PBMCs)基因表达谱数据及小鼠免疫组织RNA-seq结果进行分析和验证后显示,TLR4-NFκB-NLRP3轴可能是介导糖尿病性免疫早衰的关键信号。并且,利用Nlrp3-/-小鼠进行T2DM模型建立,验证了Nlrp3缺失可改善T2DM背景下的免疫衰老和血管老化,突出了NLRP3炎性小体的核心角色。
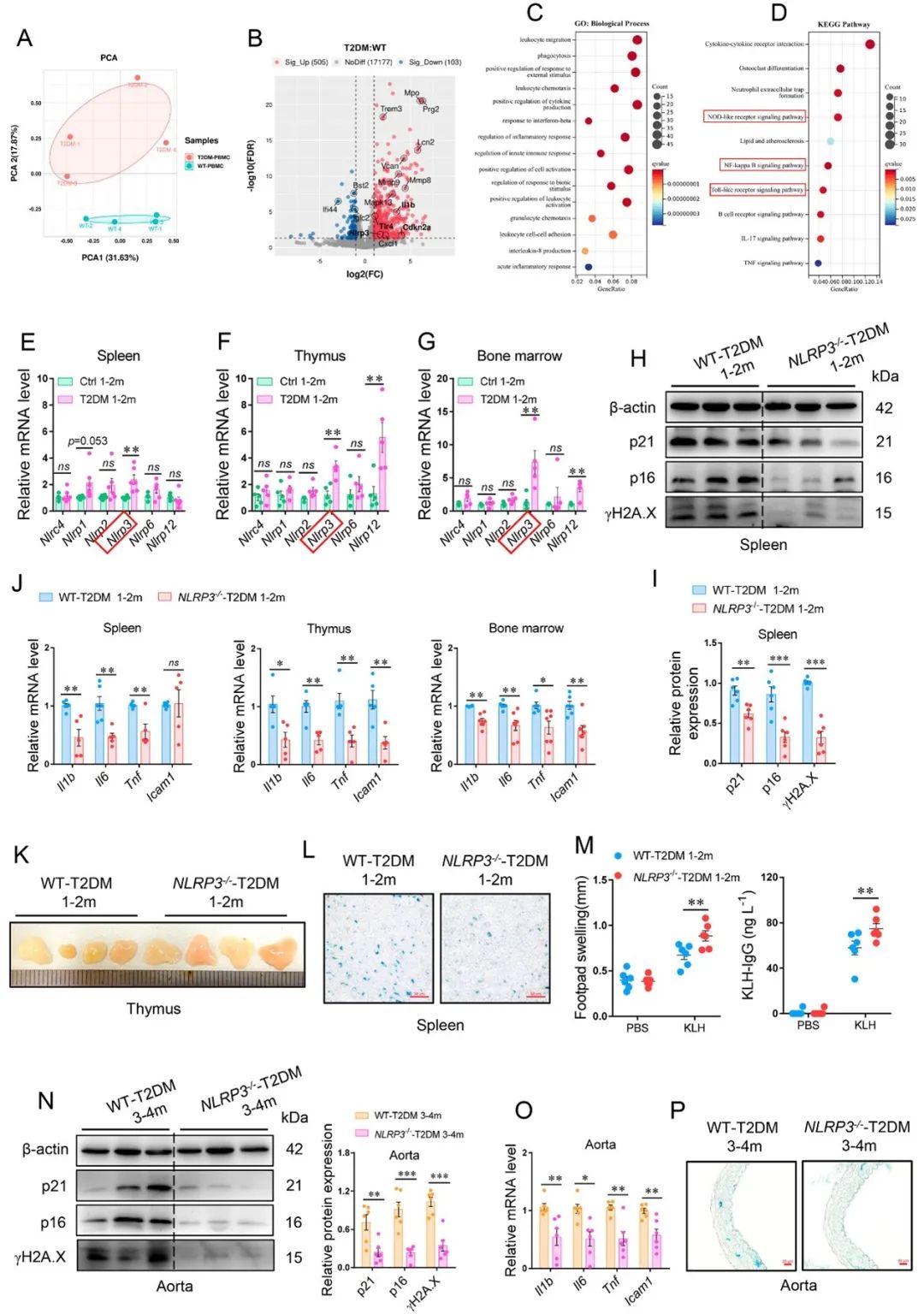
不仅如此,细胞共培养结果也显示T2DM而非Nlrp3-/- T2DM小鼠的脾细胞可诱导血管细胞衰老相关表型并损害细胞功能,值得注意的是,其对血管收缩相关指标(如血管平滑肌细胞中ROCK1/2及OPN表达、Ca2+水平;内皮细胞内Endothelin-1水平)的影响并不明显,这与前期细胞移植后观察到受体小鼠的血管收缩增强并不一致,由此考虑衰老免疫细胞可能经其他途径影响血管生物学。
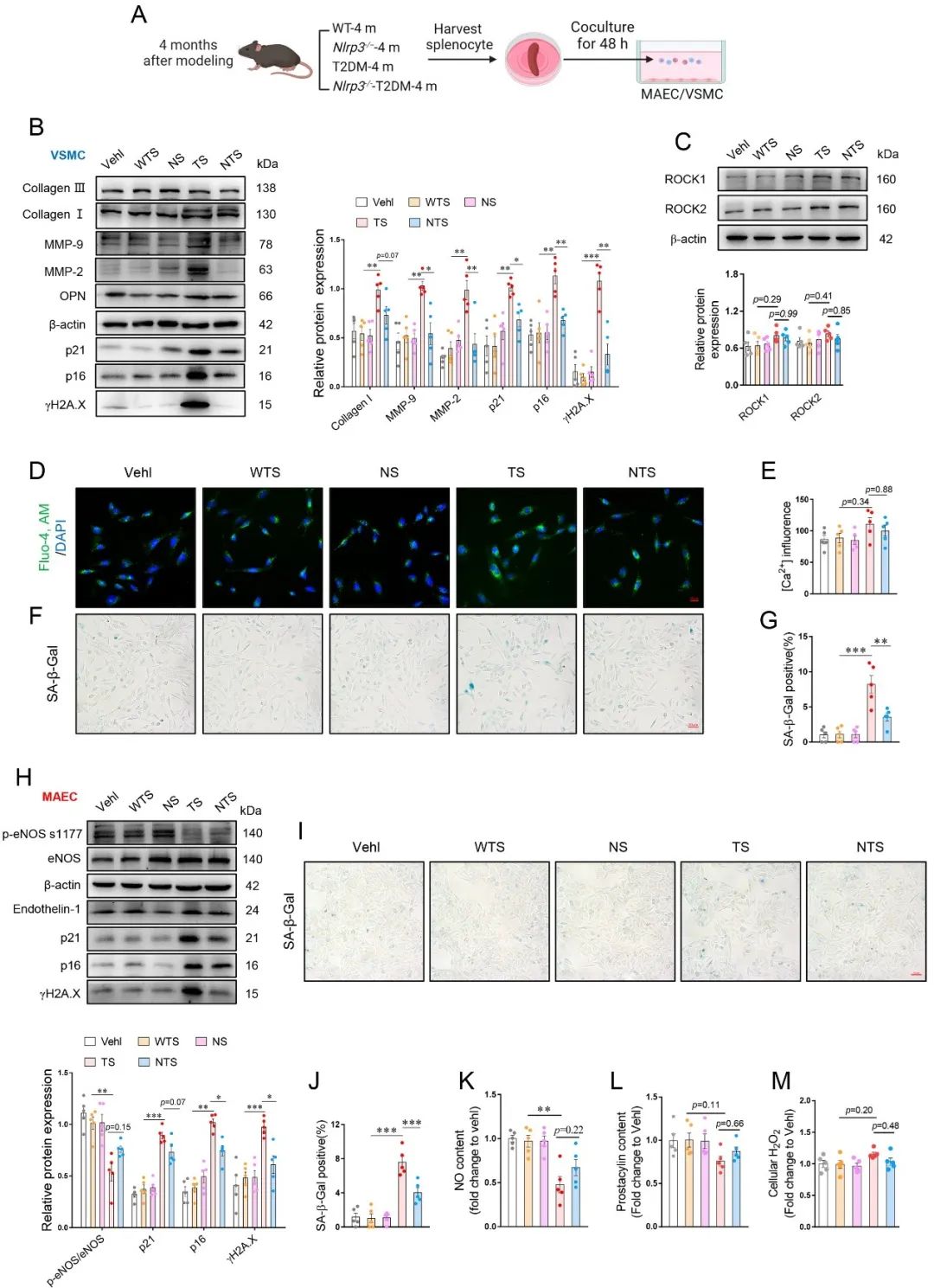
接下来,作者发现T2DM而非Nlrp3-/- T2DM小鼠PVAT中衰老免疫细胞浸润增多。同时对受体小鼠PVAT的免疫浸润丰度的评估结果提示T细胞的重要角色,并且其浸润程度与PVAT功能障碍相关的代表性基因表达水平显著相关。此外,受体小鼠PVAT条件培养基(PVAT-CM)对血管细胞的刺激及其对离体血管张力影响的结果表明PVAT分泌组对血管衰老表型及血管收缩的调控作用,佐证了衰老的免疫细胞可能经PVAT途径损害血管稳态。
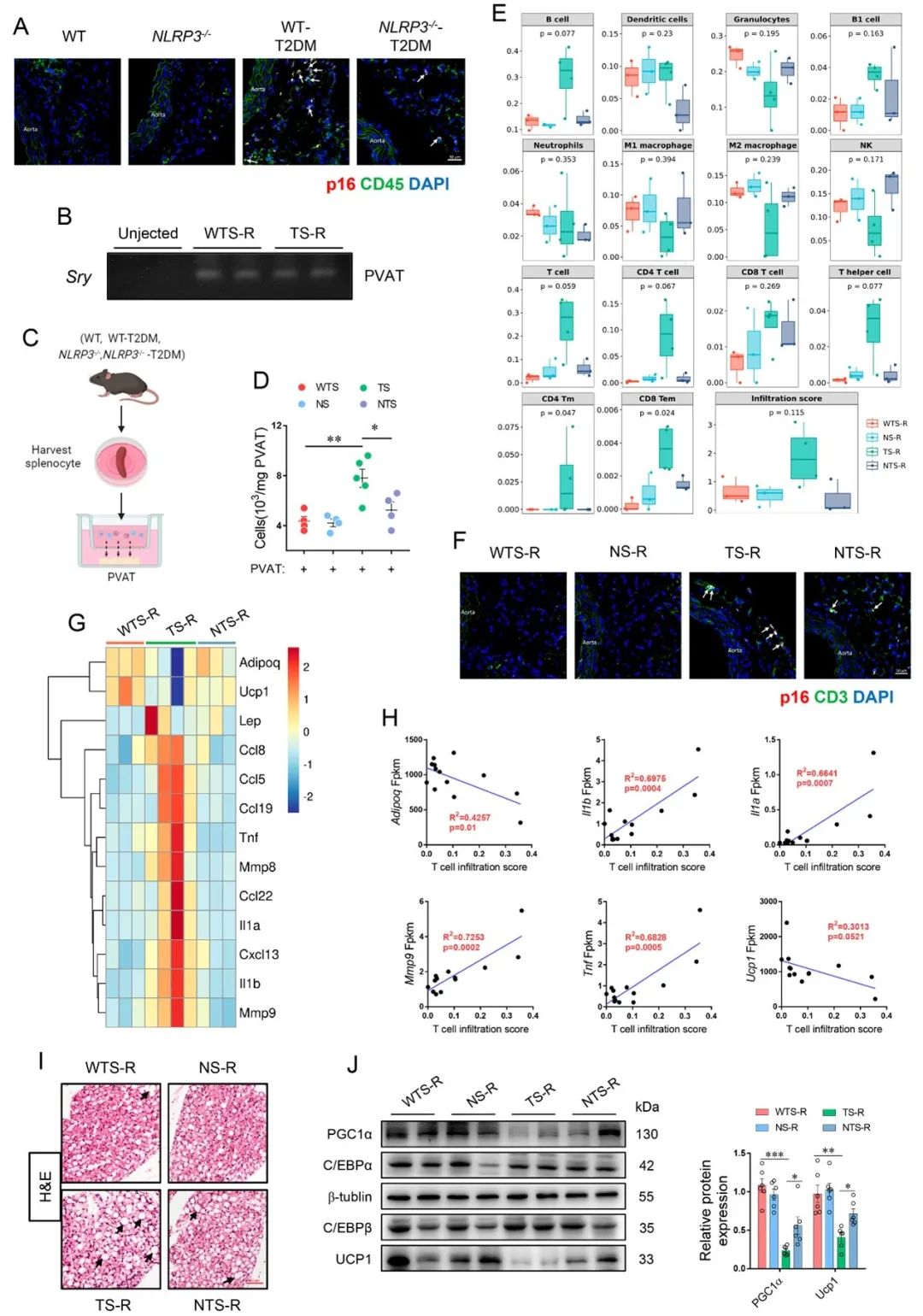
综上,NLRP3炎性小体介导的免疫早衰先于并驱动2型糖尿病性血管衰老,而早衰免疫细胞对血管衰老的贡献是其直接作用和诱导PVAT功能障碍的综合效应,这些发现为靶向免疫系统中的NLRP3信号以改善糖尿病血管衰老和相关病变提供了新的思路。此外,选择性耗竭衰老的T细胞或干预PVAT分泌组也可能是有前景的治疗策略。
中国药科大学徐明教授和东南大学附属中大医院主治医师李小雪为本文的共同通讯作者,博士研究生邰光杰、硕士研究生马延洁、冯俊霖为本文的共同第一作者,本研究获得国家自然科学基金、江苏省高校国际合作联合实验室项目等项目资助。
原文链接:
https://doi.org/10.1093/cvr/cvae079
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#NLRP3炎性小体# #糖尿病性血管衰老#
38