【BJH】无17p缺失、免疫化疗的一线CLL中基因异常的预后影响
2024-05-04 聊聊血液 聊聊血液 发表于上海
学者通过细胞遗传学和靶向二代测序,对536例接受一线免疫化疗治疗(CIT)的CLL患者进行了基因异常的综合分析,旨在评估主要异常的预后意义,并特别关注根据IGHV状态分层时的相对影响。
CLL基因异常的预后影响
遗传异常对慢性淋巴细胞白血病(CLL)的潜在预后影响可能因多种因素而异,如IGHV状态。作为两项前瞻性研究的一部分,学者通过细胞遗传学和靶向二代测序,对536例接受一线免疫化疗治疗(CIT)的CLL患者进行了基因异常的综合分析,旨在评估主要异常的预后意义,并特别关注根据IGHV状态分层时的相对影响。研究结果近日发表于《British Journal of Haematology》。

研究结果
对于整个研究人群(n=536,表1),其中293/522(56%)例为IGHV未突变(UM-IGHV),229例为IGHV突变(M-IGHV)。

每个样本的细胞遗传学异常中位数为1。在319/470(68%)的可评估样本中观察到K染色体异常,包括17%的复杂核型(CK,染色体显带分析中存在≥3个克隆异常), 4%为高CK(高CK定义为≥5个克隆异常)和30%携带易位。FISH分析显示296/503 (59%)携带del(13q), 88/522 (17%)携带tri(12)和114/534 (21%)携带del(11q)。由于特定的纳入标准,没有患者携带del(17p)。在总共1121个突变中,每位患者的基因突变中位数为2个。443/536例(83%)患者中至少有1个突变,其中1个突变117例(22%)、2个突变127例(24%)、≥3个突变199例(37%)。最常见的突变为SF3B1(24%)、NOTCH1(24%)、ATM(18%)、NFKBIE(10%)、KMT2D(8%)、XPO1(7%)、POT1(7%)、EGR2(7%)、PAX5增强子区(7%)、TP53(6%)、BRAF(6%)、IRF4(4%)、FBXW7(4%)和BIRC3(4%)(表1;图1 a)。MYD88和SAMHD1突变主要为克隆事件,而BIRC3、KRAS和NRAS突变为亚克隆事件。
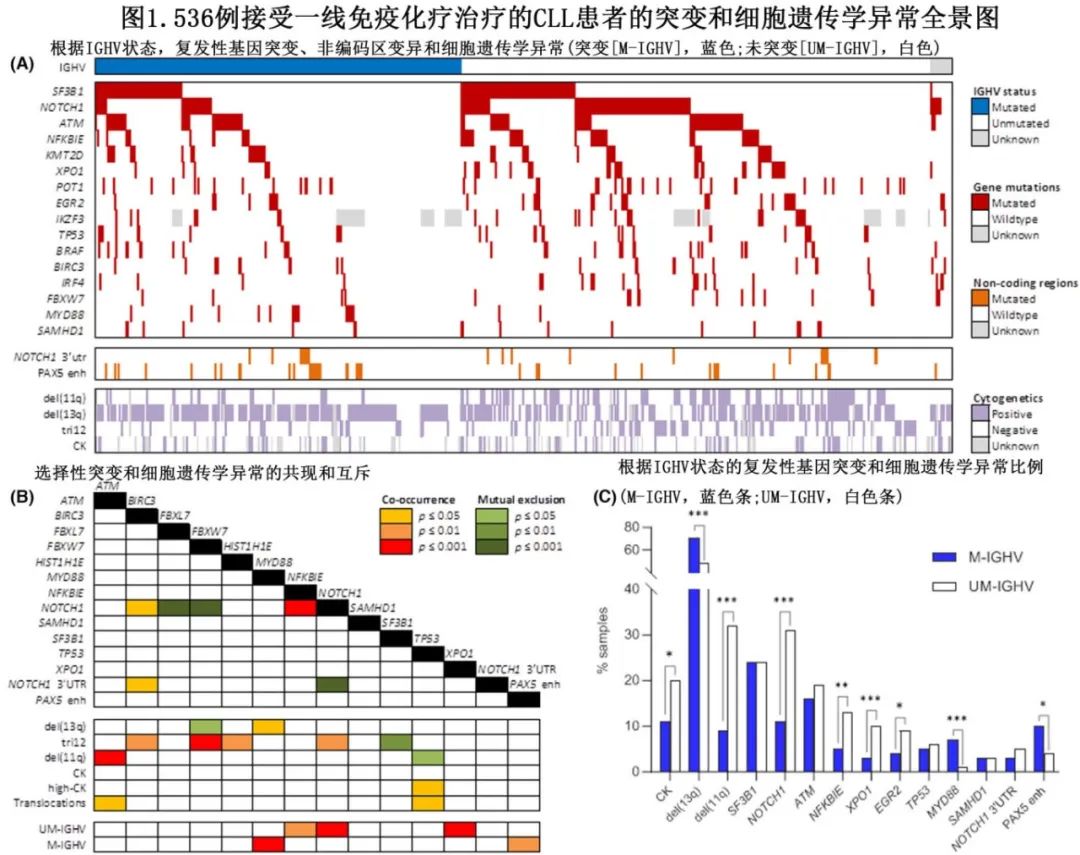
细胞遗传学和分子学特征之间的重要关联如图1B所示。值得注意的是,NOTCH1突变与UM-IGHV (p<0.0001)和tri(p=0.002)相关;FBXW7突变与tri(12)相关(p=0.001);XPO1和NFKBIE突变与UM-IGHV相关 (p分别=0.0007和0.003);ATM突变del(11q)相关(p=0.0005);TP53与高CK相关 (p=0.02);MYD88和PAX5增强子突变与M-IGHV相关 (p=0.0002和p=0.01)。因此,M-IGHV和UM-IGHV亚群的主要细胞遗传学和分子特征频率存在差异,如表1和图1C所示。
整个研究人群的中位随访时间为61个月,5年PFS和OS分别为54%和80%。单因素分析中,与PFS缩短相关的预后因素包括UM-IGHV (p<0.0001)、CK (p=0.003)、del(11q) (p=0.001)、ATM突变(p=0.01)、DNA损伤通路(p<0.0001)、突变数≥3 个(p=0.01),而del(13q)与PFS延长相关(p=0.002);TP53突变患者的PFS有缩短的趋势(p=0.06)。对OS有负面影响的因素包括UM-IGHV (p=0.01)、ATM (p=0.01)、TP53 (p=0.02)、FBXW7 (p=0.002)和IRF4 (p=0.005)突变;Del(13q)与较长的OS相关(p=0.03)。通过多因素分析,UM-IGHV对较短的PFS和OS仍具有预后意义。
具体到M-IGHV亚组(n=229),44%的患者具有正常核型,60%的患者具有孤立del(13q),9%的患者具有孤立del(11q),与UM-IGHV亚组有显著差异(n=293;分别为24%、28%和32%;均p<0.0001)(表1;图1C)。M-IGHV和UM-IGHV之间的突变分布和频率以及改变的通路也不同。M-IGHV亚组最常见的分子学异常为SF3B1(24%)、ATM(16%)和NOTCH1(11%)突变,以及PAX5增强子(10%)变异,而NFKBIE(5%)、EGR2(4%)和XPO1(3%)突变不常见。M-IGHV亚组平均突变数较低,无突变患者比例显著高于M-IGHV亚组(22% vs. 13%,p=0.01)。在接受以氟达拉滨为基础一线方案的M-IGHV患者亚组中,单因素分析(表2,图2)显示,CK、del(11q)、SF3B1和SAMHD1突变及DNA损伤通路与PFS缩短相关。在携带CK和del的患者中观察到最短的PFS (11q),中位PFS分别为53.7个月和52.0个月。除了XPO1突变外,没有分子学或细胞遗传学异常对OS有显著影响,但应该谨慎解释,因为XPO1突变患者的数量较少(n=6)。TP53突变(n=12)对M-IGHV患者的预后没有显著影响。在M-IGHV亚组中,IRF4和FBXW7突变的样本太少(n=4),无法可靠地评估其具体的预后影响。通过多因素分析,只有del(11q)对较短PFS保留预后意义(p=0.005)。
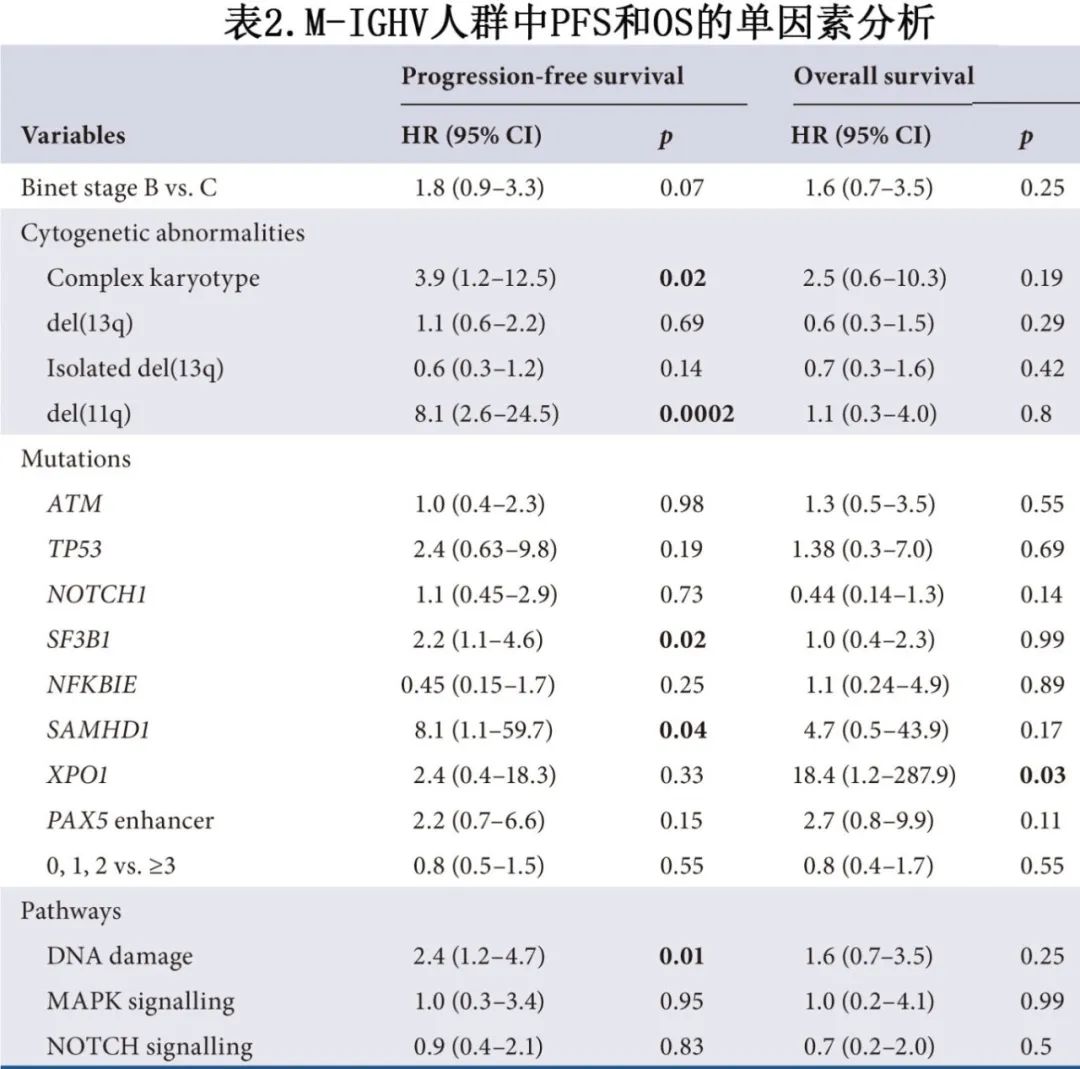
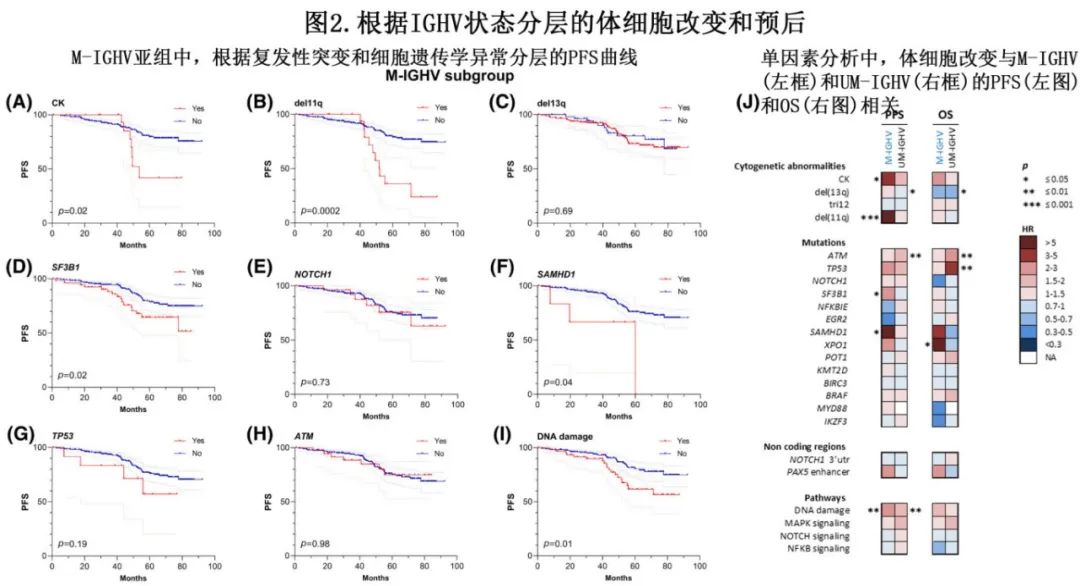
影响预后的细胞遗传学和分子学异常在UM-IGHV亚组中有所不同(图2J)。值得注意的是,CK、del(11q)、SF3B1和SAMHD1突变与M-IGHV较短的PFS相关,但对UM-IGHV亚组没有影响。另一方面,ATM突变导致UM-IGHV的PFS/OS明显缩短,而del(13q)导致UM-IGHV的PFS/OS变长,而M-IGHV中无差异。
总结
在整个队列中,IGHV未突变(UM-IGHV)、复杂核型、del(11q)和ATM突变与较短的无进展生存期(PFS)显著相关。具体到IGHV突变(M-IGHV)患者亚组,单因素分析显示,复杂核型、del(11q)、SF3B1和SAMHD1突变与PFS显著降低相关。预后影响因患者IGHV状态而异,因为这些异常并不影响UM-IGHV亚组的预后。此外TP53突变对M-IGHV亚组的预后没有显著影响。
该研究结果强调,在接受一线CIT治疗的有症状的CLL患者中,基因突变和细胞遗传学异常对预后的影响取决于IGHV状态。对于接受一线BTK和/或BCL2抑制剂治疗的患者,未来需要用分区方法学(考虑IGHV状态)研究基因突变和细胞遗传学异常的预后价值。
参考文献
Nguyen-Khac F, Baron M, Guièze R, Feugier P, Fayault A, Raynaud S, et al.Prognostic impact of genetic abnormalities in 536 first-line chronic lymphocytic leukaemia patients without 17p deletion treated with chemoimmunotherapy in two prospective trials: Focus on IGHV-mutated subgroups (a FILO study).Br J Haematol. 2024;00:1–8. https://doi.org/10.1111/ bjh.19459
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#CLL# #基因异常# #慢性淋巴细胞白血病#
104