胰腺癌(PC)是最具侵略性和致命性的癌症之一。首选治疗方案是根治性手术,但术后预后极差,总体5年生存率不足10%,约80~85%的患者初次确诊时即存在不可切除性或转移性病灶而无根治性手术机会。更令人担忧的是,即使患者在初次确诊时就接受根治性手术治疗,患者术后5年生存率也仅20%左右,因此,医学界称之为“癌中之王”。
80%~90%的胰腺癌起源于腺管上皮的导管腺癌(PDAC), 其它病理类型还包括黏液性囊腺癌、腺泡细胞癌、腺鳞癌、神经内分泌肿瘤等等。胰腺的囊性病变,包括导管内乳头状黏液性肿瘤(IPMNs)被认为是胰腺癌的前兆,但IPMNs与胰腺癌之间的具体作用机制尚不完全清楚。胰腺癌的危险因素复杂多样,主要是个体特征、行为及饮食因素,基因及免疫因素、相关疾病及微生物因素等,但大多仍在探索阶段,需要进一步验证。
近日,瑞典卡罗林斯卡研究所的研究人员在《Gut Microbes》上发表了一篇题为“Isolation ofpancreatic microbiota from cystic precursors of pancreatic cancer withintracellular growth and DNA damaging properties”的论文,他们发现来自消化道的细菌似乎有可能对胰腺细胞造成损害,增加患恶性肿瘤的风险。

https://doi.org/10.1080/19490976.2021.1983101
首次分析活细菌
最近实验动物模型中的研究进一步表明,来自胰腺微生物组的细菌可以代谢癌症药物,降低癌症化疗的效率,促使免疫抑制和增加肿瘤风险。然而,目前对胰腺微生物组的了解大多是通过微生物基因分析获得的,而不是通过对活细菌的功能检查。人类胰腺来源的细菌是否会导致直接的细胞损伤,还未有相关研究数据。
研究团队选取了2018~2019年间29例胰腺囊性肿瘤手术患者的囊性液体,进行培养后发现γ‐变形菌纲(Gammaproteobacteria)和芽孢杆菌(Bacilli)比例过高。进一步研究后发现,细菌是存在于IPMNs中的,24%(7/29)的病例可培养,且菌群可以入侵并在体外的胰腺细胞内存活。这一结果表明,一种潜在的储存器和微生物机制可能存在,即细菌可以在健康和患癌的胰腺组织中持续存在。
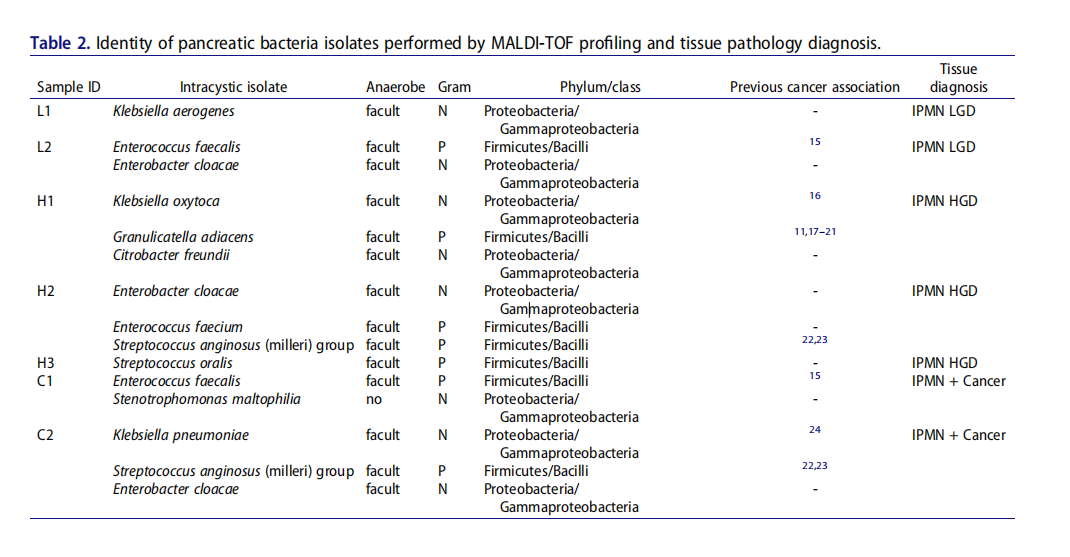
MALDI-TOF分析和组织病理学诊断胰腺细菌分离鉴定。
研究人员通过磷酸化的γH2A.X(pH2A.X)(一种已知的DNA双链断裂和DNA损伤反应激活的标志)和细菌共培后的细胞死亡程度来观察胰腺细胞的损伤。
实验结果表明,在非恶性胰腺细胞中,Granulicatella adiacens H1、肺炎克雷伯菌(K.pneumoniae) C2和阴沟肠杆菌(E. cloacae) C2菌株不仅导致明显的细胞死亡,而且在活细胞群中γH2A.X的磷酸化程度也最大。同样,G. adiacens H1、粪肠球菌(E. faecalis) C1和产酸克雷伯菌(Klebsiella oxytoca) H1菌株也在早期癌症(Capan-2)和晚期分化期癌症(AsPC-1)(恶性)细胞系中引起强烈的pH2A.X增加和细胞死亡,而产气克雷伯氏菌(Klebsiella aerogenes)L1大多引起细胞死亡,特别是在Capan-2细胞中。
与上述菌株不同,咽峡炎链球菌(milleri)组(H2/C2)菌株以及粪肠球菌H2似乎可以使胰腺细胞免受重度损伤。当与AsPC-1细胞共培时,最强的pH2A.X诱导剂是分离自IPMN病例的阴沟肠杆菌C2之中,但这种影响完全可以通过在细菌和细胞共培的开始阶段应用青霉素来预防。
总的来说,IPMN囊肿衍生的细菌能够在健康、早期和晚期癌症的胰腺细胞中造成明显的DNA损伤,但抗生素治疗可能会避免细菌诱导的细胞损伤。
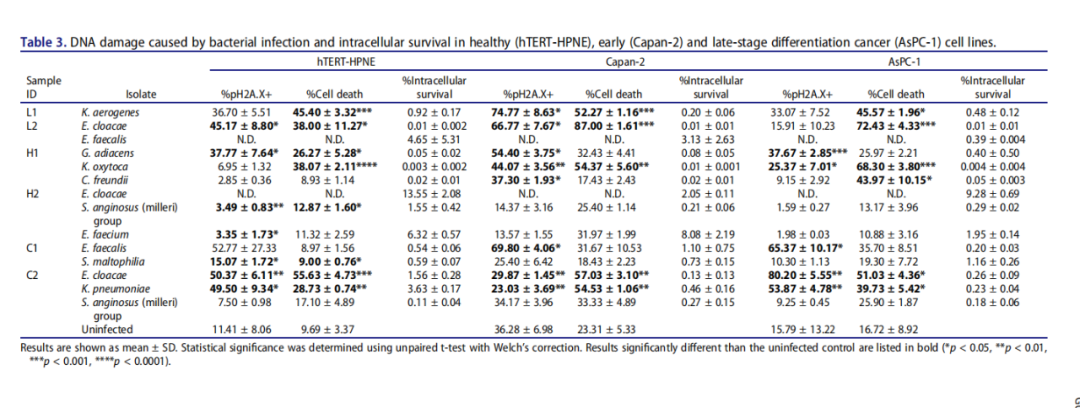
细菌感染引起的DNA损伤和健康(hTERT-HPNE)、早期(Capan-2)和晚期分化期癌症(AsPC-1)细胞系的细胞内生存。
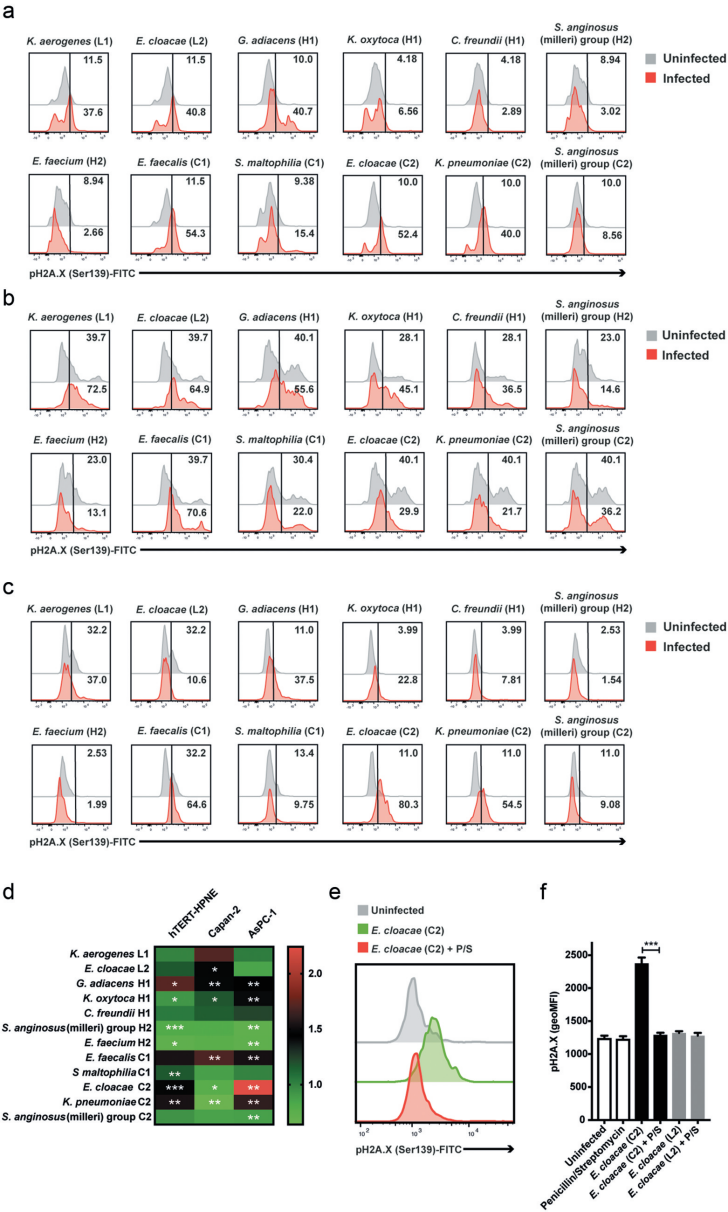
健康(hTERT-HPNE),早期(Capan-2)和晚期分化期癌症(AsPC-1)胰腺细胞系中的细菌分离物感染引起的DNA损伤
《Gut》此前也有相关多项研究发表,胰腺这个以前被认为是无菌的器官,似乎蕴藏着独特的微生物组。2013年美国布朗大学团队通过对比分析 405 例胰腺癌患者、416 例正常人发现胰腺癌患者唾液中牙龈卟啉单胞菌比值明显高于健康人或其他疾病患者,增加对特定共生口腔细菌的抗体水平,可以抑制致病细菌的生长,可能降低胰腺癌的风险,提示牙周病可能会增加患胰腺癌的风险;另一项研究对 10 例患者与 10 例健康人群匹配进行唾液微生物分析,结果发现长形奈氏菌和轻型链球菌在组间有差异。2018年,美国纽约大学医学院通过对比 361 例胰腺癌患者与 371 例健康对照组的口腔洗液也得出牙龈卟啉单胞菌为胰腺癌的危险因素。先前研究提示牙龈卟啉单胞菌、梭形杆菌、 延长奈瑟菌和轻型链球菌是 PDAC癌变所涉及的主要口腔细菌。
虽然细菌是怎么偷偷溜进胰腺,然后又是如何隐藏在胰腺细胞还有待回答。但他们的研究提示对患有IPMNs的患者进行细菌筛查,以及引进抗生素治疗是具有潜在的临床应用价值的,进一步改善胰腺疾病临床诊断和治疗方案可从微生物组分析入手。后续研究可以积极寻找相关细菌对胰腺癌发生、发展的影响,揭示其相互作用机制,以提高疾病诊治与预防效率。
参考资料:
[1]侯志颖,孙早喜,黄海溶.胰腺癌危险因素的研究进展[J].基层医学论坛,2020,24(13):1902-1905.DOI:10.19435/j.1672-1721.2020.13.079.
[2] SiegelRL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021. CA Cancer J Clin2021; 71: 7-33
[3] MICHAUDD S,IZARD J,WILHELMBENARTZIC S,et al. Plasma antibodies to oral bacteria and riskof pancreatic cancer in a large European prospective cohort study[J]. Gut,2013,62(12):1764-1770
[4] FANX,ALEKSEYENKO A V,WU J ,et al. Human oral microbiome and prospective risk for pancreaticcancer:a population-based nested case-control study[J].Gut,2018,67(1):120-127.
[5] FARRELLJ J,ZHANG L,ZHOU H,et al. Variations of oral microbiota are associated with pancreaticdiseases including pancreatic cancer.[J].Gut,2012,112(112):582-588.
[6] Isolationof pancreatic microbiota from cystic precursors of pancreatic cancer withintracellular growth and DNA damaging properties
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#CRO#
68
#Micro#
80
#生存率#
68
#消化道#
80