Cell Discov:争鸣!华东师范大学翁杰敏等合作发现HDAC1/2/3才是主要的组蛋白去琥珀酰化酶
2023-08-22 医药加学习班 医药加学习班 发表于上海
该研究证明I类HDAC1/2/3而不是SIRT家族蛋白是主要的组蛋白去琥珀酰化酶,对启动子组蛋白去琥珀酰化特别重要。因此,该研究为组蛋白琥珀酰化在转录调控中的作用提供了新的线索。
赖氨酸琥珀酰化是发生在组蛋白上的主要翻译后修饰之一,被认为在调节染色质结构和功能方面具有重要作用。目前,组蛋白去琥珀酰化被广泛认为是由SIRT家族去乙酰酶的成员催化的。
2023年8月15日,华东师范大学翁杰敏、Wei Wei及中科院上海药物研究所黄河共同通讯在Cell Discovery 在线发表了题为“HDAC1/2/3 are major histone desuccinylases critical for promoter desuccinylation”的研究论文,该研究揭示HDAC1/2/3是主要的组蛋白去琥珀酰化酶,对启动子去琥珀酰化至关重要。该研究报道了组蛋白去琥珀酰化实际上主要由I类HDAC1/2/3催化。HDAC1/2/3的抑制或缺失导致全局组蛋白琥珀酰化的显著增加,而HDAC1/2/3的异位表达但不是其脱乙酰酶失活突变体下调全局组蛋白琥珀酰化。
该研究证明I类HDAC1/2/3复合物在体外具有强大的组蛋白去琥珀酰化酶活性。基因组景观分析显示,组蛋白琥珀酰化在基因启动子处高度富集,HDAC活性的抑制导致启动子组蛋白琥珀酰基化的显著升高。此外,综合分析显示,启动子组蛋白琥珀酰化与基因转录活性呈正相关。总之,该研究证明I类HDAC1/2/3而不是SIRT家族蛋白是主要的组蛋白去琥珀酰化酶,对启动子组蛋白去琥珀酰化特别重要。因此,该研究为组蛋白琥珀酰化在转录调控中的作用提供了新的线索。

赖氨酸琥珀酰化(Ksu)是在赖氨酸的ε-氨基上添加琥珀酰基。作为最近出现的赖氨酸酰化反应的一员,包括丙酰化、丁酰化、巴豆酰化等,Ksu已在从原核生物到人类的广泛蛋白质中被鉴定。Ksu需要供体琥珀酰辅酶A,并且以酶促或非酶促的方式发生。尽管Ksu在琥珀酸辅酶A浓度相对较高的线粒体中高度富集,但琥珀酸辅酶A在核区室中也很丰富,组蛋白对Ksu的修饰是众所周知的。由于琥珀酰化不仅中和赖氨酸的正电荷,还带来负电荷和庞大的侧链,Ksu被认为对染色质结构和功能的影响比乙酰化和甲基化更强。为了支持这一观点,多项体外生物化学研究表明,Ksu有力地促进DNA解开、核小体不稳定性和转录激活。
虽然线粒体中的琥珀酰化可能是一种非酶促事件,但一些组蛋白乙酰转移酶已被证明能催化组蛋白上的位点特异性Ksu。例如,KAT2A和HAT1已被证明分别催化H3K79和H3K122琥珀酰化。此外,CBP/p300也被证明能对组蛋白进行琥珀酰化。在功能上,组蛋白琥珀酰化已被证明可以促进转录、肿瘤细胞增殖和肿瘤发展。
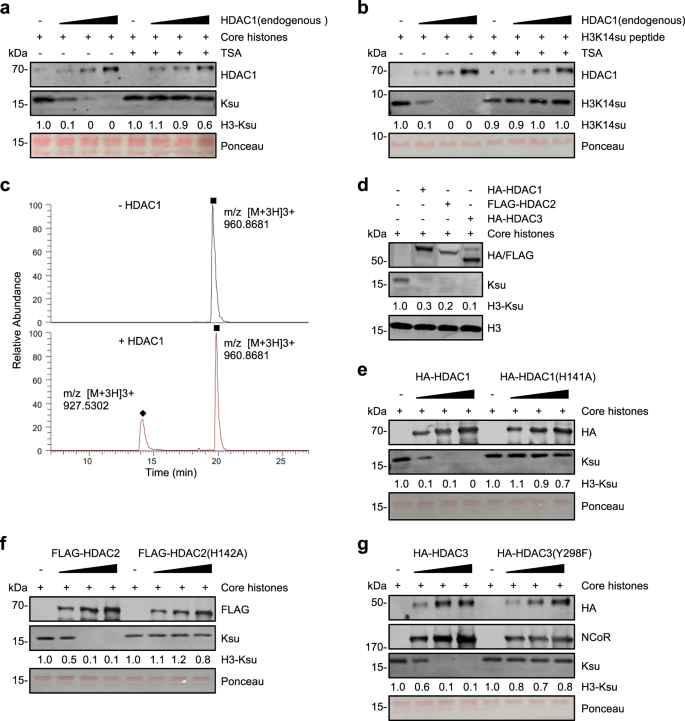
HDAC1/2/3 在体外进行组蛋白去琥珀酰化(图源自Cell Discovery )
与其他赖氨酸修饰一样,Ksu也是一种动态修饰。直到SIRT5(Sirtuin家族NAD+依赖性脱乙酰酶的一个成员)被鉴定为迄今为止第一个也是唯一一个主要的去琥珀酰化酶,Ksu的生物学功能才被人们所知。SIRT5也因其赖氨酸去甲酰化酶和去乙酰基化酶活性而闻名,但具有非常弱的去乙酰基酶活性。SIRT5主要存在于线粒体中。一致地,SIRT5的缺失导致多种线粒体蛋白的高度琥珀酰化,并且许多SIRT5底物参与代谢途径,如脂肪酸代谢和TCA循环。SIRT5主要基于体外研究,被认为是组蛋白去琥珀酰化的酶。最近,SIRT7被报道催化H3K122去琥珀酰化。然而,SIRT家族脱乙酰酶是否负责体内大量组蛋白去琥珀酰化,以及组蛋白琥珀酰化是如何动态调节的,目前尚不清楚。
该研究发现,I类HDAC(HDAC1/2/3)而不是SIRT家族成员是体内主要的组蛋白去琥珀酰化酶。哺乳动物中的组蛋白脱乙酰酶由两个大家族组成,即Zn2+依赖性HDAC家族(HDAC 1–11)和NAD+依赖性SIRT家族(SIRT 1–7)。11种HDAC进一步分为I类(HDAC 1–3和8)、IIa类(HDAC4、5、7和9)、IIb类(HDAC-6和10)和IV类(HDACM11)。HDAC1/2/3存在于大的辅阻遏物复合物中,并代表细胞中的大量HDAC活性。HDAC1/2/3对组蛋白去羰基化、去β-羟基丁基化和脱乙酰基化也有活性。与之前所有重组HDAC对组蛋白去琥珀酰化无活性的体外测定相反,该研究发现哺乳动物HDAC1/2/3复合物在体外具有强大的组蛋白去琥珀酰化酶活性。该研究还提供了HDAC8在体外缺乏内在组蛋白去琥珀酰化酶活性的证据。该研究进一步证明,组蛋白琥珀酰化在基因启动子处高度富集,启动子组蛋白琥珀酰基化水平与转录活性呈正相关。
原文链接:
https://www.nature.com/articles/s41421-023-00573-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言