Cell death dis:胶质母细胞瘤干细胞迁移的关键分子靶标——Rap1a
2020-03-17 MedSci原创 MedSci原创
作为一种最常见的原发性恶性脑肿瘤,胶质母细胞瘤(GBM)一般是由于肿瘤细胞浸润到邻近的脑实质中而产生的。但是目前针对该疾病的靶向治疗手段仍然有限。在之前的研究中,虽然自我更新的癌症干细胞(CSC)及其
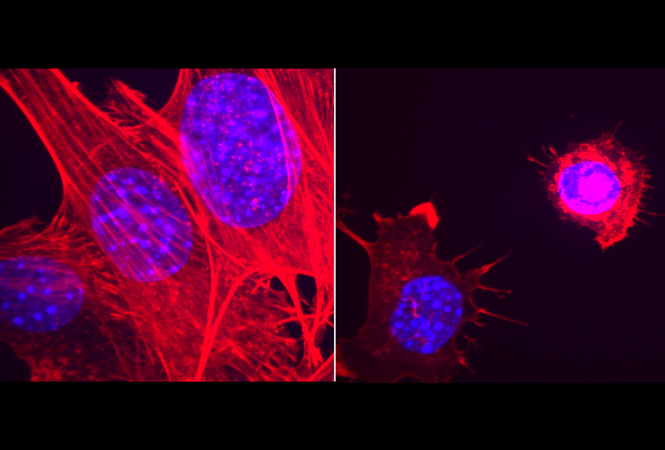
在该研究中,研究人员主要使用了活细胞显微镜实时成像培养系统来评估CSC的迁移能力,以确定迁移过程中的关键调控因素。而直接迁移实验则发现CSC细胞比非CSC细胞更具有侵袭性。而活细胞显微镜实时成像培养系统研究进一步发现,GBM患者来源的CSC细胞模型主要以集落或单细胞的方式进行迁移。
为了研究调控集落细胞浸润的保守性分子调节因子,研究人员采用了遗传上易编辑的果蝇边缘细胞集落迁移模型。通过靶向果蝇遗传筛选,并结合GBM肿瘤中的人同源基因的基因表达分析结果及与之相关的GBM患者预后分析,进而得到供下一步功能研究的候选基因。而这一实验策略也确定了高度保守的小GTP酶Rap1a为细胞浸润过程的潜在调节因子。
Rap1a的活性改变能够损害在发育过程中果蝇边缘细胞的生长发育。而在GBM中Rap1a的表达水平升高,且与更高的肿瘤等级相关。功能上研究发现,活化的Rap1a的水平能够影响CSC从肿瘤微球中迁移至胞外间质的速度。
以上的研究数据表明,CSC相比于非CSC具有更强的侵袭性,其能够以集落和单细胞的方式进行迁移,并表达癌细胞迁移和浸润所需的相关保守基因。同时也证实了Rap1a在胶质母细胞瘤中癌症干细胞的迁移过程中所充当的作用。
Volovetz et al.Identifying conserved molecular targets required for cell migration of glioblastoma cancer stem cells. Cell Death and Disease ( 2020) 11:152
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











已拜读,受益匪浅。
82
#Dis#
63
#CEL#
63
#Rap1a#
62
#Cell#
71
#胶质母细胞#
57
#RAP1#
63
#母细胞瘤#
59
#迁移#
69
干细胞是热点,但是进入临床仍然需要时间和临床疗效验证哦
75