苏州大学曹建平/四川大学张舒羽揭示四氢生物蝶呤代谢调控放射性肺损伤进展新机制
2024-05-07 BioMed科技 BioMed科技 发表于上海
该研究阐明了四氢生物蝶呤代谢在辐射诱导的ROS生成和放射敏感性中的关键作用,为放射性肺损伤防治提供了新的干预策略。
放射治疗(简称放疗)已成为治疗恶性肿瘤最重要的手段之一,但是放射治疗也存在毒副作用。放射性肺损伤是胸部肿瘤放疗常见的并发症,严重影响患者的心肺功能及生活质量。放射性肺损伤发病机制尚不完全明确,目前临床上尚无靶点明确的特异性防治策略。因此,进一步阐明放射性肺损伤进展的分子机制,并寻找有效临床干预策略和防治药物靶点,对放射性肺损伤患者预后的改善具有重要意义。
2024年5月1日,苏州大学苏州医学院放射与防护学院曹建平教授团队联合四川大学华西基础医学与法医学院张舒羽教授团队在Experimental And Molecular Medicine杂志发表了题为“Tetrahydrobiopterin metabolism attenuates ROS generation and radiosensitivity through LDHA S-nitrosylation: novel insight into radiogenic lung injury”的文章,该研究以多种肺细胞辐射损伤模型及肺特异性敲除Gch1的小鼠和肺特异性敲入Gch1模型为研究对象,阐明了四氢生物蝶呤(Tetrahydrobiopterin,BH4)代谢在辐射诱导的ROS生成和放射敏感性中的关键作用,为放射性肺损伤防治提供了新的干预策略。
电离辐射会诱导ROS产生,并导致正常组织发生氧化损伤。确定ROS产生的机制对于阐明组织的辐射敏感性以及对保护氧化损伤非常重要。BH4是一氧化氮合(NOS)的重要辅助因子,由GTP经过限速酶GTP环化水解酶1(GTP cyclohydrolase 1,GCH1)等催化产生。BH4在抗肿瘤方面发挥着重要的作用,2018年Natuer报道通过GCH1过表达增强BH4水平可增强表达CD4-和CD8-的T细胞的应答,增强其体内抗肿瘤活性[1]。该研究团队前期发现Nrf2/GCH1轴参与辐射诱导的ROS产生从而参与放射性皮肤损伤的进展[2],该报道提出辐射诱导的ROS产生被认为是NOS解偶联的结果[2]。多项研究表明GCH1/BH4轴对辐射损伤防治具有重要意义[3-6]。

1. 电离辐射降低GCH1的表达,破坏BH4合成,干扰NO的稳态
为了确定电离辐射对BH4相关代谢途径的潜在影响,作者在HELF和BEAS-2B肺细胞和大鼠肺组织中检测GCH1、PTPS和SR的表达,发现辐射降低GCH1的表达,并呈剂量依赖性,但PTPS或SR的表达几乎没变化。为了模拟放疗,给予肺细胞分次照射(10 Gy/5次,每天1次),分次照射也降低了GCH1表达,但没有降低PTPS或SR表达。
BH4作为NOS的重要辅因子,很容易被氧化成BH2等衍生物。电离辐射后BH4水溶液或大鼠肺组织BH4/BH2比值明显降低,肺细胞中NOS活性降低,重要的是,辐照降低eNOS蛋白水平,但iNOS和nNOS蛋白水平几乎没变化。并且受照的HELF和BEAS-2B细胞中的NO水平显著降低。上述结果表明,电离辐射破坏了BH4的合成,从而干扰NO的稳态(图1a-1g)。
2. BH4合成减少,致使eNOS解耦联
缺乏BH4导致NOS解偶联,产生ROS。因此,作者研究了辐射诱导的ROS是否受GCH1或其代谢物BH4的调节。通过NO及ROS实验,发现过表达GCH1或外源性补充BH4可以显著增加受照肺细胞中NO的产生,并且降低了电离辐射诱导的HELF和BEAS-2B细胞中的ROS水平。
BH4是NOS必需辅因子。接下来,作者研究了GCH1/BH4轴是否通过抑制NOS解偶联来调控辐射诱导的ROS。在HELF和BEAS-2B细胞中,过过表达GCH1或补充BH4减少辐射诱导的ROS的这一作用被NOS抑制剂L-NMMA或L-NAME所消除。上述结果表明,NOS活性在GCH1/BH4减少受照肺细胞中ROS的产生这一过程中发挥着至关重要的作用(图1h-1n)。
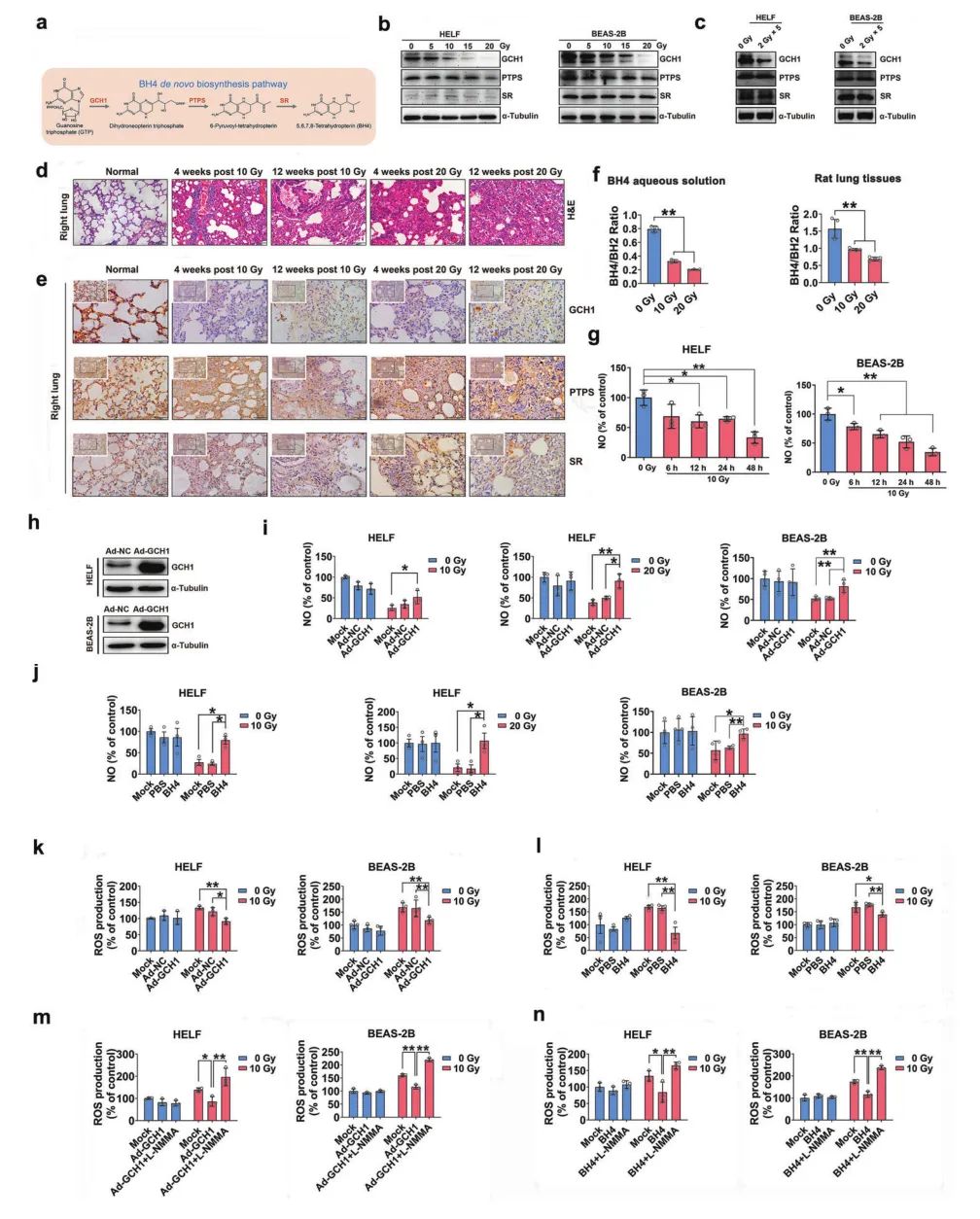
图1 BH4通过减少NOS解偶联和恢复NO水平来抑制辐射诱导的ROS的产生
3. BH4减少肺细胞辐射损伤
为了研究GCH1/BH4对受辐照肺细胞的保护作用,作者进行了一系列体外研究。通过细胞活力、集落形成分析以及LDH释放实验发现GCH1/BH4处理增加受照肺细胞的细胞活力、增加克隆形成率,减少细胞死亡。综上所述, GCH1/BH4显著减轻受辐照的肺细胞损伤(图2a-2f)。
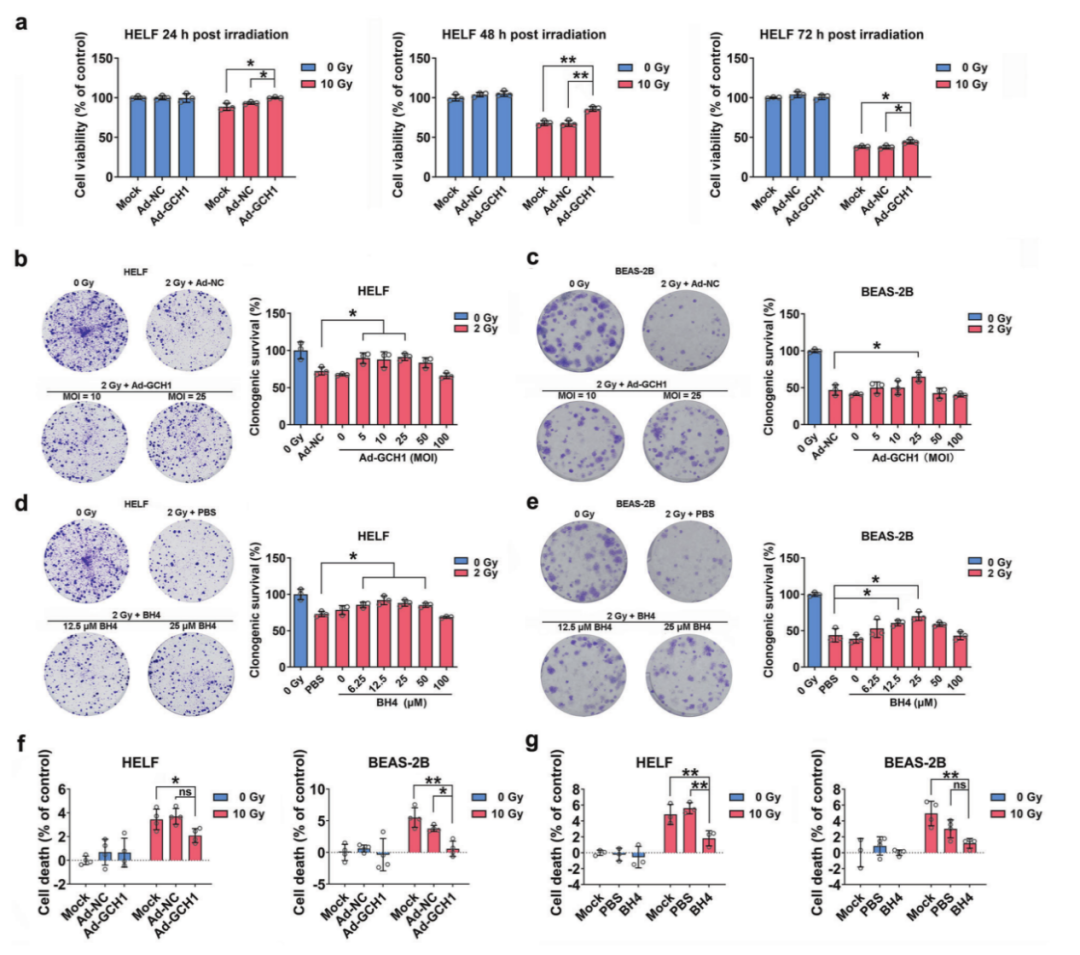
图2 BH4保护肺细胞免受辐射损伤。
4. GCH1代谢参与调控小鼠放射性肺纤维化
作者构建了野生型小鼠(Gch1fl/fl小鼠)和肺特异性敲除Gch1的小鼠(Gch1fl/fl;Sftpa1-Cre+/-,Gch1-CKO小鼠),使用15 Gy X射线照射小鼠全胸,照后90天,Gch1-CKO小鼠的体重明显下降,并且其生存期明显少于野生型小鼠。重要的是,GCH1敲除后明显发生肺纤维化,肺组织中α-SMA和COL-1的表达明显升高。为了进一步证实GCH1在放射性肺纤维化中的作用,进一步构建了肺特异性敲入Gch1的小鼠(Gch1lsl/lsl;Sftpa1-Cre+/-小鼠,Gch1-CKI小鼠)。辐照后Gch1-CKI小鼠的体重和存活时间明显高于野生型小鼠,并且肺组织纤维化病变少于野生型小鼠的肺组织,同时减少了α-SMA和COL-1的表达,表明GCH1在辐射诱导的肺纤维化中起重要作用(图3a-3n)。
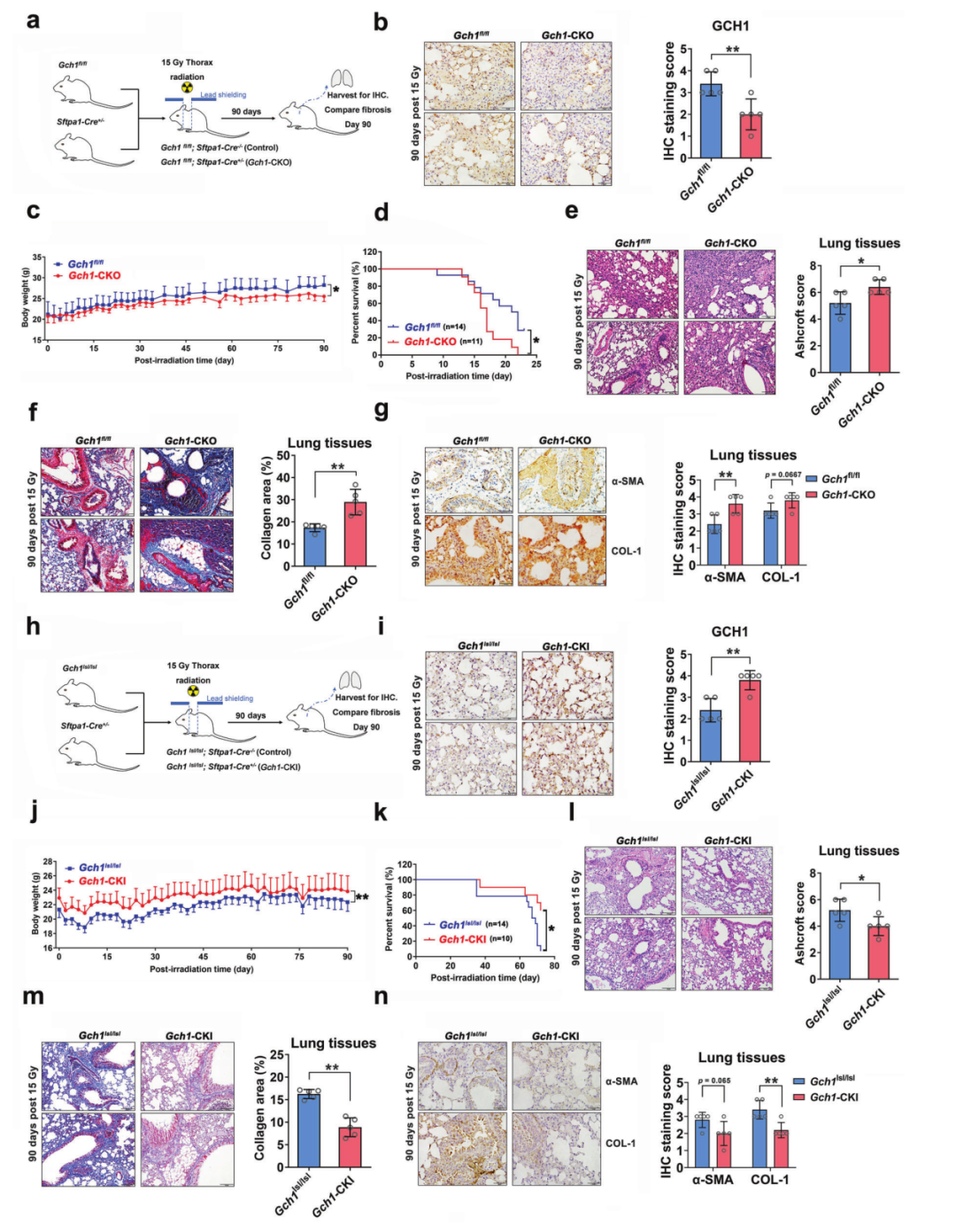
图3 GCH1减轻辐射诱导的肺纤维化
5. BH4通过影响LDHA S-亚硝基化调控ROS生成
由于NO稳态已被证明可以调节蛋白质S-亚硝基化,作者通过基于碘乙酰基串联质量标签(iodoTMT)的蛋白质定量检测小鼠肺组织的蛋白质S-亚硝基化谱。在122个蛋白中共鉴定出194个S-亚硝基化位点,其中107个蛋白鉴定出167个S-亚硝基化位点。通过S-亚硝基修饰组学,发现BH4水平与蛋白S-亚硝基化有关。作者在S-亚硝基化在辐射后减少,在补充BH4后恢复的蛋白质中筛选出3个重要的修饰蛋白,包括含黄素二甲基苯胺单加氧酶1 (Fmo1)、乳酸脱氢酶A (LDHA)和黄嘌呤脱氢酶(Xdh)。
LDHA是一种氧化还原相关酶,通过与NADH的相互作用参与ROS的产生。因此,作者对该蛋白及其S-亚硝基化进行了更详细的研究。小鼠LDHA的Cys293和Cys163位点发生S-亚硝基化。通过生物素开关实验进一步验证LDHA的S-亚硝基化在体外对辐射和BH4的响应,发现在辐照的HELF细胞中,LDHA的S-亚硝基化减少,而在BH4处理的细胞和Ad-GCH1感染的细胞中,LDHA的S-亚硝基化部分恢复。
为了证明LDHA S-亚硝基化在ROS生成中的作用,作者利用CRISPR/Cas9技术构建了LDHA敲除(KO) BEAS-2B细胞。作者发现,LDHA KO显著抑制辐射诱导的ROS生成,而BH4补充并没有进一步降低LDHA KO细胞中辐射诱导的ROS水平,表明LDHA是辐射源性ROS生成的下游效应物。与这些发现一致,辐照后LDHA沉默消除了GCH1抑制剂DAHP预处理诱导的ROS生成增加。
前文表明,NOS活性在GCH1/BH4减轻辐射诱导的ROS这一过程中发挥着重要作用。接下来,作者探索了LDHA和NOS对ROS生成的调节作用。作者发现LDHA KO通过L-NMMA降低了ROS的增加。此外,在存在或不存在辐射的情况下,LDHA KO都不会影响NO的产生。这些发现进一步表明LDHA位于BH4和NOS的下游。
构建LDHA野生型及单位点或双位点突变体 (C163A或C293A或同时突变(2C-A))的质粒并转染LDHA KO BEAS-2B细胞。生物素开关实验显示,Cys163和Cys298的突变消除了LDHA的S-亚硝基化,并且LDHA S-亚硝基化突变后ROS生成增加,这表明LDHA中S-亚硝基化的缺失促进了ROS的产生。LDHA的核易位已被证明可以激活抗氧化反应,我们发现辐照后LDHA从细胞质转移到细胞核,而LDHA S-亚硝基化双突变降低了LDHA核易位。重要的是,LDHA S-亚硝基化的缺失降低了细胞存活率。这些结果表明,LDHA S-亚硝基化可以削弱ROS的生成能力,从而提高细胞存活率(图4a-4r)。
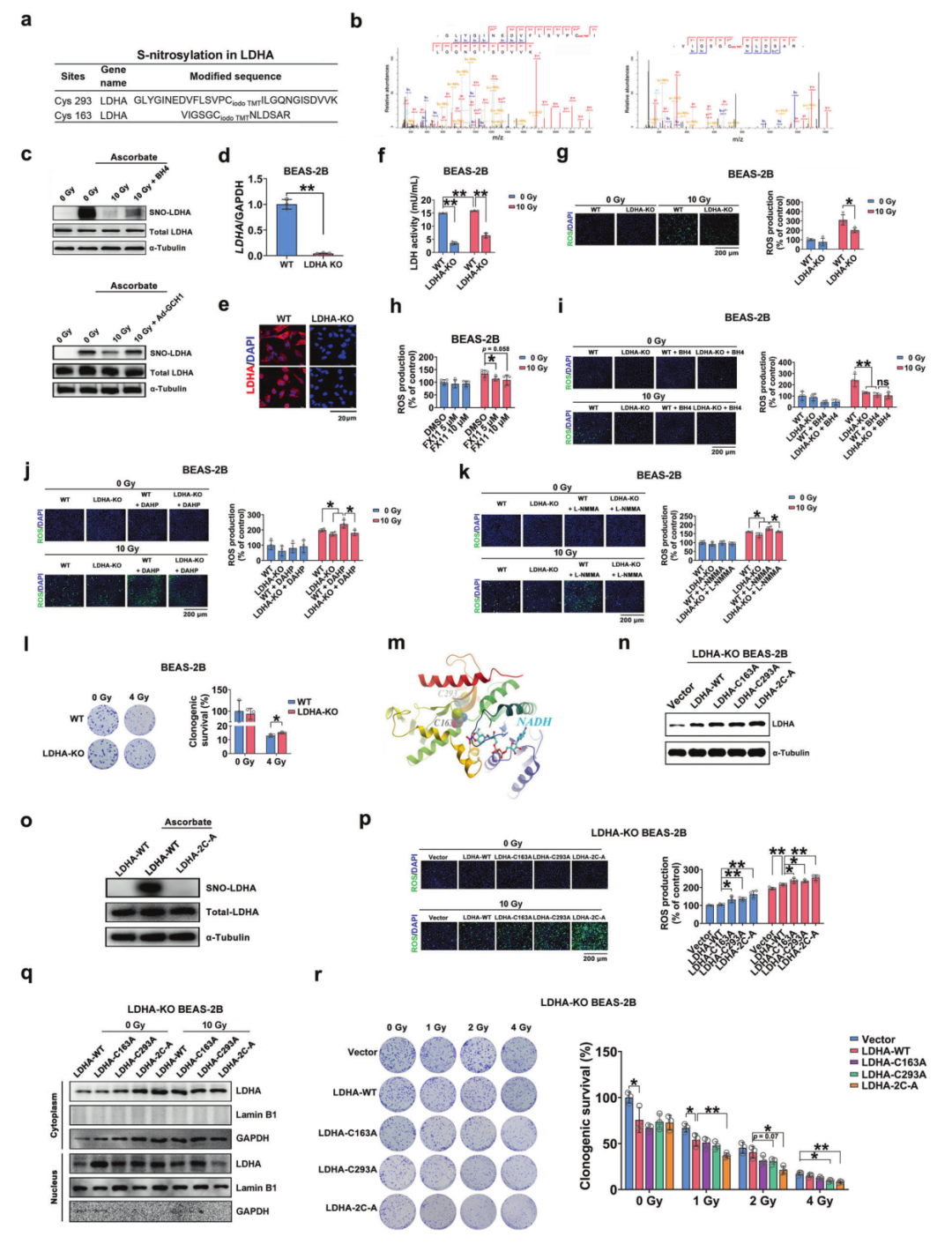
图4 LDHA通过S-亚硝化介导BH4产生ROS
5. 总结
综上所述,该研究发现电离辐射通过BH4的稳定性从而减少了LDHA S-亚硝化,促进了ROS级联效应(图5)。该研究揭示了GCH1/BH4介导的LDHA S-亚硝化在ROS生成和肺细胞放射敏感性中的新的关键作用,为改善放射性肺损伤提供了新的策略。
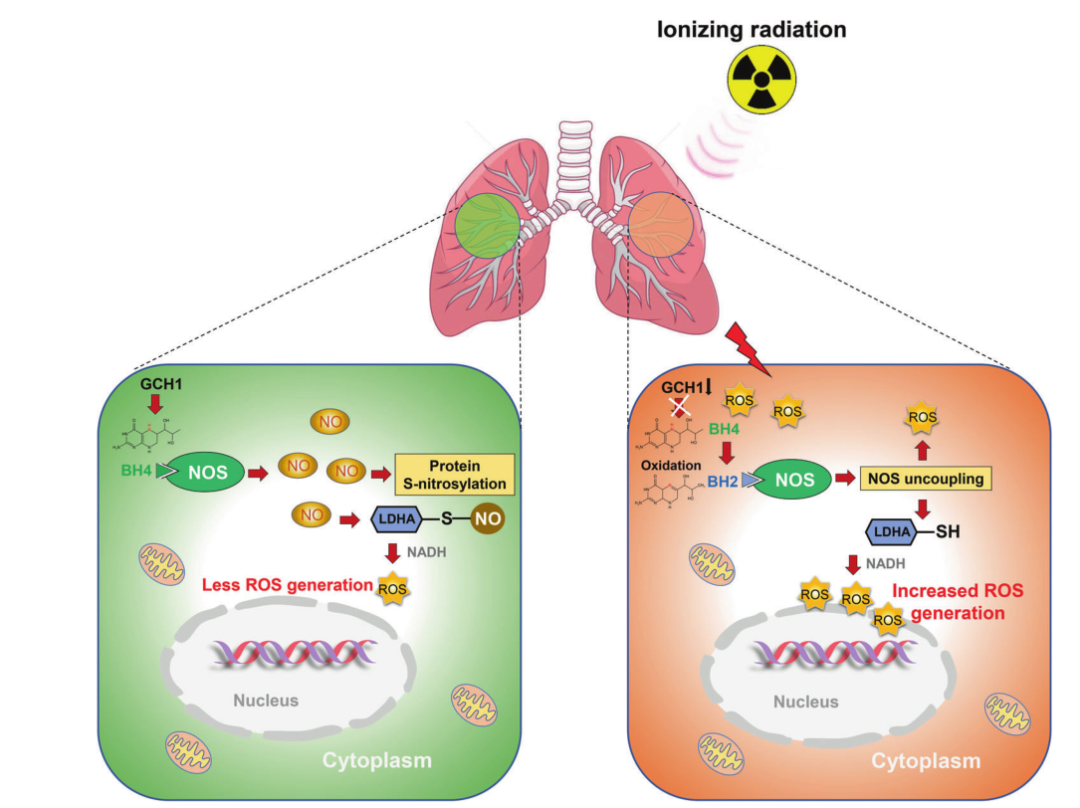
图5 GCH1介导的BH4在ROS生成过程中的示意图
苏州大学苏州医学院放射与防护学院曹建平教授、四川大学华西基础医学与法医学院张舒羽教授为本文共同通讯作者,苏州大学苏州医学院放射与防护学院博士研究生冯阳(现就职于江南大学附属中心医院)为本文第一作者。本研究受到国家自然科学基金联合基金重点项目、国家自然科学基金面上项目和四川省杰出青年科学基金等项目资助。
参考文献:
1.Cronin S, Seehus C, Weidinger A, et al. The metabolite BH4 controls T cell proliferation in autoimmunity and cancer. Nature 2018;563(7732):564-568.
2.Xue J, Yu C, Sheng W, et al. The Nrf2/GCH1/BH4 Axis Ameliorates Radiation-Induced Skin Injury by Modulating the ROS Cascade. J Invest Dermatol 2017; 137(10): 2059-2068.
3.Feng Y, Feng Y, Gu L, et al. The Critical Role of Tetrahydrobiopterin (BH4) Metabolism in Modulating Radiosensitivity: BH4/NOS Axis as an Angel or a Devil. Front Oncol 2021; 11: 720632.
4.Yan T, Zhang T, Mu W, et al. Ionizing radiation induces BH(4) deficiency by downregulating GTP-cyclohydrolase 1, a novel target for preventing and treating radiation enteritis. Biochem Pharmacol 2020; 180: 114102.
5.Yan T, Guo S, Zhang T, et al. Ligustilide Prevents Radiation Enteritis by Targeting Gch1/BH(4)/eNOS to Improve Intestinal Ischemia. Front Pharmacol 2021; 12: 629125.
6.Thabet N M, Rashed E R, Abdel-Rafei M K, et al. Modulation of the Nitric Oxide/BH4 Pathway Protects Against Irradiation-Induced Neuronal Damage. Neurochem Res 2021; 46(7): 1641-1658.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#四氢生物蝶呤# #放射性肺损伤#
35