多发性骨髓瘤骨病变生物学及治疗进展
2011-07-14 杨励、蔡真 医学论坛报
多发性骨髓瘤(MM)是发生于骨髓浆细胞的恶性肿瘤,可导致骨破坏和骨髓衰竭。近年来,随着如硼替佐米、沙利度胺和来那度胺等新药的问世,MM的治疗取得了突破性进展。同时,对骨髓微环境的认识也为治疗与新药研发提供了依据。但现有的治疗手段仍无法治愈MM,因此须不断优化治疗手段,包括对疾病本身的治疗及旨在提高生活质量的支持治疗。 多发性骨髓瘤骨病的生物学特点 图1 A:正常情况下骨内稳态;B:
多发性骨髓瘤(MM)是发生于骨髓浆细胞的恶性肿瘤,可导致骨破坏和骨髓衰竭。近年来,随着如硼替佐米、沙利度胺和来那度胺等新药的问世,MM的治疗取得了突破性进展。同时,对骨髓微环境的认识也为治疗与新药研发提供了依据。但现有的治疗手段仍无法治愈MM,因此须不断优化治疗手段,包括对疾病本身的治疗及旨在提高生活质量的支持治疗。
多发性骨髓瘤骨病的生物学特点
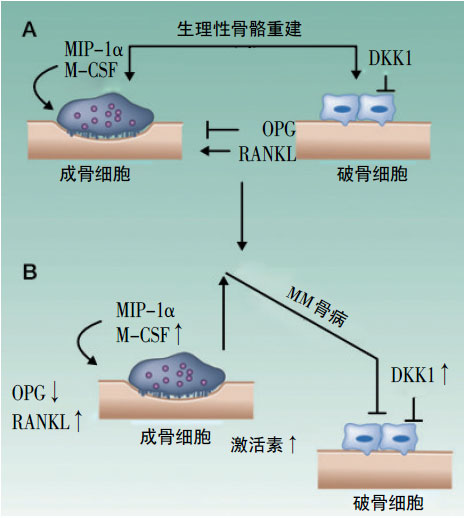
图1 A:正常情况下骨内稳态;B:骨髓瘤骨重建生物学基础。
骨病是MM的特征性病变,80%的MM患者会有骨破坏,表现为弥漫性溶骨性损害。MM骨病生物学基础涉及破骨细胞-成骨细胞轴稳态的破坏,利于骨吸收并抑制新骨形成而导致溶骨性病变。正常情况下,成骨细胞、破骨细胞维持骨髓的内稳态(图1A)。在MM中,骨髓瘤细胞通过直接分泌破骨细胞激活因子、间接刺激骨髓基质细胞分泌核因子κB 受体活化因子配体(RANKL)、激活素等促进破骨细胞分化,并通过降低骨保护素(OPG)、提高DKK1表达等抑制成骨细胞分化(图1B)。骨髓瘤细胞与骨髓基质细胞间的相互作用涉及很多细胞因子,包括白介素(IL)-6、RANKL/OPG、B 细胞激活因子(BAFF)、趋化因子配体(CCL)3/巨噬细胞炎症蛋白(MIP)-1α等。Tian等发现,DKK1在MM骨病患者骨髓中高表达,且与早期骨病相关;RANKL、OPG是破骨细胞功能的重要调节枢纽,Giuliani等发现,骨髓瘤浆细胞RANKL水平上升、OPG水平下降,从而导致RANKL/OPG比例异常;而Seidel证实,低水平OPG与MM溶骨性病变相关。CCL3由破骨细胞及骨髓瘤细胞分泌,Terpos等发现,高水平CCL3 也与骨髓瘤患者生存期及溶骨性病变相关,CCL3/趋化因子受体(CCR)1途径可诱导异常浆细胞的生长及趋化,促进破骨细胞前体细胞的迁移等。此外,其他破骨细胞激活因子IL-1、IL-6、IL-3、IL-7、CCL20、IL-8、激活素A、肝细胞生长因子、血管内皮细胞生长因子(VEGF)和巨噬细胞集落刺激因子(M-CSF)等也在MM骨病中发挥重要作用。最近,Hiruma等发现,p62 作为丝裂原活化蛋白激酶(p38MAPK)和核因子κB(NF-kB)信号途径的上游调节因子,可通过骨髓瘤细胞与基质细胞间的粘附作用被激活,抑制p62可抑制破骨细胞分化及骨髓瘤细胞增殖。
骨骼相关事件,包括脊椎压缩性骨折、高钙血症、病理性骨折、剧痛,是造成MM患者生活质量和功能状态受限的主要原因。随着MM患者生存期的延长,MM骨病的治 疗已成为提高患者生活质量的重要举措。迄今为止,MM骨病治疗方法包括双膦酸盐治疗、放疗和外科手术,这些均以预防骨骼相关事件、延缓溶骨性病变发展及缓解疼 痛为目标。
多发性骨髓瘤骨病的治疗现状
双膦酸盐双膦酸盐是目前治疗MM骨病的主要药物,2010年,美国国立综合癌症网络(NCCN)推荐对所有患者包括骨质疏松患者应用双膦酸盐(1类)。临床上,使用帕米膦酸和唑来膦酸可预防骨相关事件并减轻骨痛。但长期使用双膦酸盐可出现少见但严重的并发症,主要包括肾功能不全和下颌骨坏死。目前对双膦酸盐的使用策略主要基于维持其药效及降低副作用。
针对靶位点的新型药物针对MM 骨病,研究者提出了一些治疗新思路,不仅针对骨髓瘤细胞,更着重于细胞因子网络调节、细胞信号传导和骨髓微环境等对骨髓瘤细胞增殖和分化的调节作用。这些新药不仅可恢复成骨和破骨细胞的内稳态,还可抑制肿瘤的生长。
RANKL中和抗体denosumab已成功用于MM 骨病治疗。一项Ⅲ期临床试验显示,denosumab在降低骨骼相关事件上与唑来膦酸同样有效。Denosumab副作用更小,并可更持续地抑制骨吸收,对双膦酸盐治疗不敏感患者亦有效。研究证实,CCL3抑制剂可延缓骨病发展并抑制肿瘤的生长。
临床前期试验显示,口服CCR1 抑制剂MLN3897 可抑制破骨细胞的形成及增殖。抗BAFF 中和抗体LY2127355 可显著减低肿瘤负荷,减少溶骨性病变数量并抑制破骨细胞分化。嵌合抗体RAP-011可特异性抑制激活素并有效抑制肿瘤生长。研究发现,RAP-011/ACE-011 可有效抑制绝经后女性的骨吸收并刺激骨形成,但其在MM中 的作用正处于Ⅰ/Ⅱ 期临床研究阶段。

图2 骨髓瘤骨病变新药靶点
DKK1拮抗剂可促进成骨细胞分化,增加其数量并减少骨病,抑制肿瘤生长(图2)。沙利度胺类似物可抑制破骨细胞分化,通过直接或间接改变肿瘤微环境影响骨髓瘤细胞的生长。PU.1是单核细胞分化至破骨细胞的前期转录因子,来那度胺可下调其在破骨细胞前体细胞中的表达,抑制骨髓基质细胞分泌RANKL,恢复RANKL/OPG 比 值。硼替佐米可通过抑制骨髓瘤细胞与骨髓基质细胞间的作用来影响破骨细胞的形成,并促进间充质干细胞分化为成骨细胞,从而调节骨重建。
此外,研究者发现,特异性抑制与骨髓瘤细胞生存、生长相关的信号途径可发挥抗MM 作用。MAPK 信号途径抑制剂,如细胞外信号调节激酶(ERK)和p38 抑制剂,可阻断破骨细胞分化,减少其数量,抑制肿瘤生长。热休克蛋白(HSP)90 抑制剂SNX-2112对骨髓微环境具有多重作用,并通过下调ERK、转录因子c-Fos 和PU.1 介导抗破骨细胞作用。
展望
目前,针对骨病新靶位的药物正处于临床研究阶段,药物的联合应用亦是研究热点,包括BAAF抑制剂和硼替佐米、DKK1中和抗体和双膦酸盐等。恢复骨髓瘤骨内稳态、克服溶骨性病变、改善骨髓瘤生长的微环境是今后研究的方向。未来的研究将侧重于这些药物的优化选择与联合应用,充分利用其抗肿瘤活性,同时减轻骨病变相关发病率及死亡率。
注:本文摘译自Advances in the Biolo⁃gy and Treatment of Bone Disease in MultipleMyeloma(Clin Cancer Res 2011, 17: 1278~1286)。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#多发性#
73
#多发性骨髓瘤骨病#
78
#生物学#
92